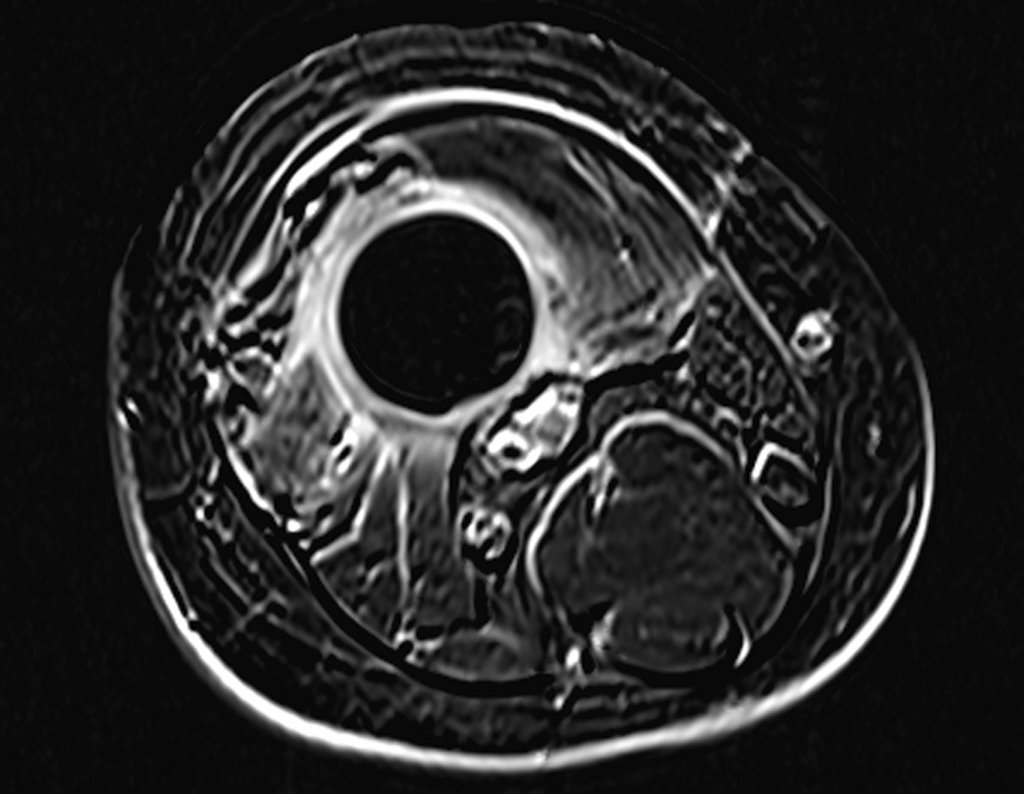
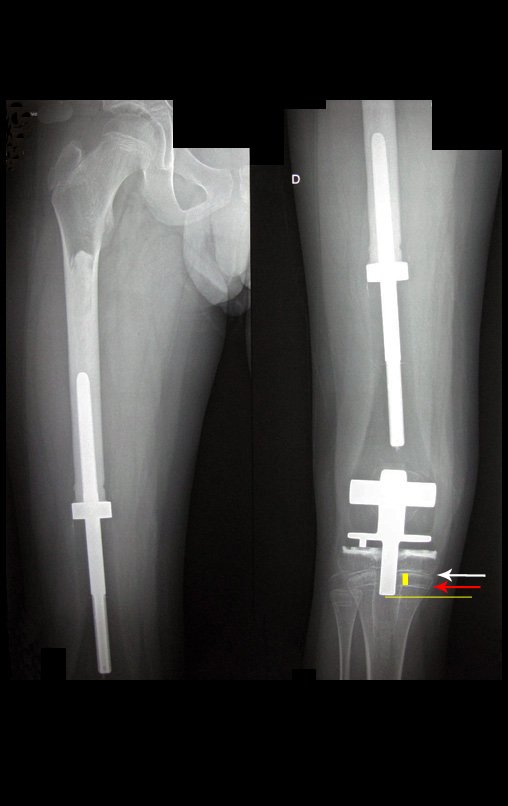
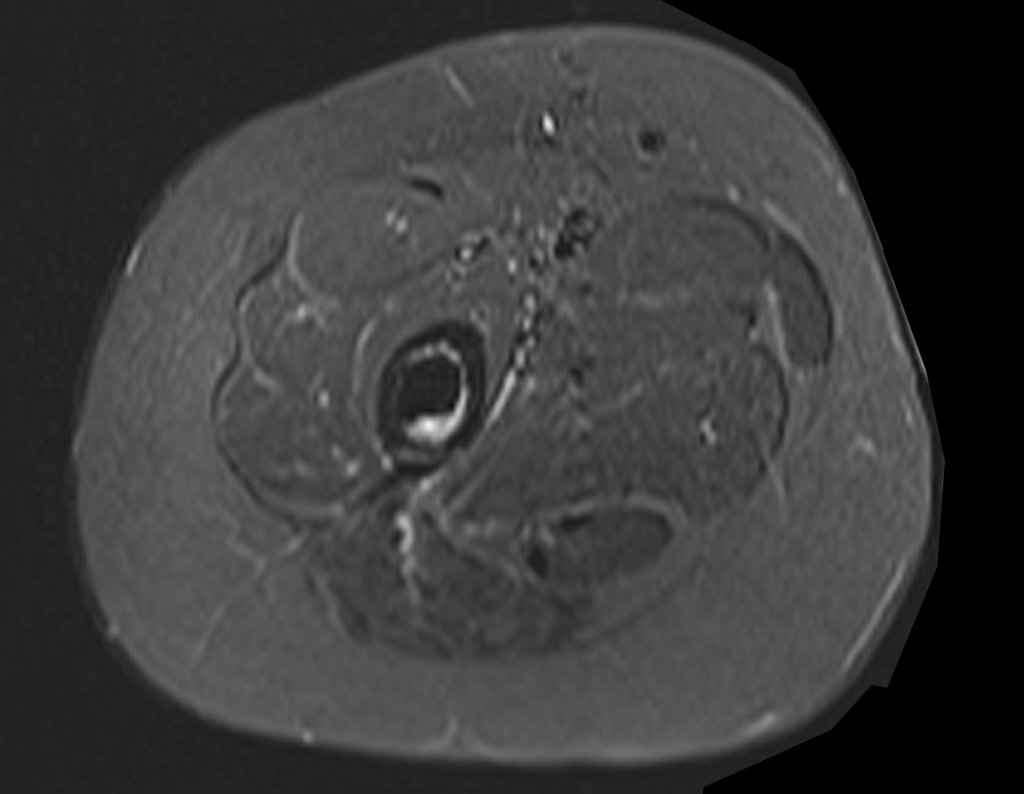
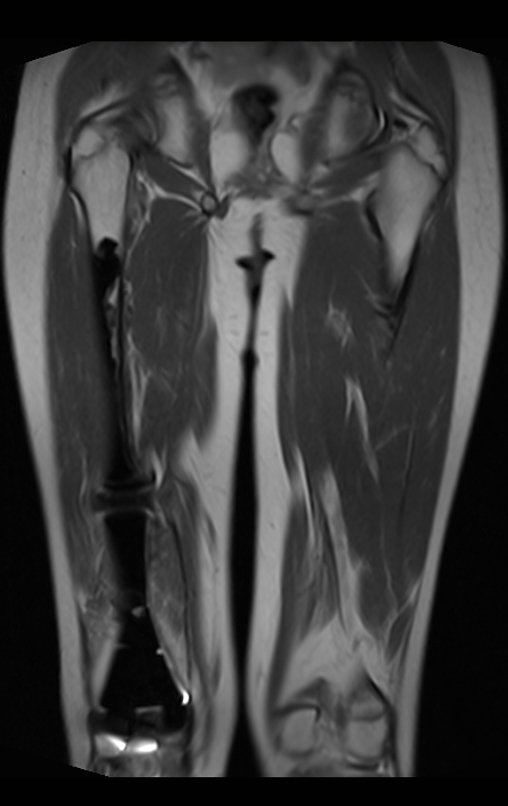
Sarcoma de Ewing
Tiene una incidencia máxima en la primera y segunda décadas de la vida, siendo rara a partir de la tercera, con preponderancia 2:1 de hombres sobre mujeres.
Existe mucha controversia respecto a la célula de origen del sarcoma de Ewing, sin embargo estudios más recientes apoyan un origen neuroectodérmico.
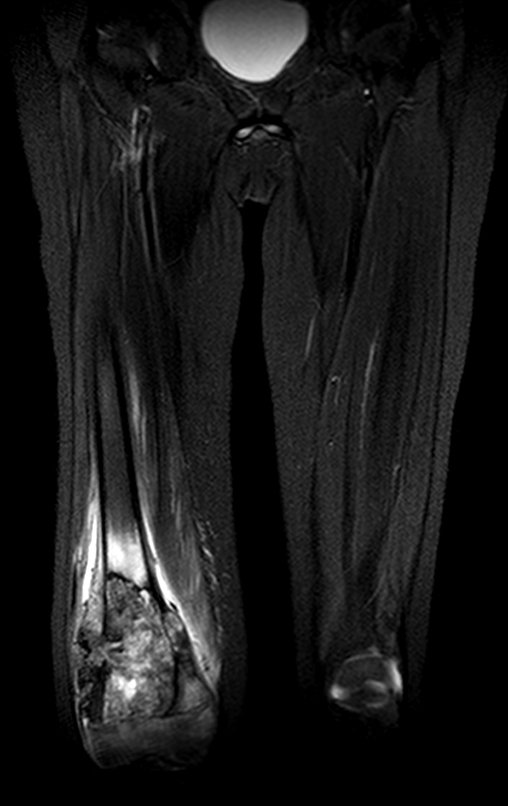
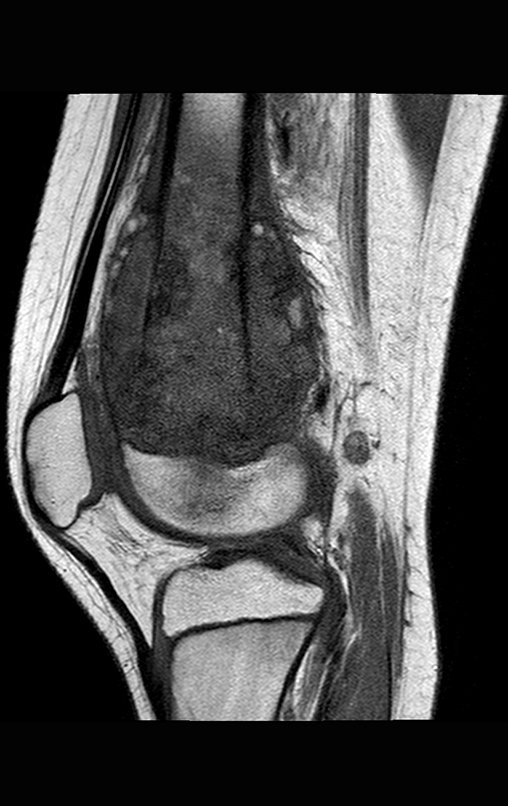
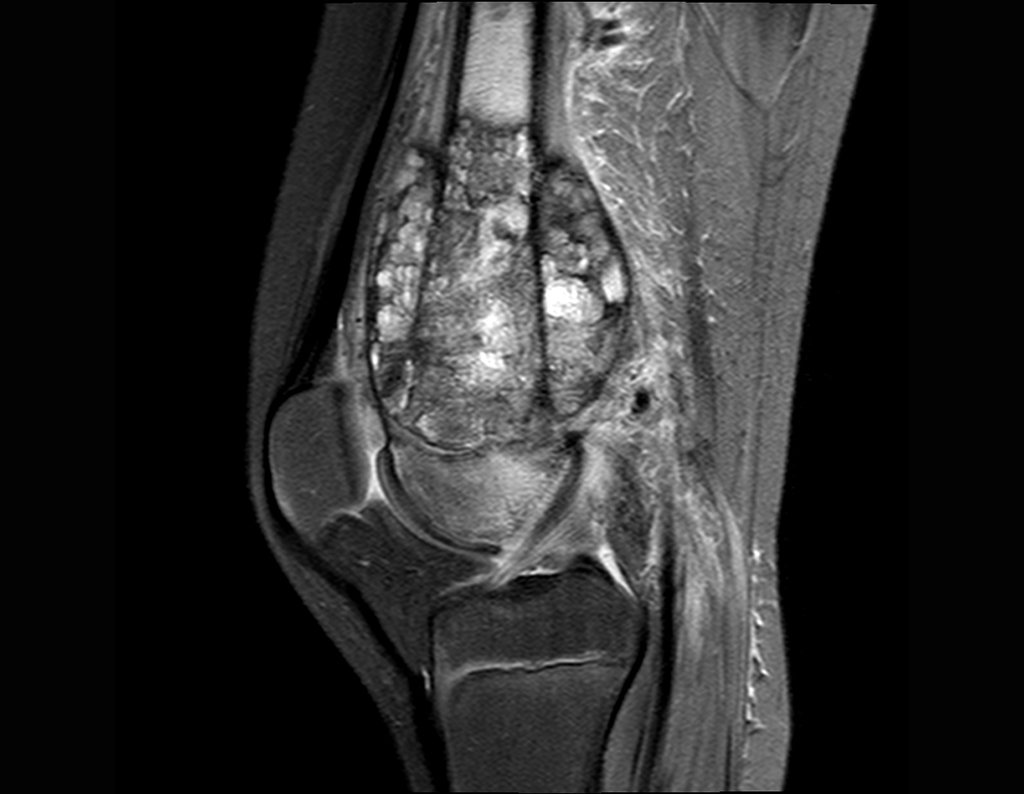
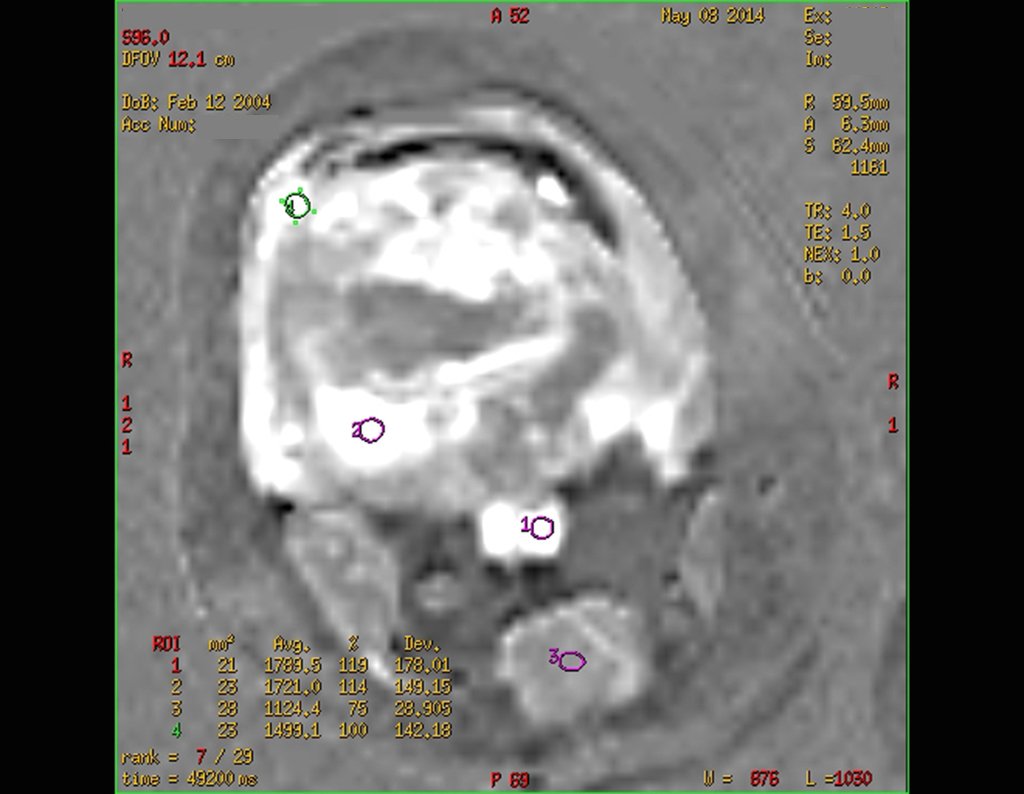
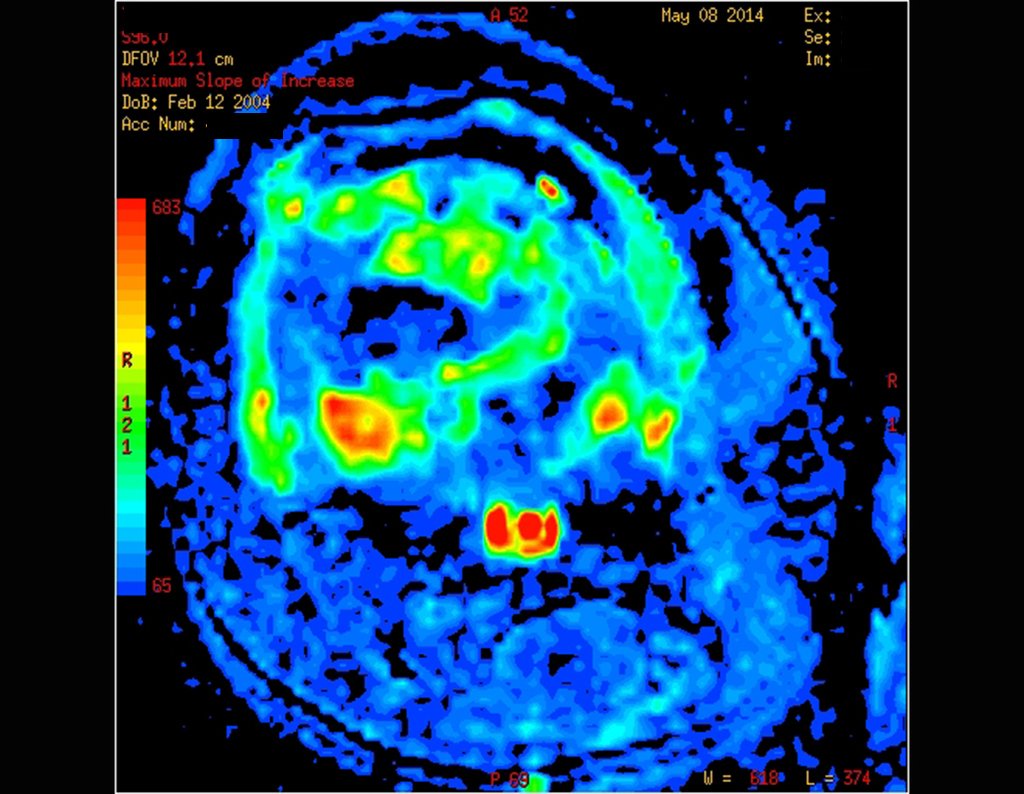
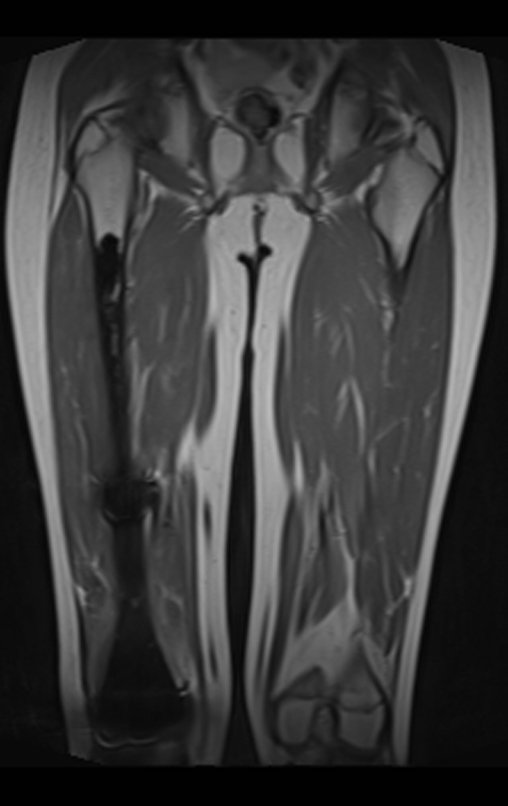
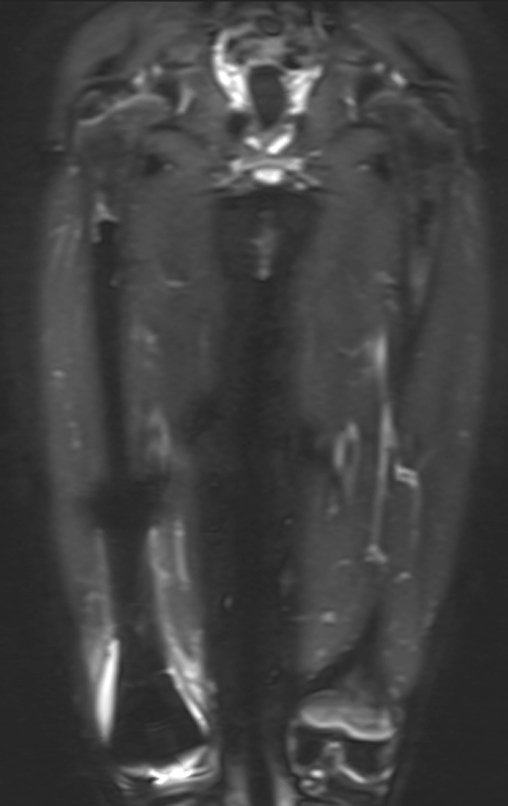
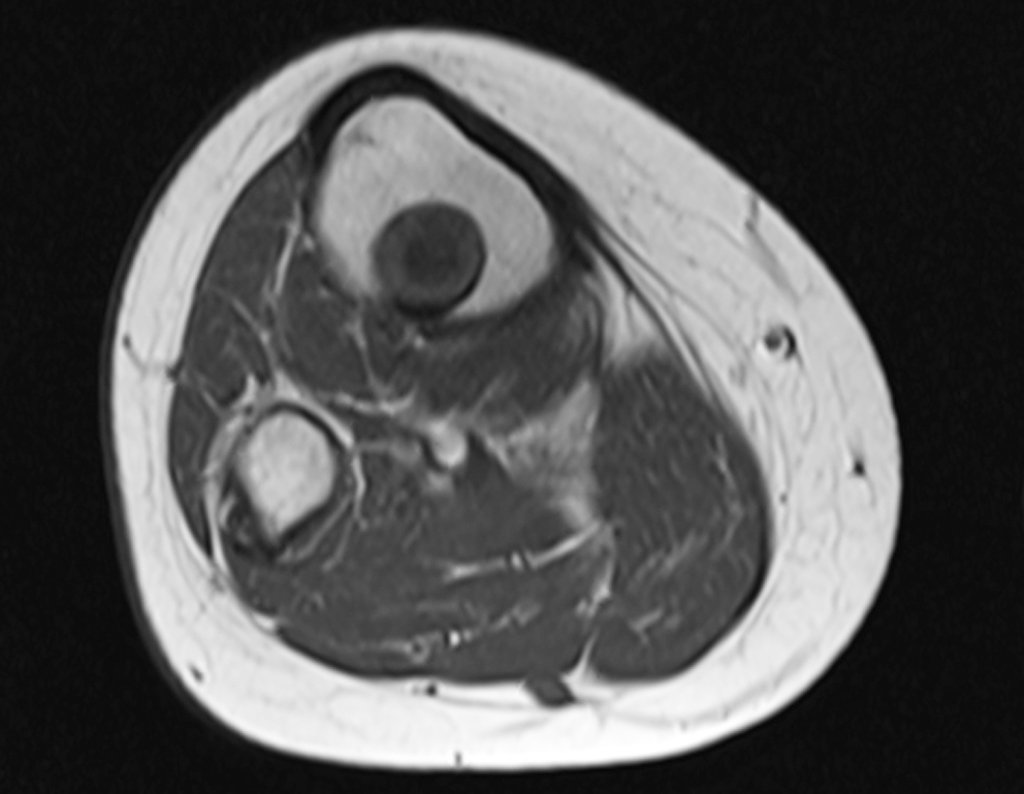
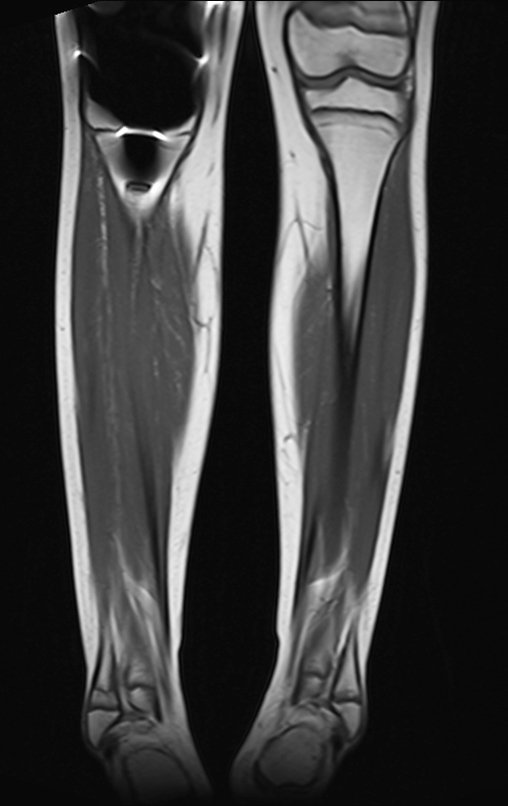
El tumor de Ewing afecta principalmente a la región metafisaria de los huesos tubulares largos y la pelvis.
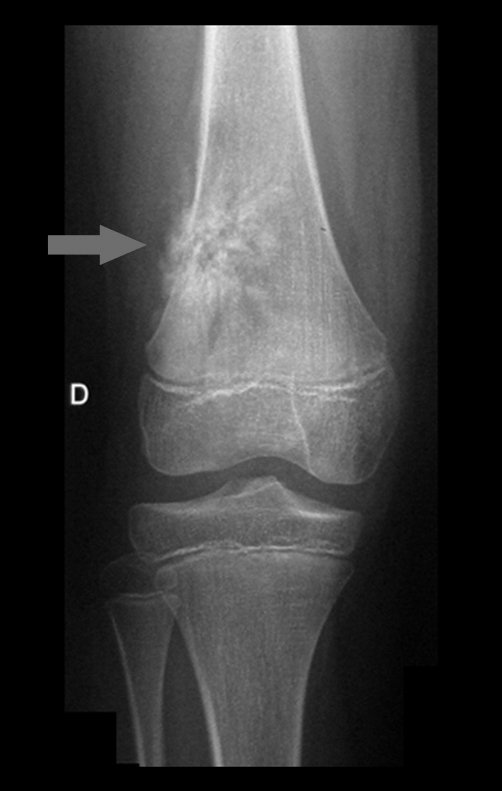
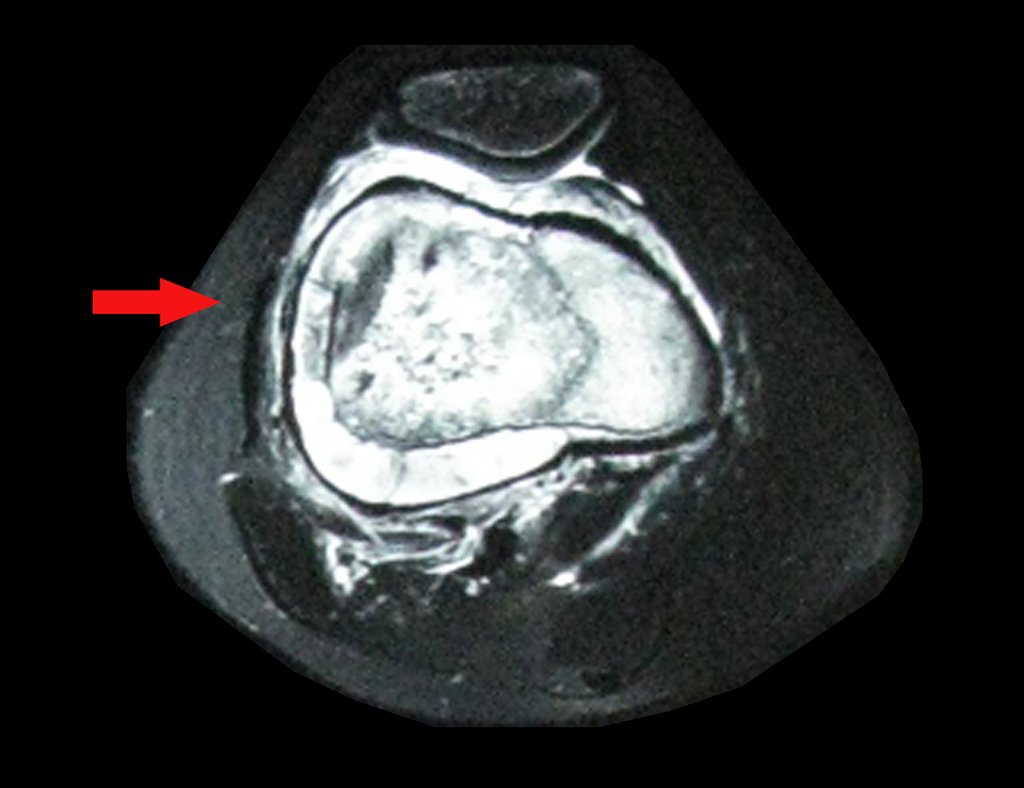
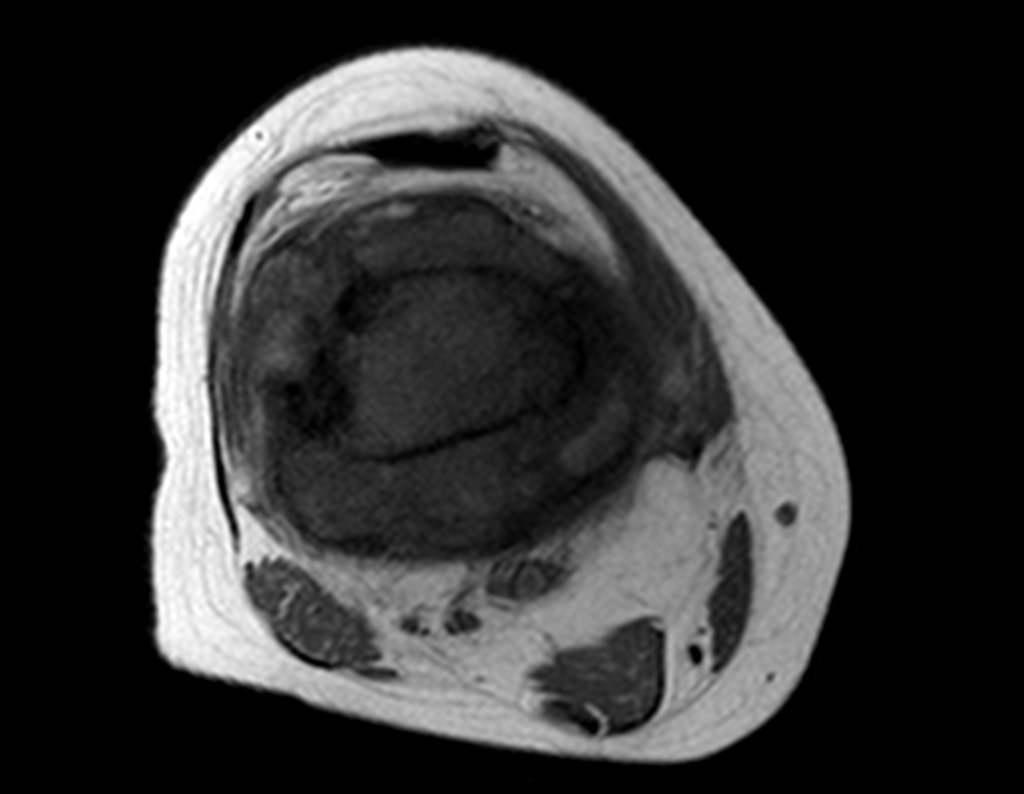
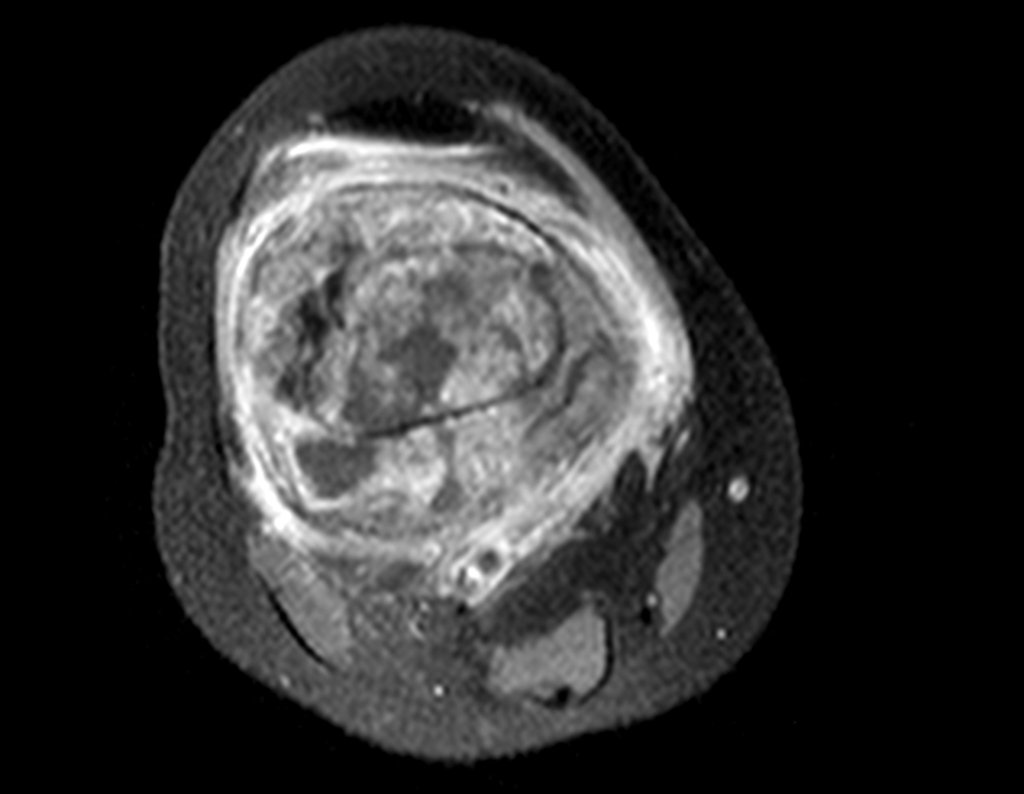
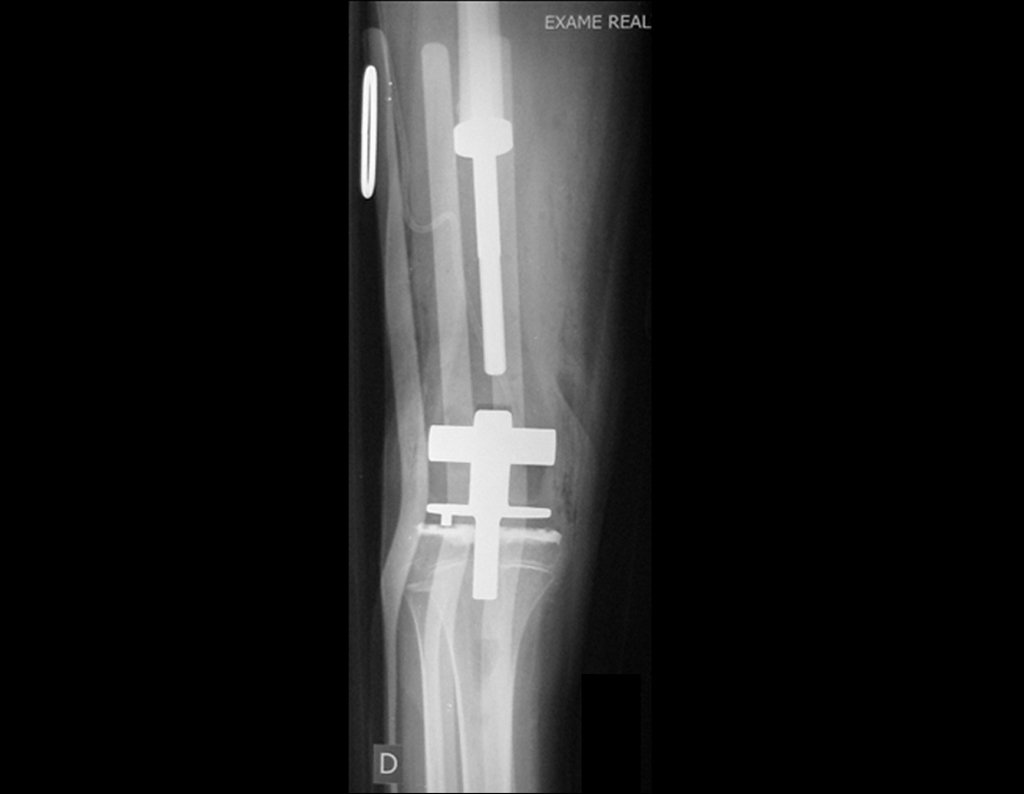
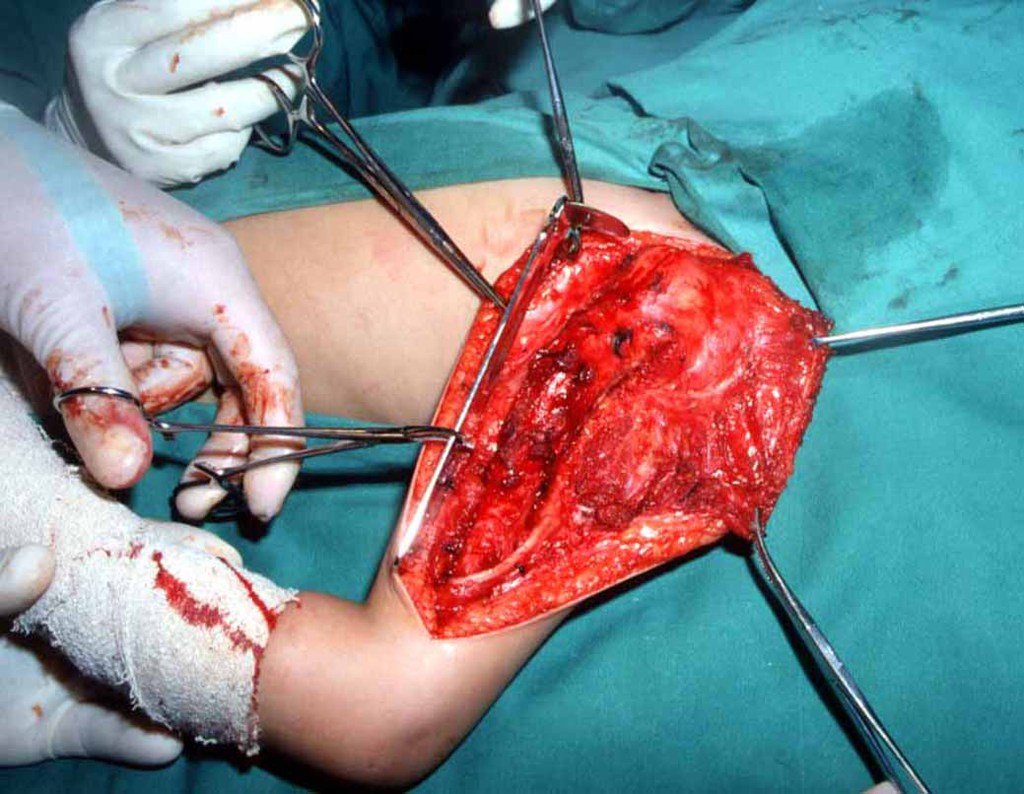
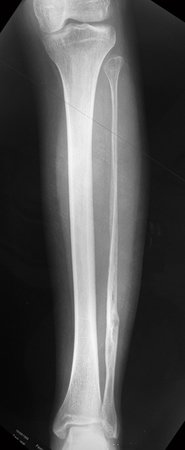
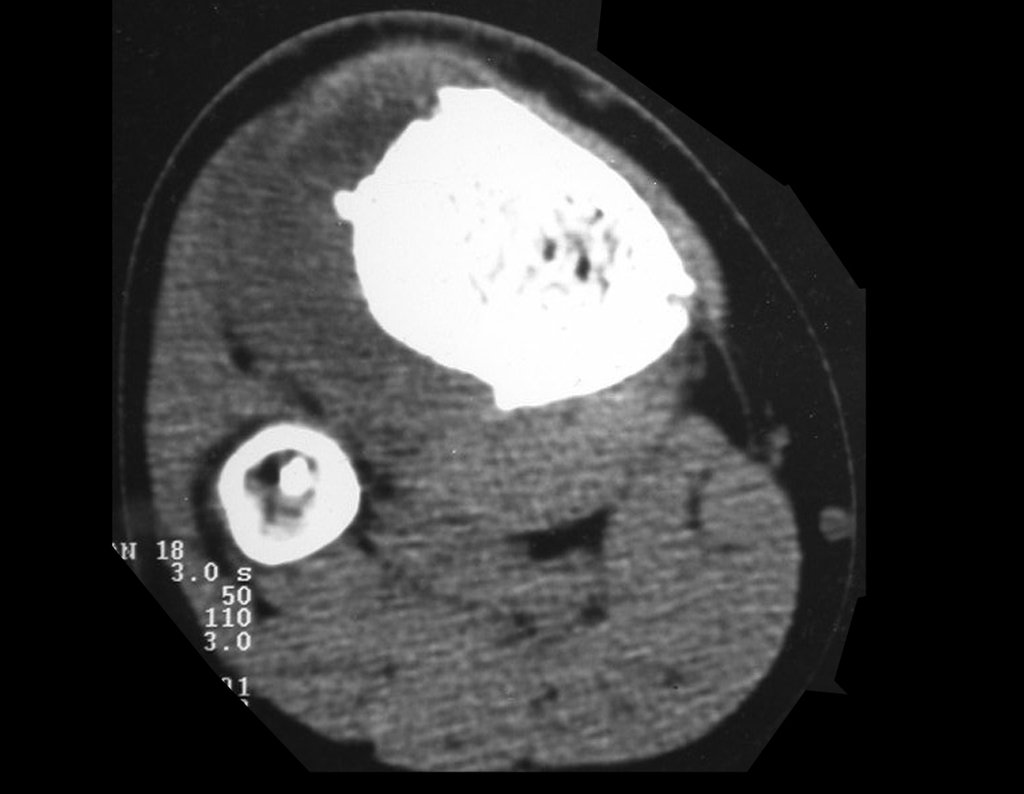
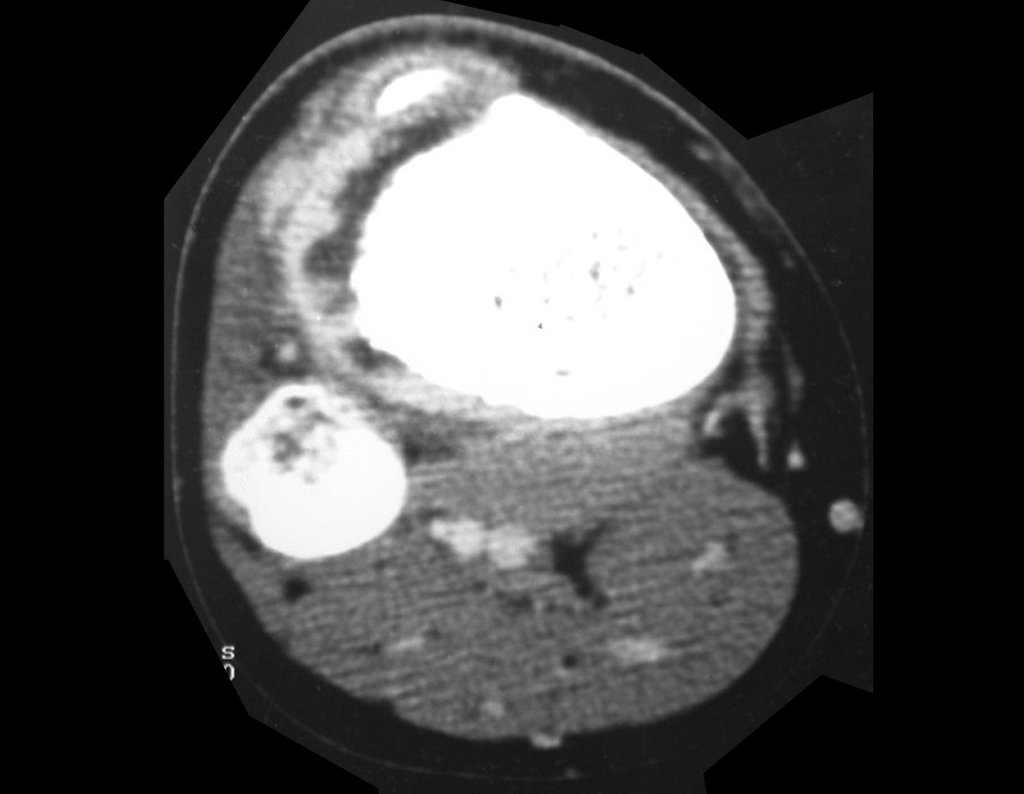
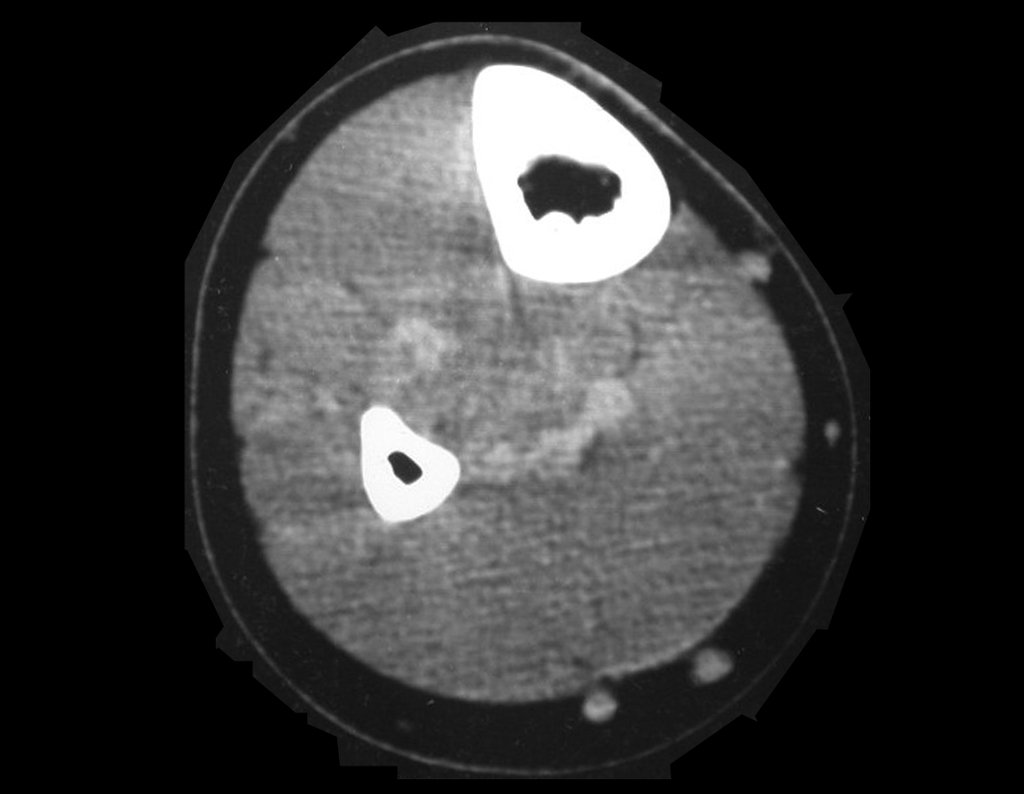
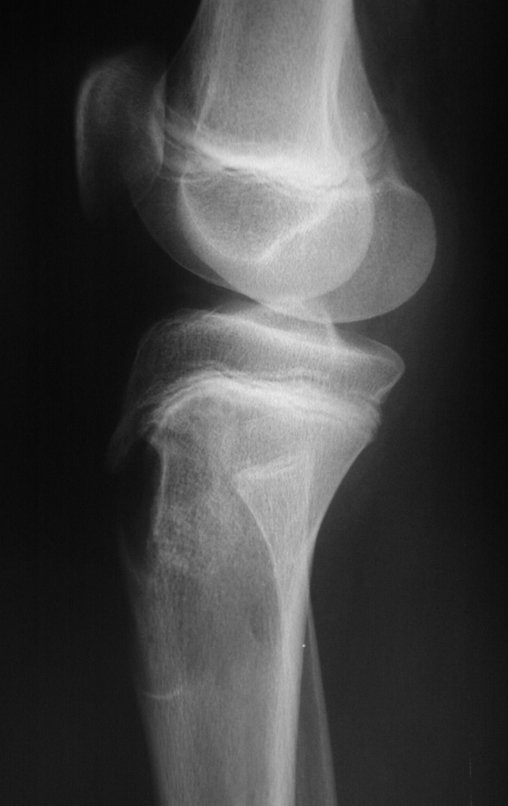
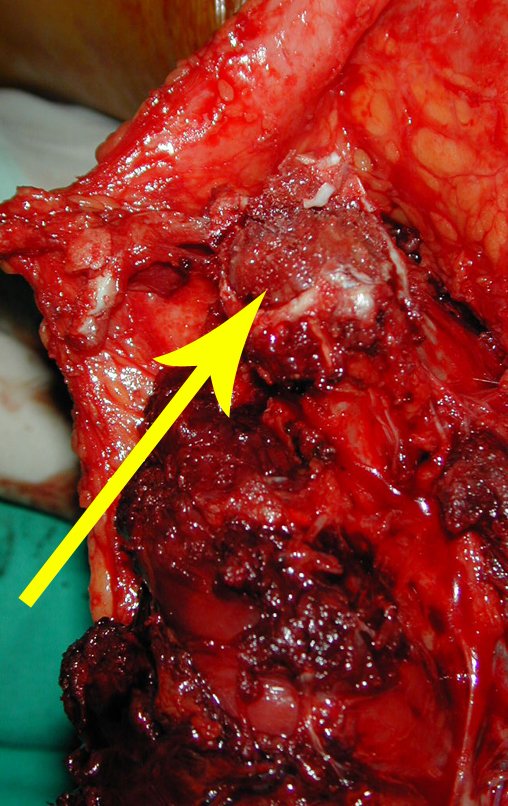
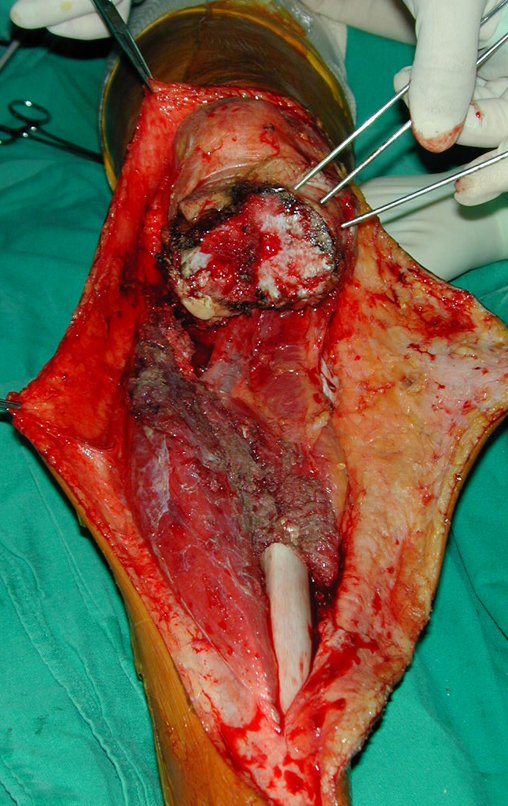
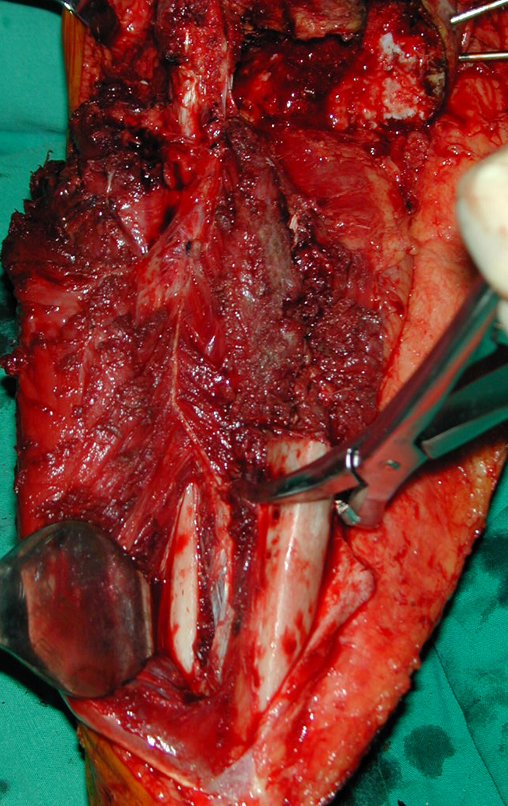
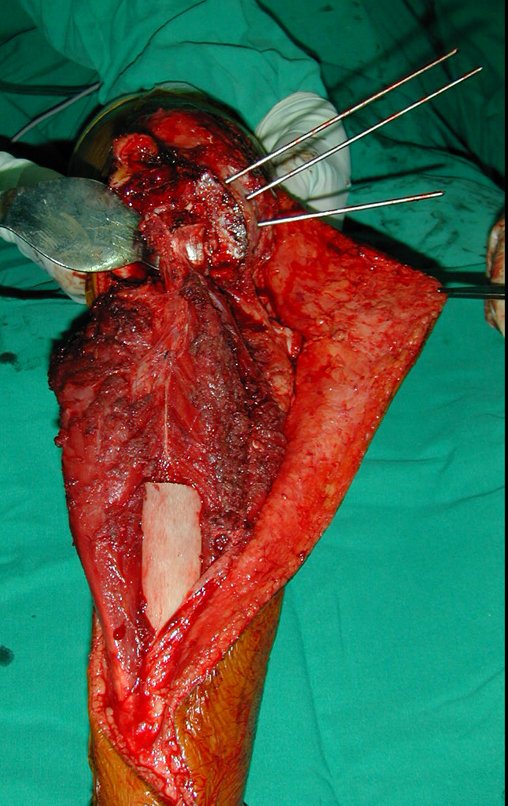
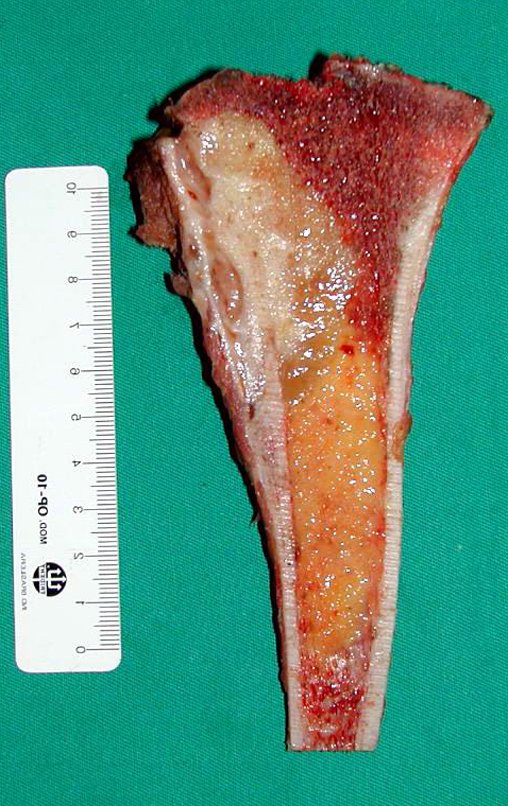
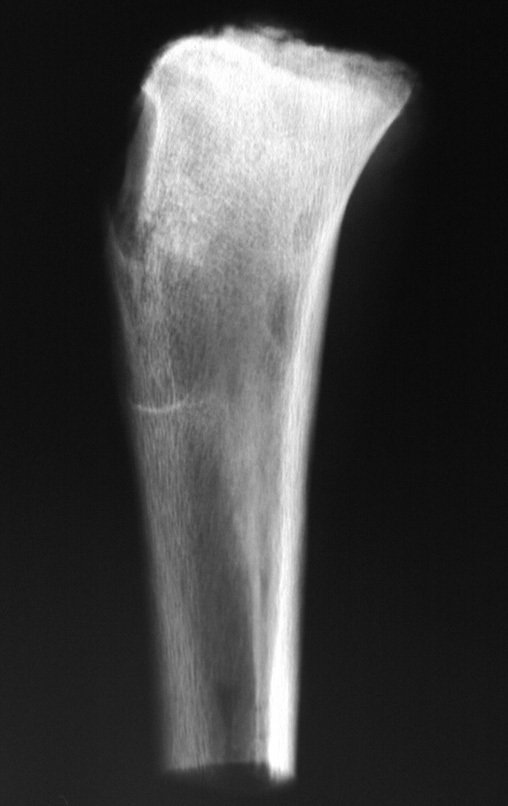
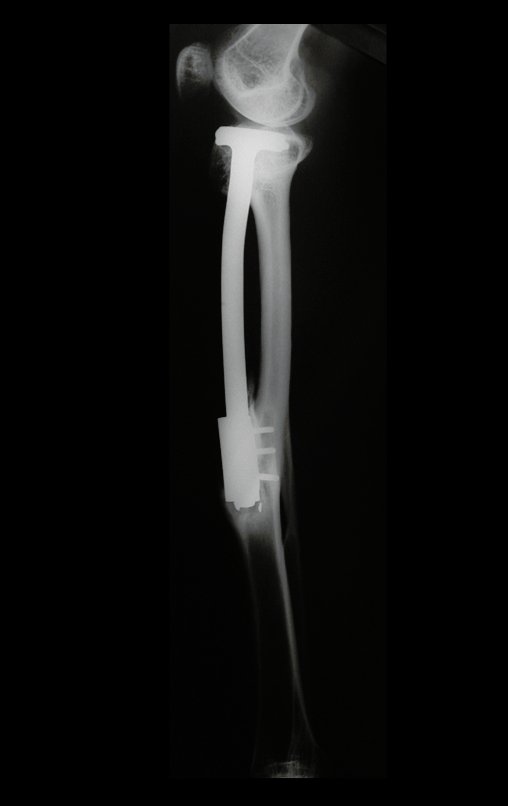
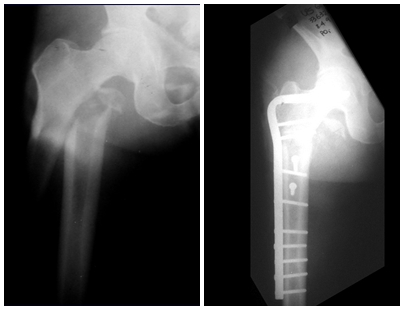
Macroscópicamente la lesión ósea se caracteriza por un color gris blanquecino, de consistencia blanda. Este tumor supera tempranamente la corteza, provocando elevación del periostio con formación subperióstica de hueso nuevo, característica de esta enfermedad, proporcionando una imagen radiológica con apariencia de “piel de cebolla”.
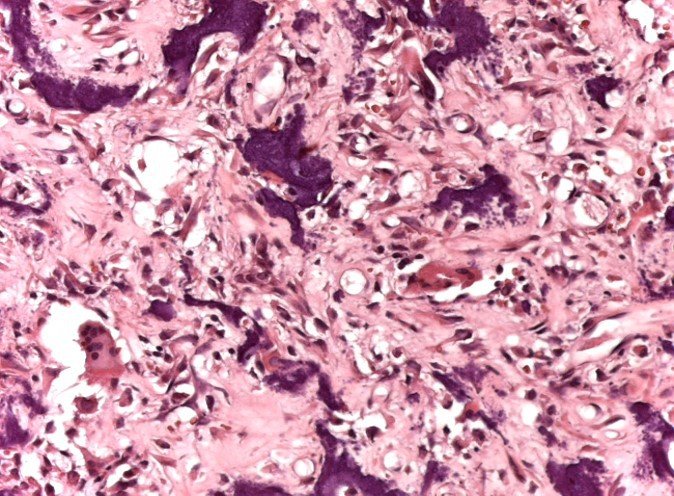
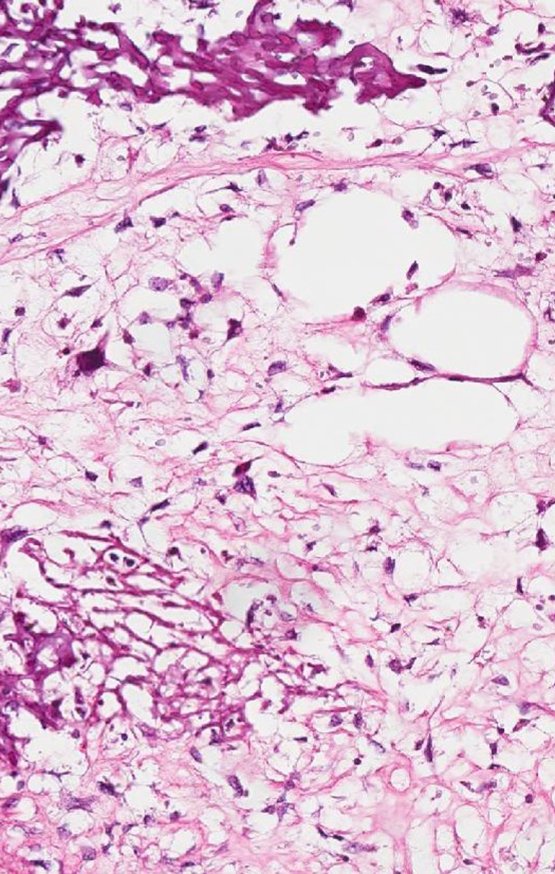
Histológicamente está compuesto por numerosas células pequeñas, redondas y uniformemente distribuidas, similares a los linfocitos, pero de mayor tamaño. La técnica de impregnación con plata en el estudio histológico revela una escasez de fibras de reticulina, que sólo se encuentran alrededor de los vasos, a diferencia de los linfomas en los que se observa una rica red de reticulina. Se puede identificar una cantidad abundante de glucógeno en el citoplasma de las células del sarcoma de Ewing mediante tinción con PAS.
Las manifestaciones clínicas del sarcoma de Ewing son dolor, hinchazón, hipersensibilidad de la parte afectada, circulación colateral, temperatura local elevada y aumento de la velocidad de sedimentación globular, que pueden disfrazarse de osteomielitis. Al principio es posible que no haya cambios radiológicos o que los cambios sean pequeños y mal definidos. A medida que avanza la enfermedad, el tumor induce la formación de grandes áreas de lisis ósea que corroen las trabéculas esponjosas y luego la corteza de adentro hacia afuera, dando a la radiografía una apariencia “apolillada”. Muy tempranamente aparece una masa tumoral extracortical, de gran volumen, que contiene más tumor fuera del hueso que dentro de él.
El diagnóstico diferencial se realiza con osteosarcoma, granuloma eosinofílico, rabdomiosarcoma y osteomielitis.
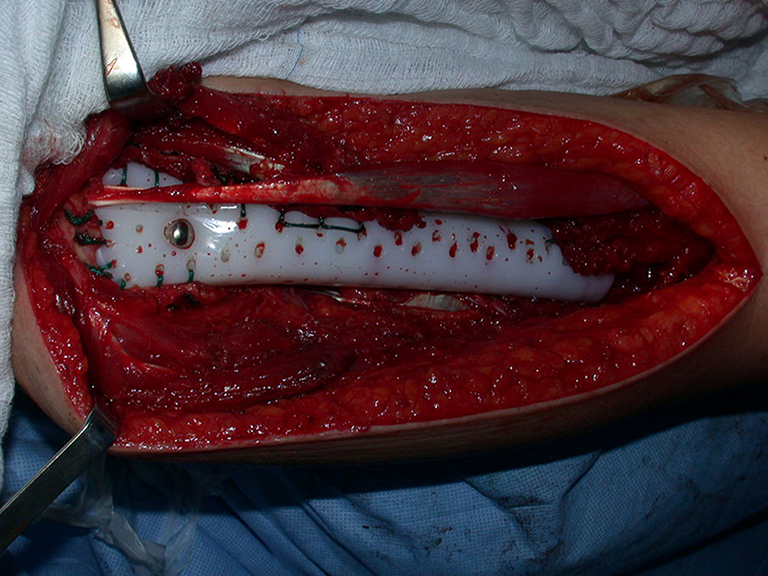
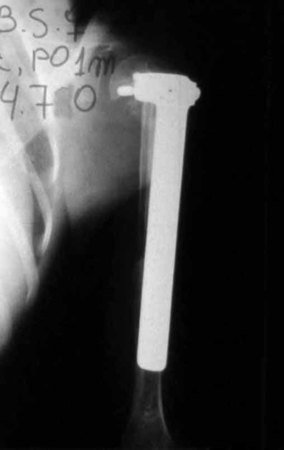
El tratamiento actual consiste en politerapia preoperatoria, cirugía de resección de la lesión seguida de politerapia postoperatoria. En el tratamiento quirúrgico, tras la resección de la lesión, se puede realizar la reconstrucción del segmento con endoprótesis, injerto óseo de banco e injerto autólogo.
La evaluación de la respuesta a la quimioterapia preoperatoria orienta el tratamiento, tiene valor pronóstico y se realiza mediante el estudio del material resecado durante la cirugía. Esta evaluación se clasifica en grados, a saber:
I – hasta un 50% de necrosis tumoral
II – entre el 50% y el 90% de la necrosis tumoral
III – más del 90% de necrosis tumoral
IV – ausencia de neoplasia histológicamente viable
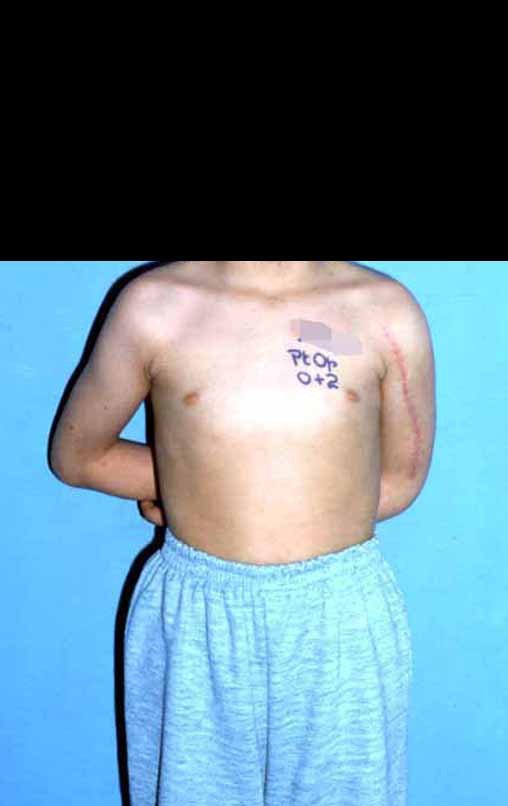
Actualmente, con excelentes respuestas al tratamiento de quimioterapia y expectativas de “cura” de la enfermedad (pacientes con más de quince años de tratamiento, vivos y clínicamente bien), se busca siempre que sea posible el tratamiento quirúrgico con soluciones biológicas, ya que son definitivas y evitar complicaciones derivadas de endoprótesis o injertos de banco, cuya durabilidad es limitada.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
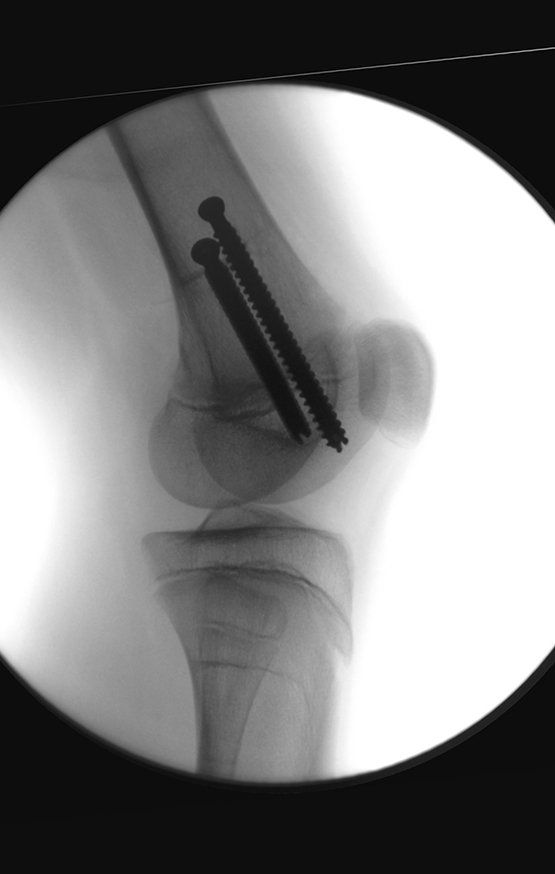
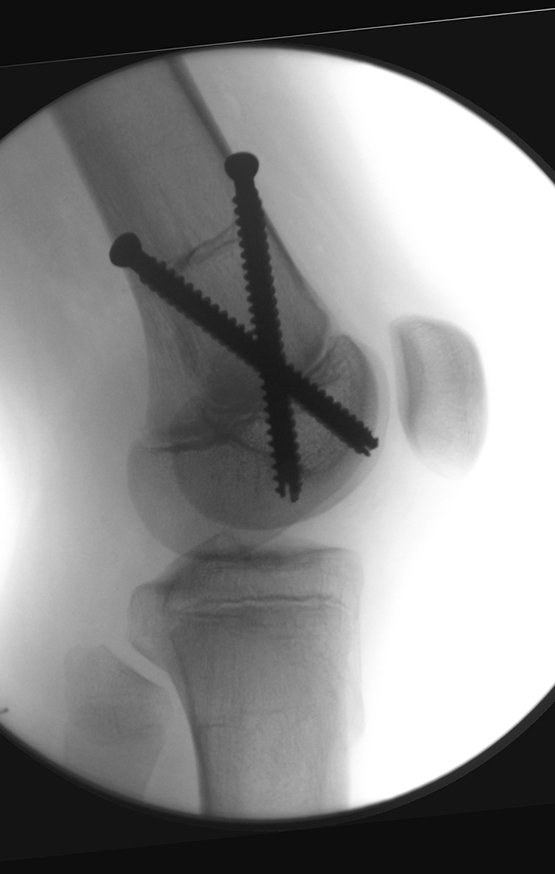
osteoma osteoide
Es una lesión que se localiza preferentemente en la corteza de los huesos largos o en el pedículo de la columna vertebral (huesos compactos). Puede ocurrir en tres ubicaciones diferentes del hueso:
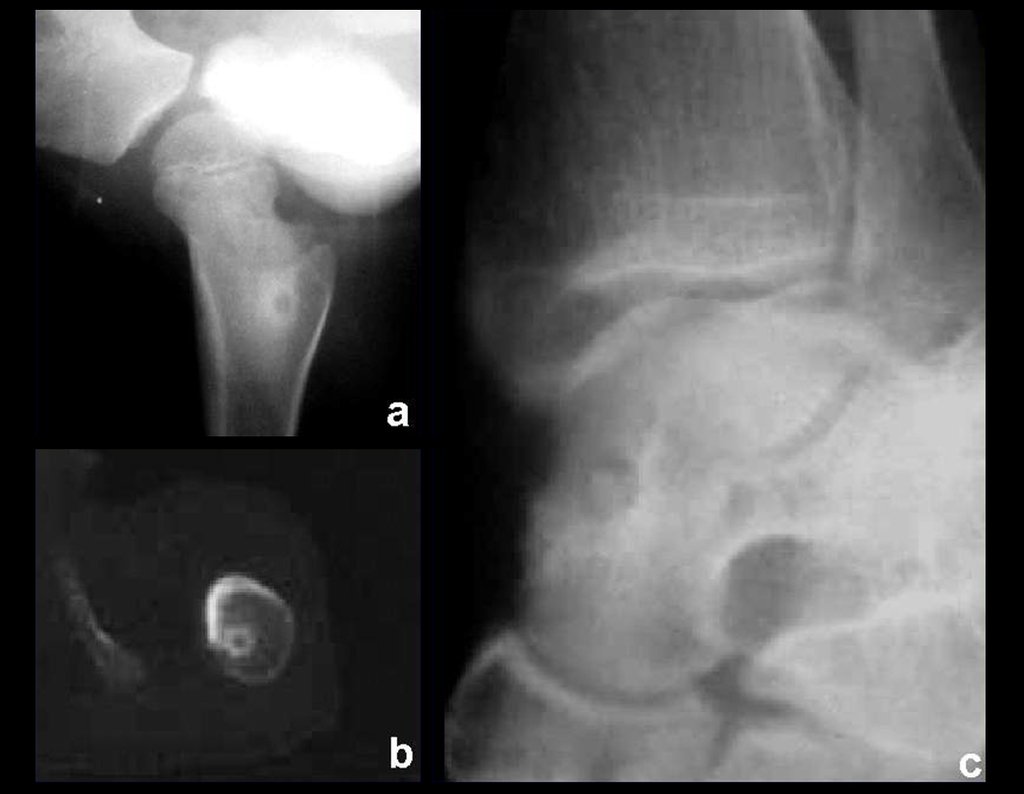
- Corticales : la gran mayoría, figuras 1 y 2a, 2b y 2c.
- Medular : o esponjoso (endostal), figura 3a, 3b y 3c.
- Subperióstico, figuras 4, 5 y 6.
Ocurre en la primera y segunda década de la vida y ocurre con el doble de frecuencia en los hombres.
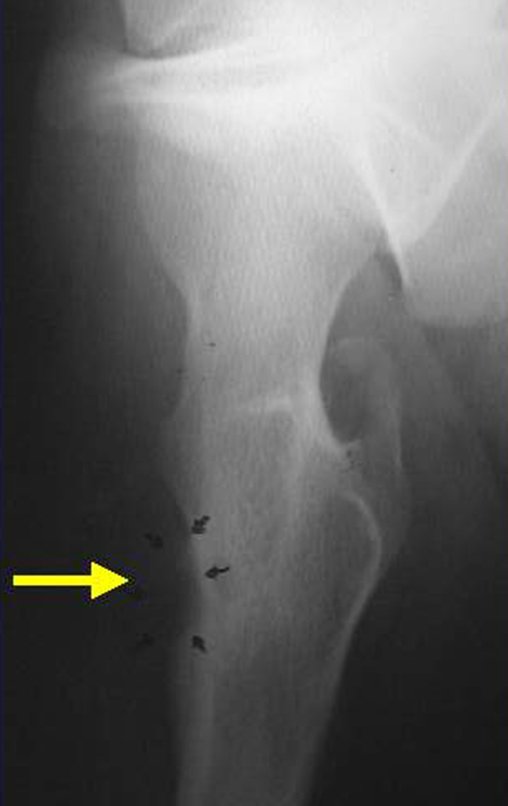
El cuadro clínico es de dolor nocturno (dolor leve que el niño no manifiesta mientras juega), que mejora con la administración de salicilatos. Puede producirse hinchazón local (fig. 4) y artralgia.
Realiza diagnóstico diferencial con esteoma, osteoblastoma y absceso de Brodie (secuestro de osteomielitis crónica).
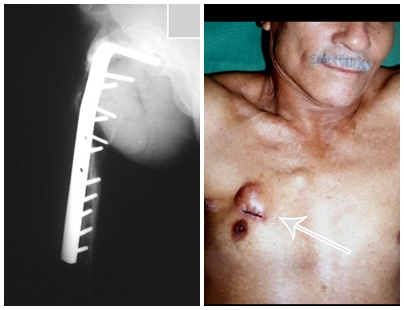
El tratamiento consiste en la resección del nicho central (fig. 5). No es necesario eliminar toda la esclerosis circundante. Cuando el defecto óseo provocado por la resección supone riesgo de fractura (como en el cuello femoral (fig. 6), se debe colocar un injerto óseo.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Metástasis ósea
El tejido esquelético representa el tercer gran filtro, que por su lenta circulación sinusoidal favorece el refugio de los émbolos metastásicos que pueden alcanzar el hueso.
Actualmente, con el aumento de la supervivencia de los pacientes con diferentes neoplasias, fruto de diagnósticos cada vez más tempranos, los avances de la quimioterapia con una variedad de fármacos cada vez más eficaces y el control de los efectos secundarios, aumenta el número de pacientes que tienen controlada su enfermedad primitiva y que metastatizan. al esqueleto está aumentando.
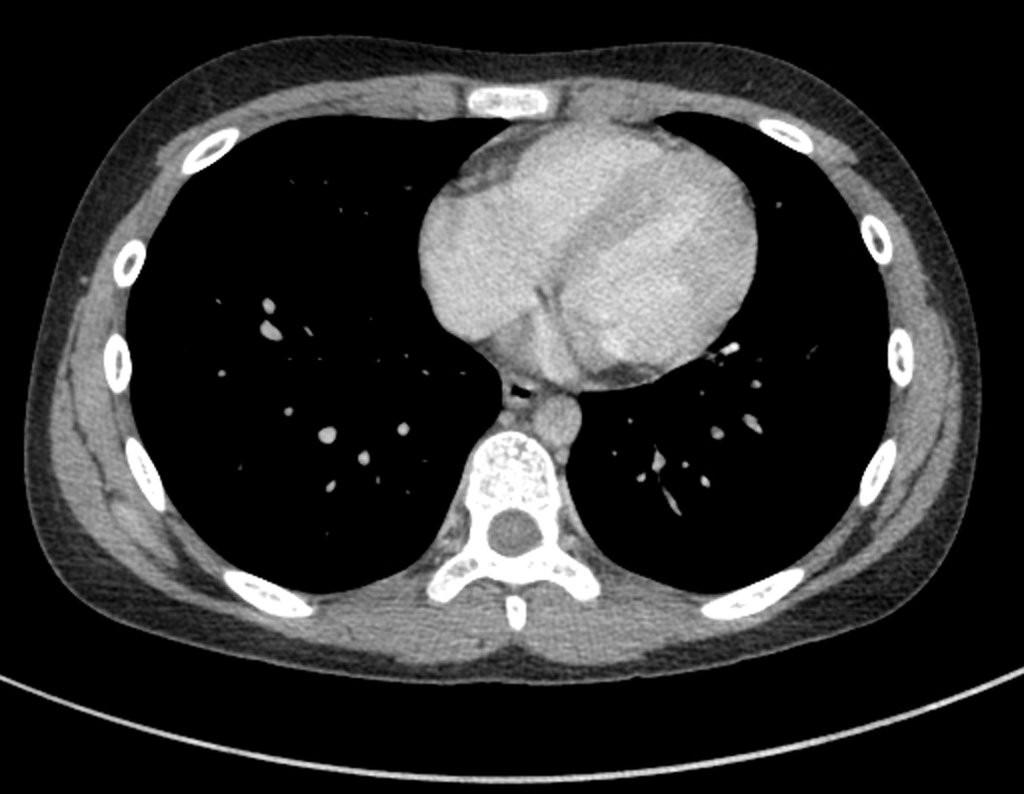
Los tumores que con mayor frecuencia producen metástasis óseas son el carcinoma de mama en mujeres, el carcinoma de próstata en hombres y el carcinoma de pulmón. riñón y tiroides en ambos.
Las lesiones óseas que con mayor frecuencia dan manifestaciones clínicas, requiriendo cirugía ortopédica, se presentan en el fémur, húmero, vértebras, pelvis, escápula y tibia, en ese orden.
La historia natural de esta condición es dolorosa y el diagnóstico generalmente puede ocurrir debido a una fractura ósea patológica que causa impotencia funcional, limitaciones en las actividades de la vida diaria, dependencia de otros, escaras y falla multiorgánica por el encamado del paciente.
El papel del ortopedista oncológico tiene como objetivo operar la lesión metastásica lo antes posible para aliviar el dolor, restaurar la función y mejorar la calidad de vida del paciente.
Para ello se realizan cirugías de resección y reconstrucción mediante osteosíntesis con cemento o endoprótesis.
La radioterapia puede eventualmente usarse como medida paliativa, con el objetivo de aliviar el dolor en pacientes que no son clínicamente aptos para la cirugía.
En relación al mieloma múltiple, que es el tumor primitivo del hueso más frecuente, un tumor del ERE, hay que añadir que se trata con quimioterapia y además es muy sensible a la radioterapia. Sin embargo, en los casos que desarrollan lesiones óseas importantes o riesgo de fractura, el manejo quirúrgico ortopédico es similar al tratamiento de las metástasis óseas.
Haga clic aquí para descargar el artículo en PDF sobre metástasis de tumores de mama masculinos.
Haga clic aquí para ver el tratamiento de metástasis de hipernefroma.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Fibroma condromixoide: neoplasia condromixoide del hueso
Fibroma Condromixoide: La Neoplasia Condromixoide Ósea es una lesión rara en el tejido óseo, que se manifiesta en las metáfisis de los huesos largos de forma excéntrica. Caracterizada por un aspecto lobulado, presenta un halo interno de esclerosis ósea que la separa del tejido normal circundante, a menudo acompañada de erosión cortical, denotando cierta agresividad local. La presencia de calcificaciones en su interior es una característica común de todas las lesiones cartilaginosas.
Desde el punto de vista histológico, el Fibroma Condromixoide presenta un notable pleomorfismo celular, con presencia de áreas de condroide, tejido fibroso y una importante cantidad de material mixoide, muchas veces acompañado de células gigantes multinucleadas.
Este tipo de lesión también puede estar asociada a un quiste óseo aneurismático, encontrándose con mayor frecuencia en la metáfisis proximal de la tibia, afectando principalmente a adolescentes y adultos jóvenes.
El tratamiento estándar para el fibroma condromixoide es la cirugía. Generalmente, el abordaje implica la resección parietal parcial de la lesión, acompañada de medidas adyuvantes locales, como el uso de fenol, electrotermia o nitrógeno líquido, además de injertos óseos cuando sea necesario. En casos más avanzados, puede estar indicada la resección segmentaria. También se puede utilizar el legrado, especialmente en las zonas articulares, pero debe realizarse con cuidado para evitar recurrencias.
En definitiva, el Fibroma Condromixoide es una lesión ósea poco frecuente, pero que requiere de un abordaje quirúrgico adecuado para evitar complicaciones y garantizar una recuperación satisfactoria del paciente.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
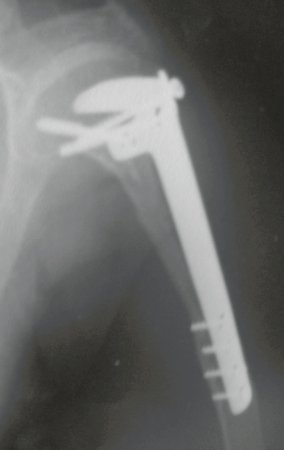
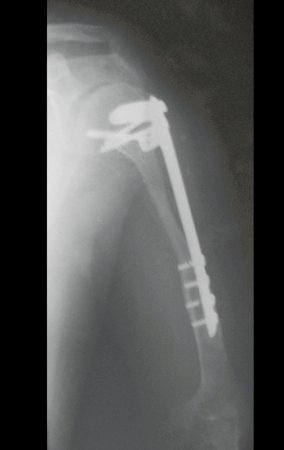
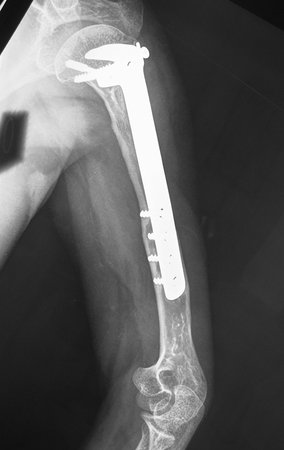
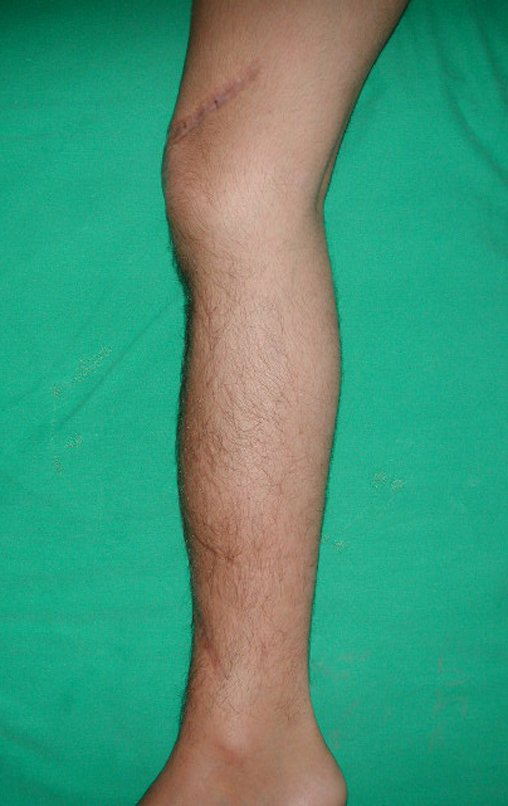
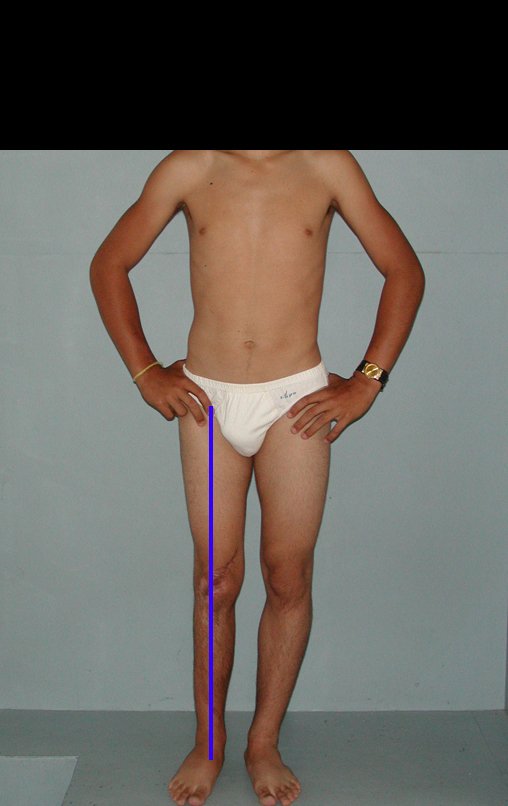
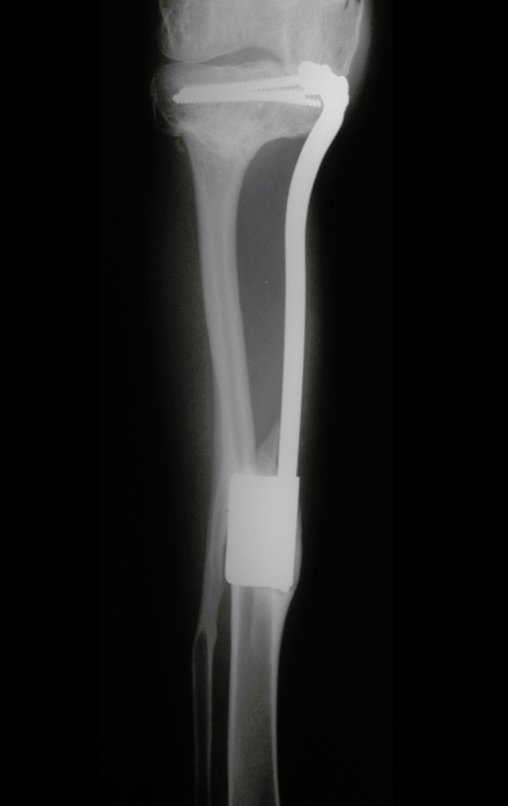
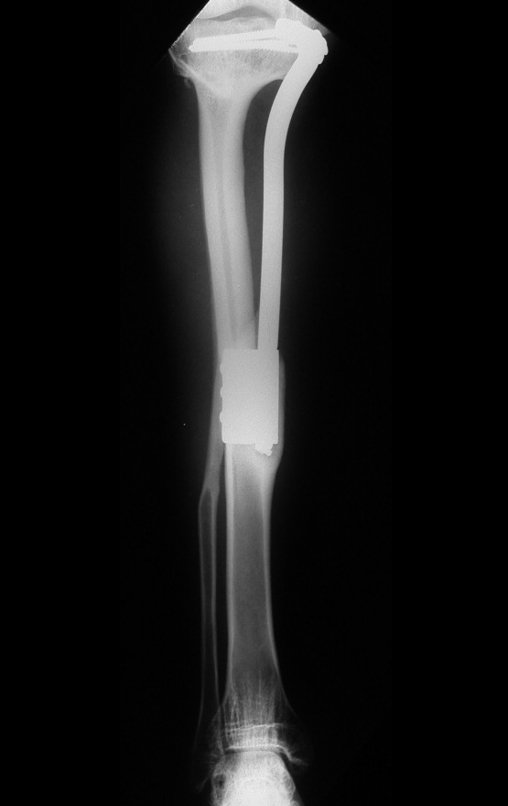
Autotrasplante de Peroné a Tibia. En 2016 publicamos un artículo actualizado con la evolución de este caso, con dieciséis años de seguimiento, ver: . http://springerplus.springeropen.com/articles/10.1186/s40064-016-2042-7
Autotrasplante de peroné a tibia con placa epifisaria proximal
Véase el artículo sobre este dispositivo de fijación interna extensible que desarrollamos, así como el uso de esta técnica en los dos primeros casos, publicado en la Revista Brasileira de Ortopedia – Vol. 36, nº 7 – julio de 2001, Figura. 166. Se puede acceder y descargar este artículo completo en PDF directamente desde el siguiente enlace:
https://oncocirurgia.com.br/2015/08/19/dispósito-de-fixacao-interna-extensivel/
Esta técnica, de autotrasplante de cartílago de crecimiento, ha sido divulgada en varios congresos nacionales e internacionales en los últimos años.
Realizamos una investigación en perros Poodle, en colaboración con la Facultad de Veterinaria de Botucatu. Este trabajo resultó en una Tesis de Maestría, en el Área de Medicina Veterinaria, en la cual actuamos como Co-Asesor. Esta tesis fue publicada posteriormente en una revista internacional, en ZEITSCHRIFTEN – VETERINARY AND COMPARATIVE ORTHOPEDICS AND TRAUMATOLOGY – ARCHIVE – NÚMERO 2 2008, Figura 167. Se puede acceder a este artículo en el siguiente enlace:
En 2016 publicamos un artículo actualizado con la evolución de este caso, con dieciséis años de seguimiento, ver: . http://springerplus.springeropen.com/articles/10.1186/s40064-016-2042-7
AUTOTRASPLANTE DEL PERONÉ A LA TIBIA CON LA PLACA EPIFISIARIA PROXIMAL
INTRODUCCIÓN
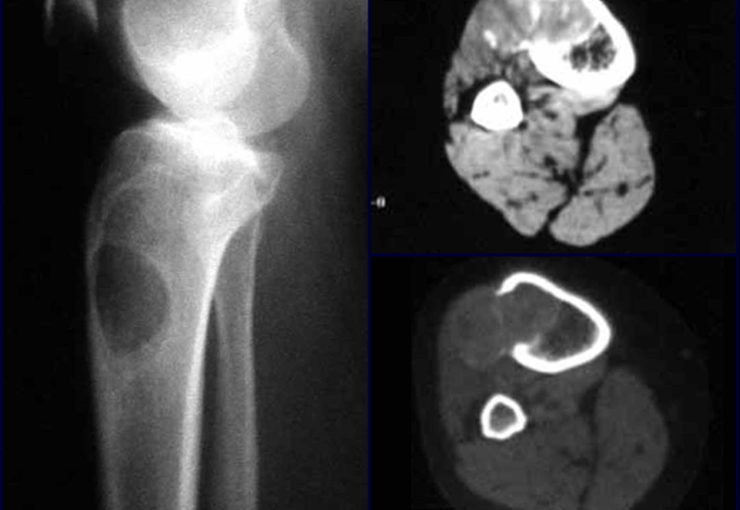
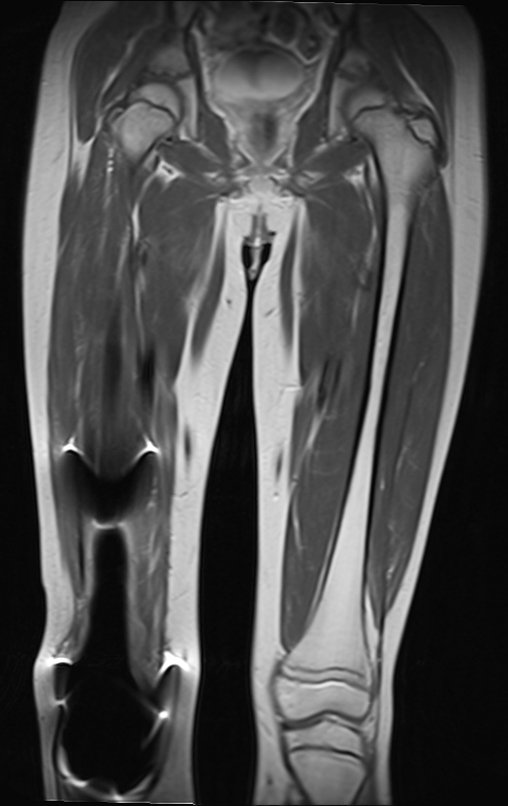
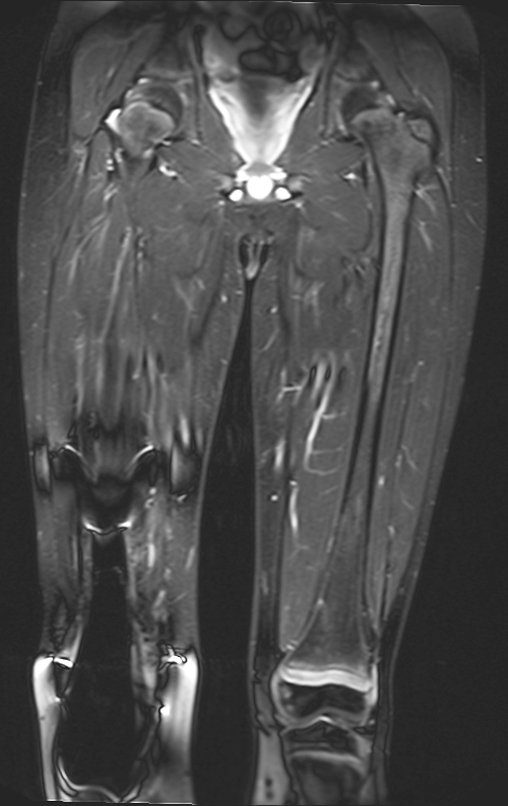
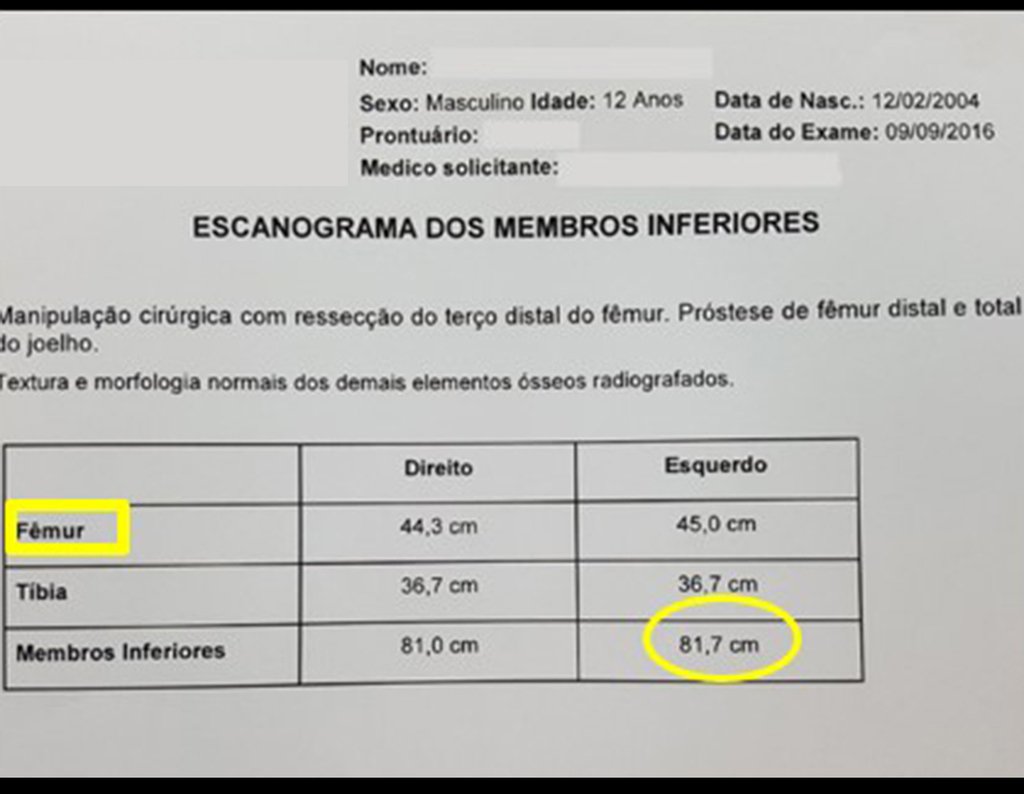
El tercio proximal de la tibia, en la población esqueléticamente inmadura, alberga una fisis de crecimiento responsable de aproximadamente el 30% de la longitud final de la extremidad en la edad adulta1. Esta región es también la segunda localización más frecuente de incidencia de tumores óseos primarios, sólo detrás del tercio distal del fémur2.
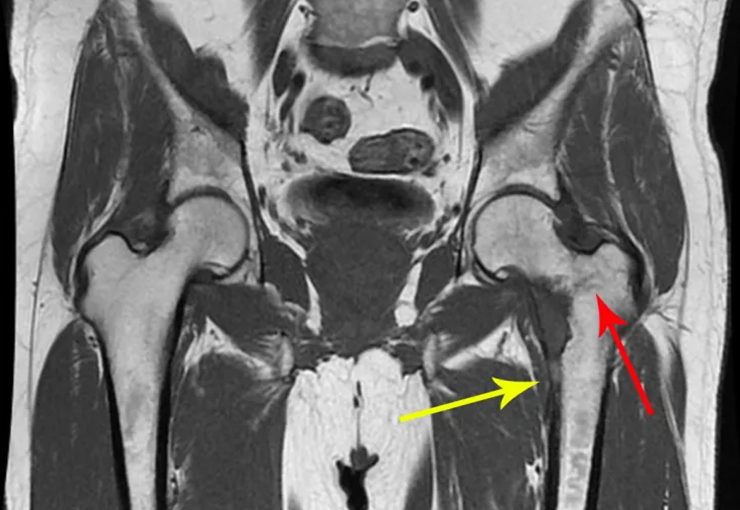
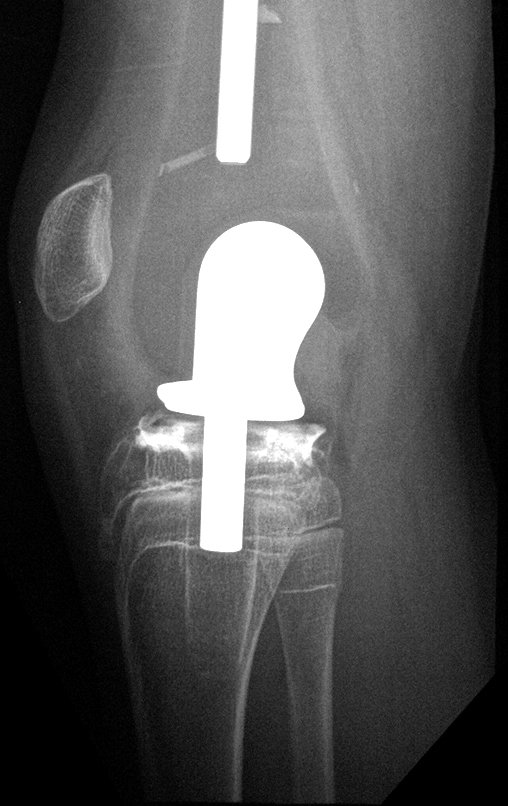
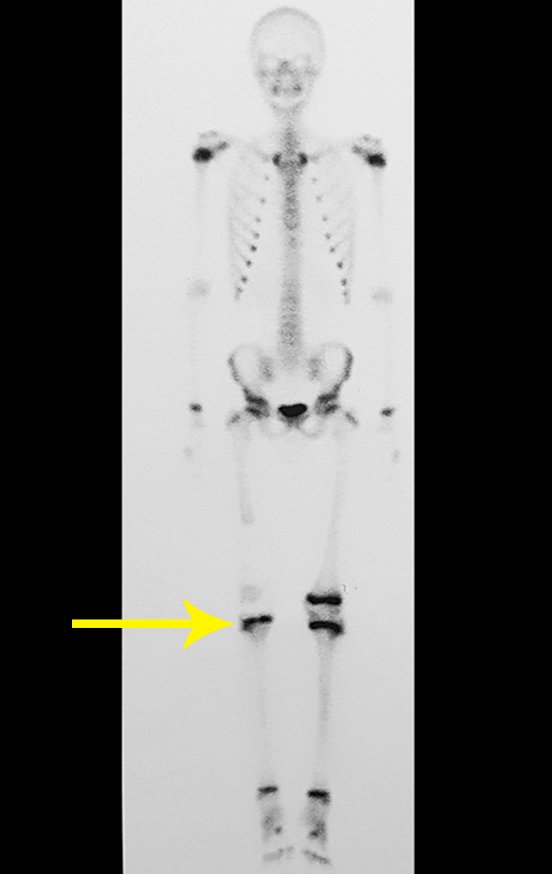
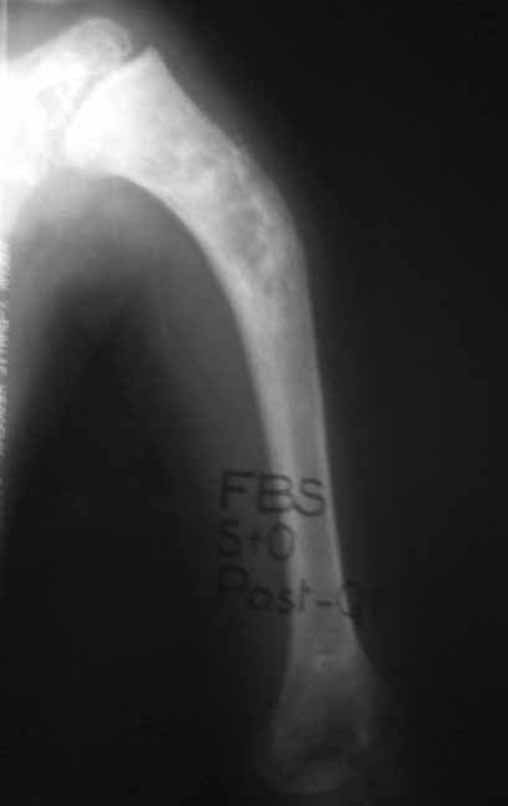
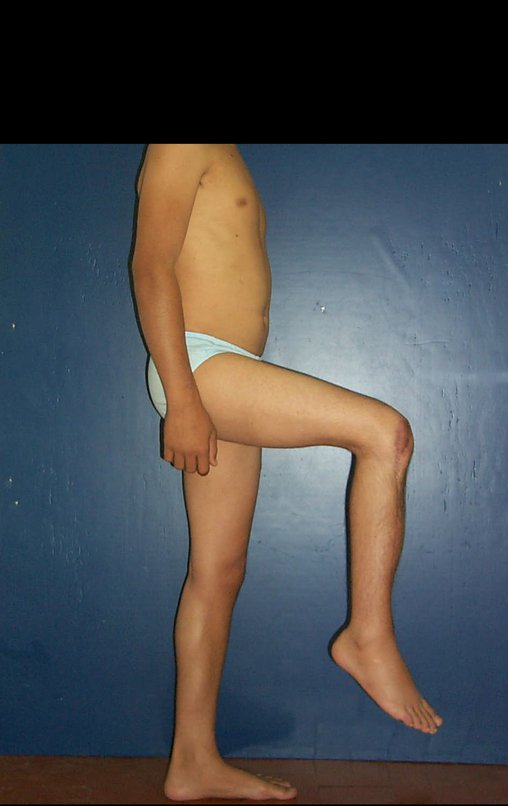
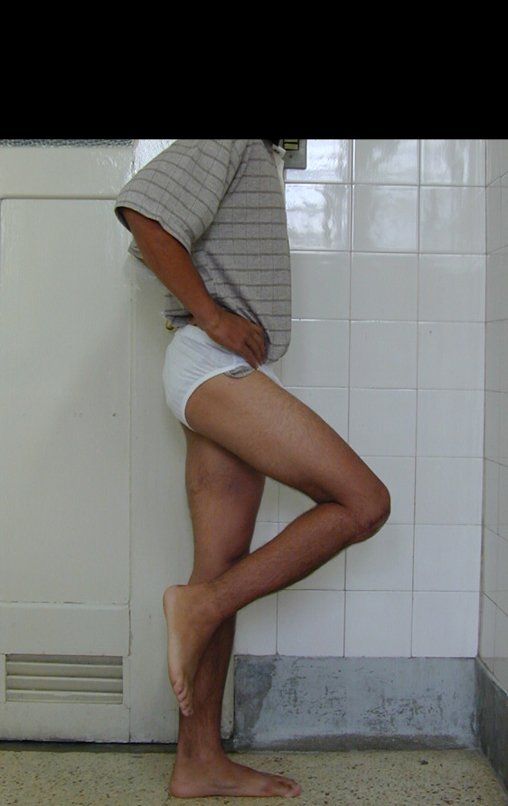
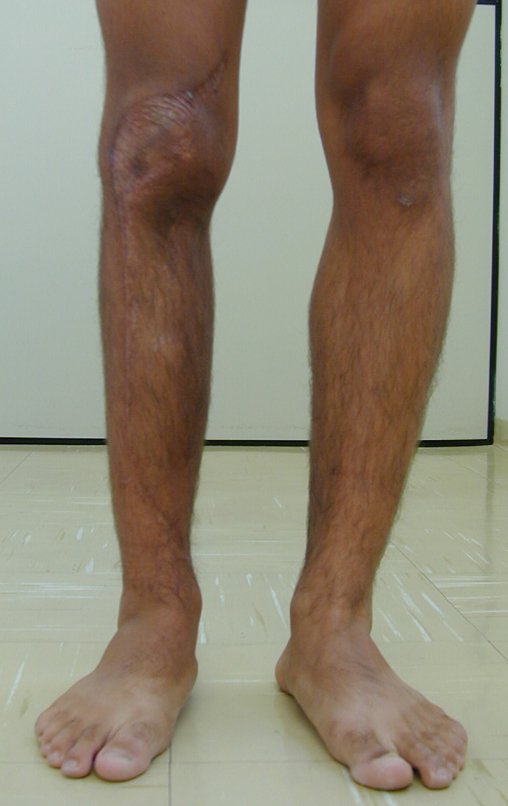
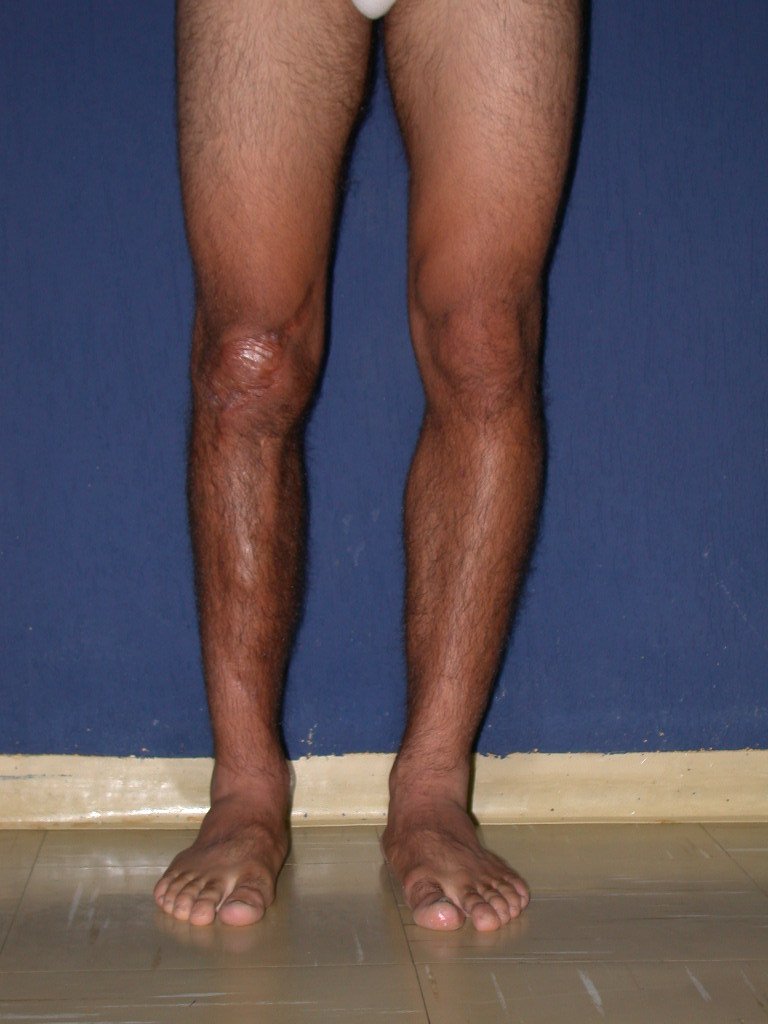
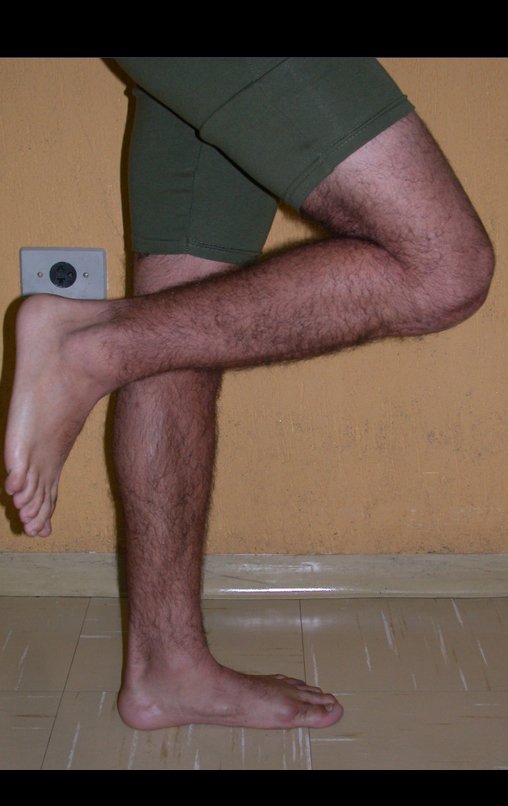
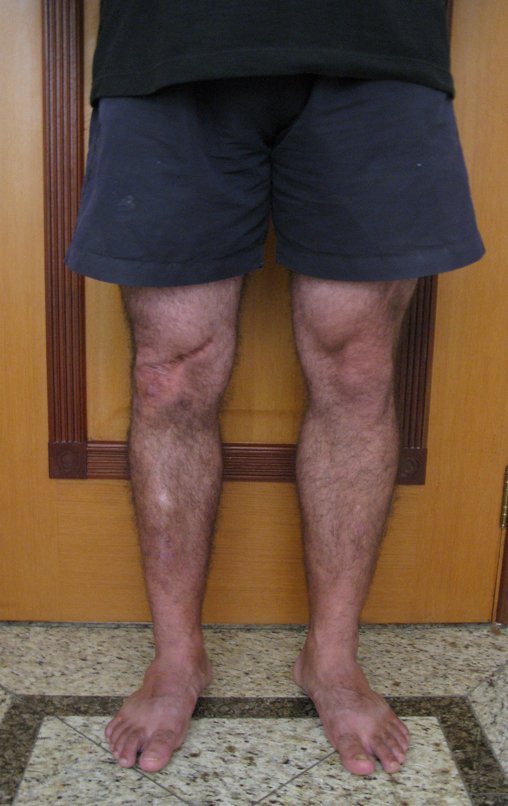
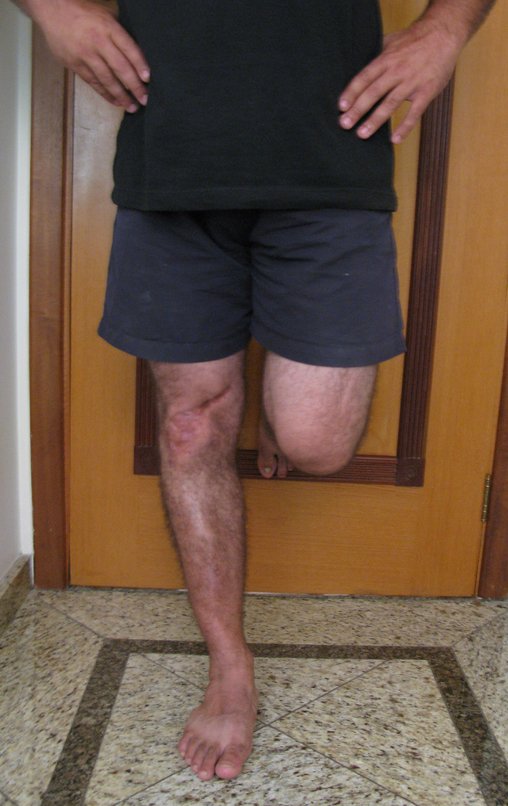
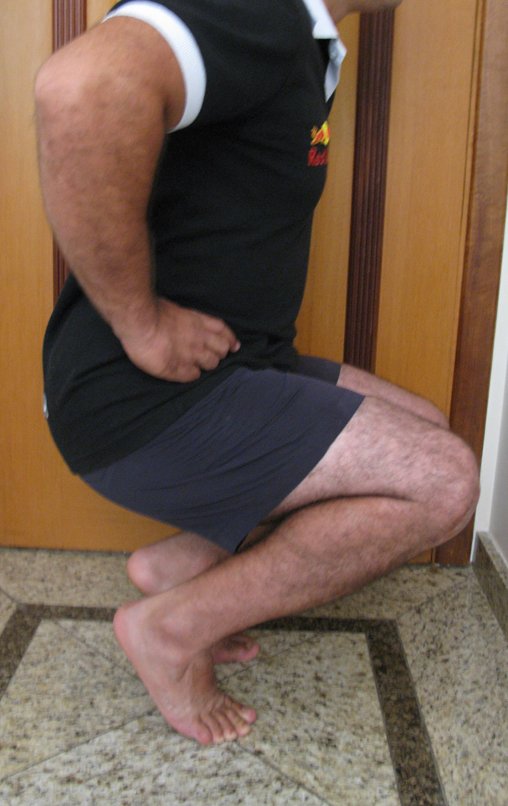
Los tumores que surgen en la región proximal de la tibia antes de la madurez esquelética pueden afectar la fisis de crecimiento y generar discrepancias en la longitud final de los miembros inferiores (figura 1)2.
La resección tumoral en este segmento de la tibia requiere la reconstrucción del defecto óseo generado, que por su corta edad puede tener resultados insatisfactorios con los métodos tradicionales, recomendándose la amputación como alternativa3.
Entre los métodos de reconstrucción de este segmento podemos mencionar el reemplazo por endoprótesis no convencional, el uso de injerto homólogo o autólogo y el transporte óseo, ninguno de los cuales reemplaza la función de la fisis de crecimiento comprometida4-8.
El uso del peroné vascularizado para rellenar defectos óseos cobró gran impulso con el desarrollo de la técnica microquirúrgica, ya que permite el uso del peroné contralateral9-13.
La utilización del segmento proximal del peroné con su fisis, mediante una técnica microquirúrgica, permitió, por primera vez, reconstruir defectos óseos y restablecer el crecimiento longitudinal del hueso, requiriendo sin embargo de un equipo especializado, así como de materiales y equipos especiales y de alto costo y sujetos a varias complicaciones14.
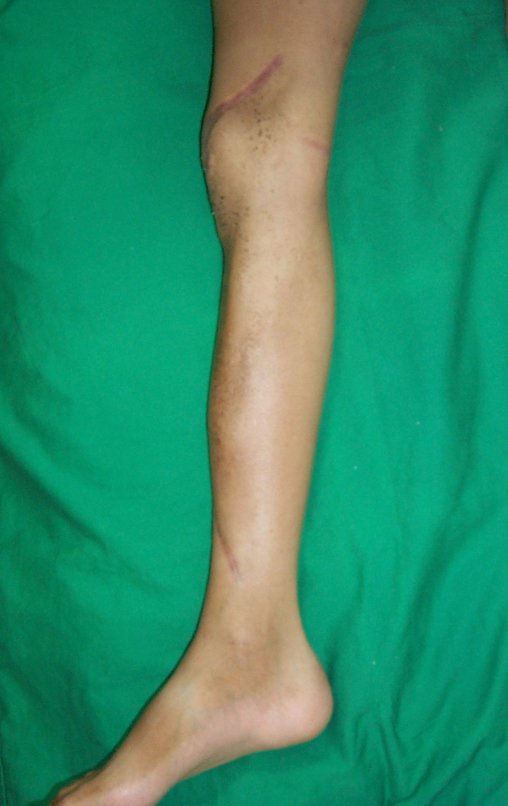
El objetivo de este trabajo es presentar una nueva técnica quirúrgica para la reconstrucción de lesiones óseas que comprometen la región proximal de la tibia y su placa de crecimiento en niños. Esta técnica consiste en transponer el peroné ipsilateral, junto con su fisis de crecimiento, preservando el riego sanguíneo y la capacidad de crecimiento longitudinal, sin necesidad de técnica microquirúrgica, utilizando una única vía de acceso quirúrgico. Describimos dos casos en los que se utilizó esta técnica.
MÉTODOS
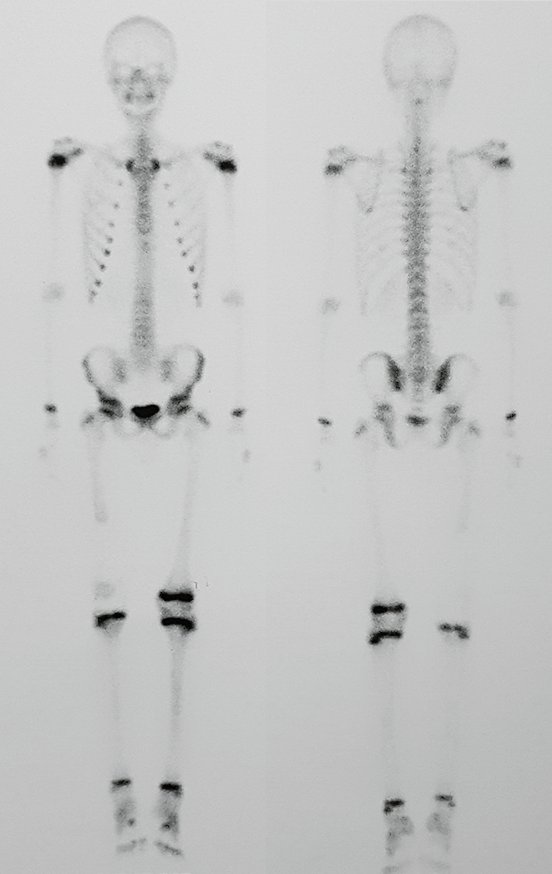
Se analizaron retrospectivamente las historias clínicas de dos pacientes con sarcoma óseo en la región proximal de la tibia que presentaron afectación del cartílago de crecimiento, quienes fueron tratados quirúrgicamente mediante la técnica de autotrasplante del segmento proximal del peroné a la tibia, desarrollada por el Dr. . Pedro Péricles Ribeiro Baptista, en el Departamento de Ortopedia de la Santa Casa de São Paulo.
Descripción de la técnica quirúrgica.
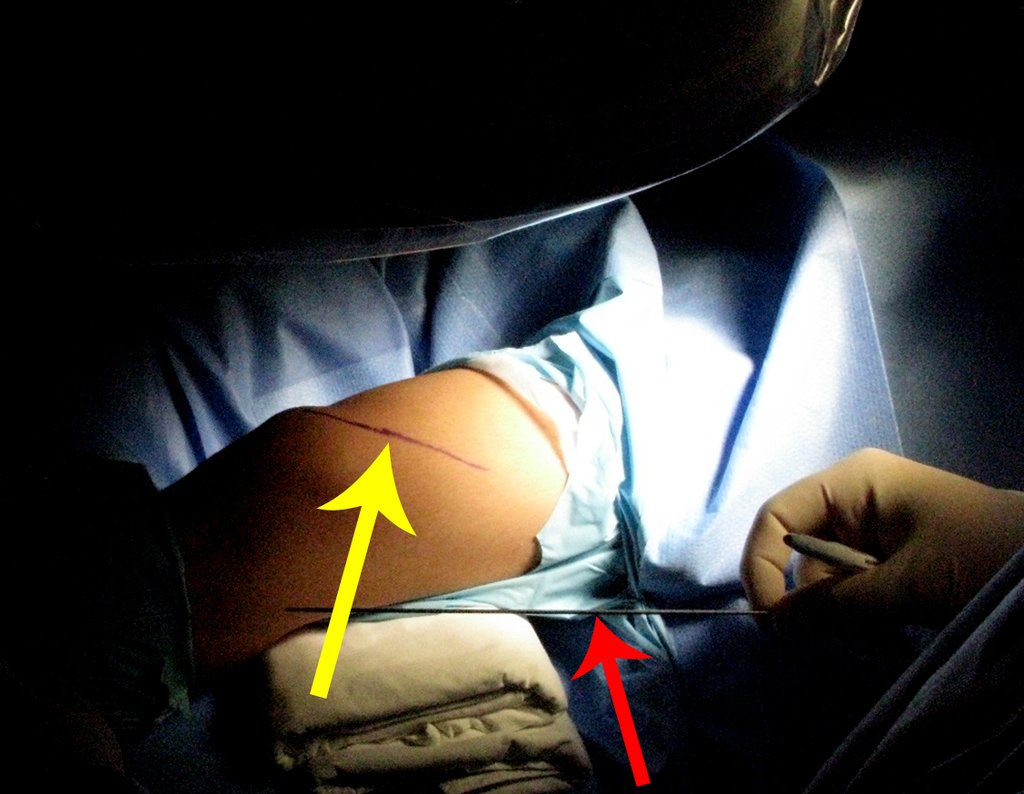
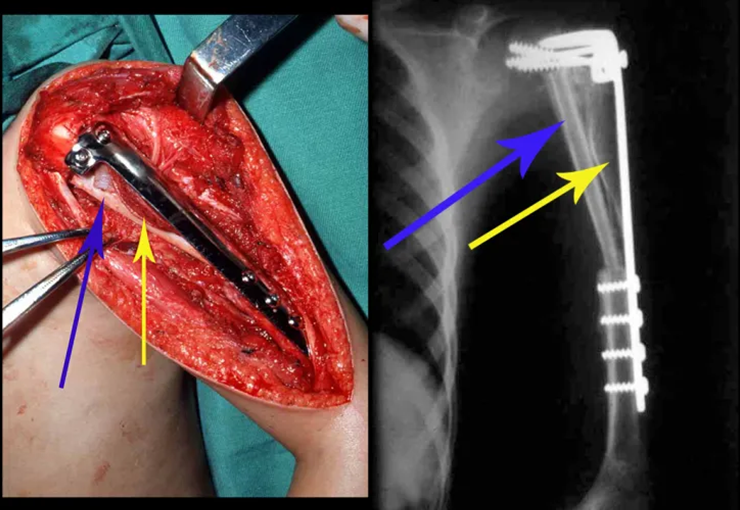
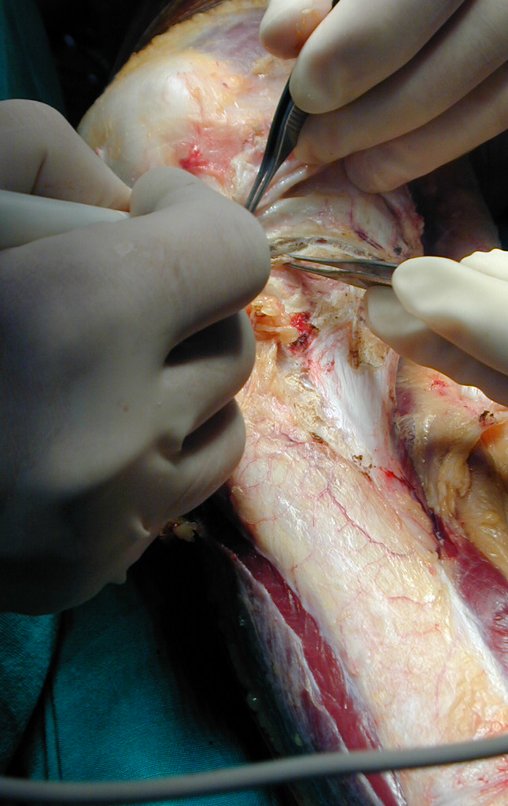
El paciente se coloca en decúbito supino horizontal. Se utiliza una ruta de acceso única y curva, que comienza por encima de la articulación tibioperonea proximal, desciende anteriormente a lo largo de la cresta tibial y se curva medialmente, unos centímetros por debajo del lugar donde se realizará la osteotomía del peroné (figura 2a).
Se expone el músculo tibial anterior, se abre el perimisio y se desplaza lateralmente el músculo, dejando la capa interna de este perimisio adherida al periostio, con el objetivo de preservar el margen de resección oncológica de la tibia (figura 2b).
Se identifica el cuello del peroné y se aísla el nervio peroneo común. Se aborda la articulación tibioperonea proximal y se libera la cápsula articular, junto con el ligamento anterior, el ligamento posterior, el ligamento arqueado poplíteo, el ligamento colateral del peroné y el tendón del músculo bíceps femoral (figura 2c).
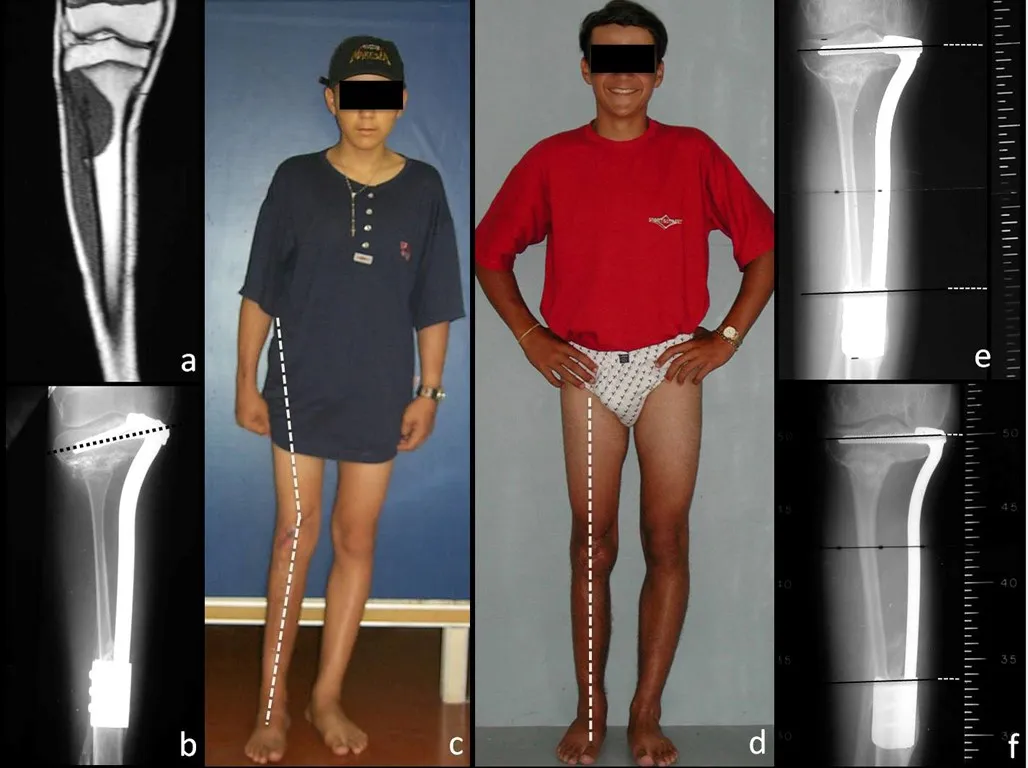
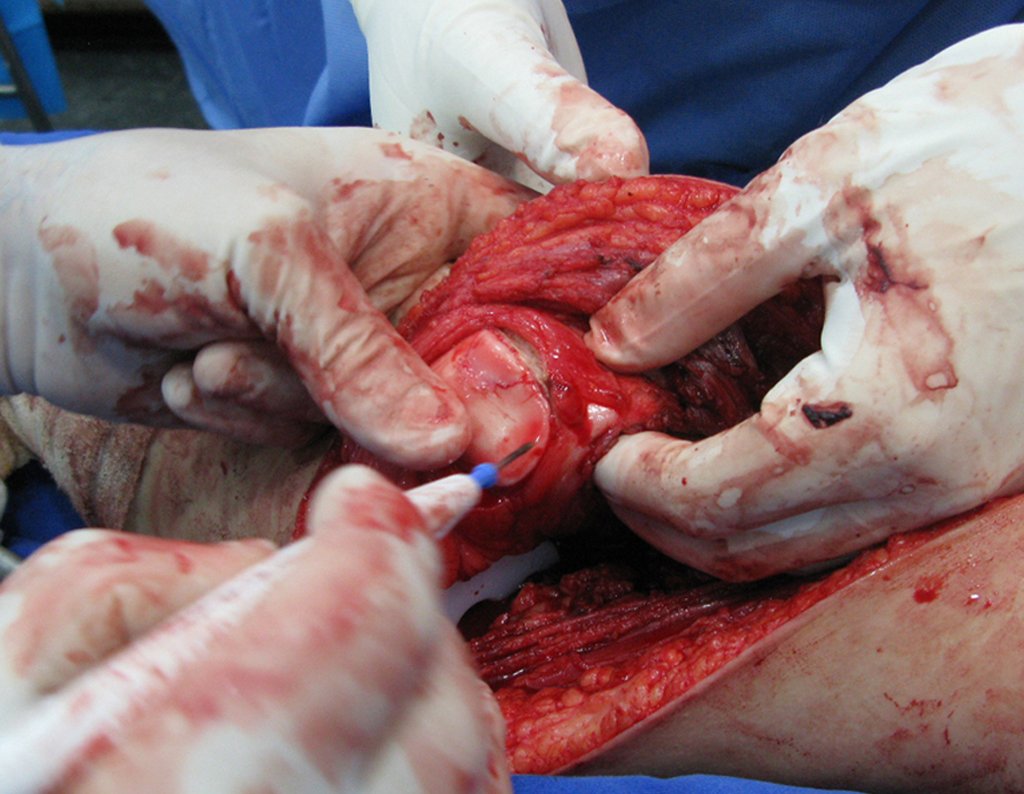
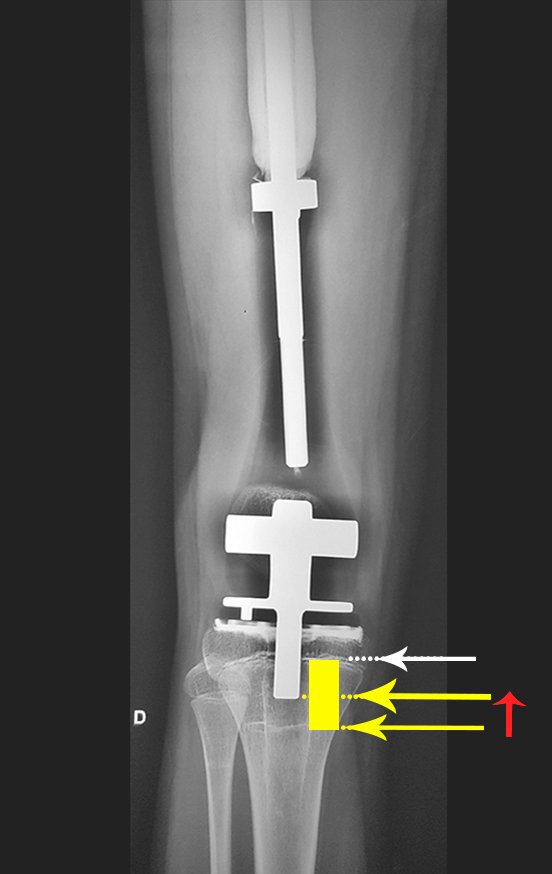
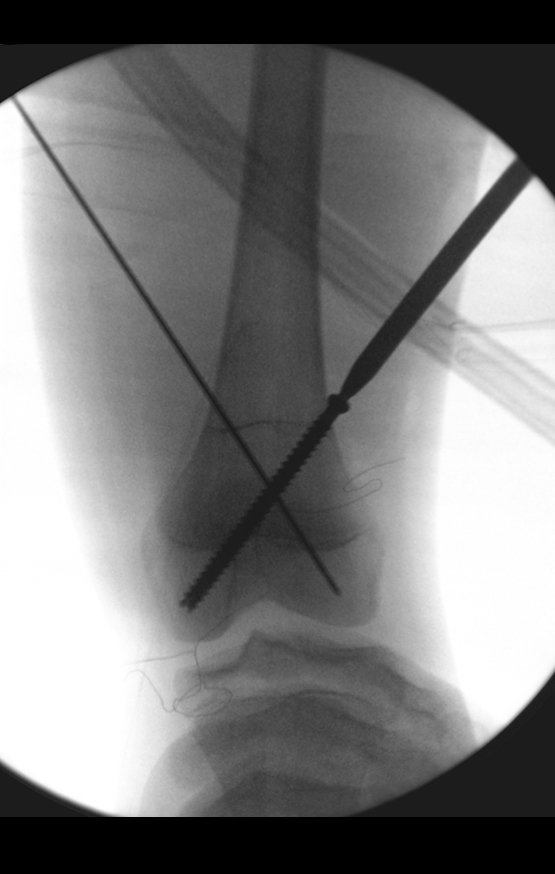
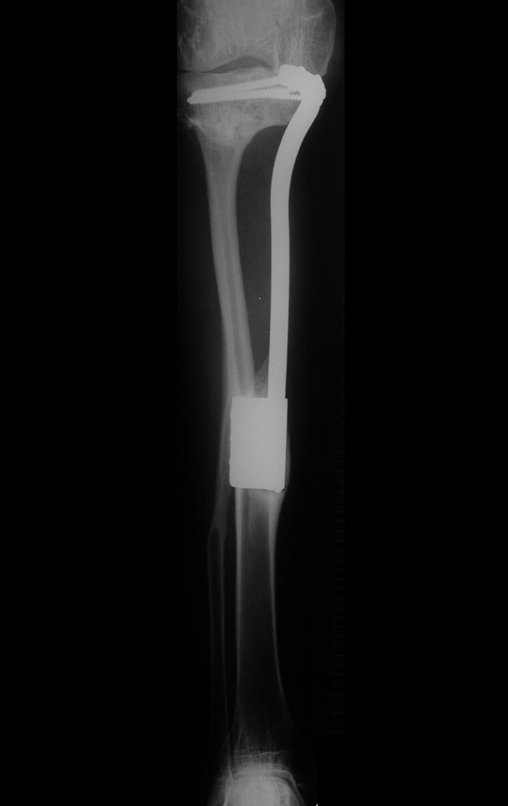
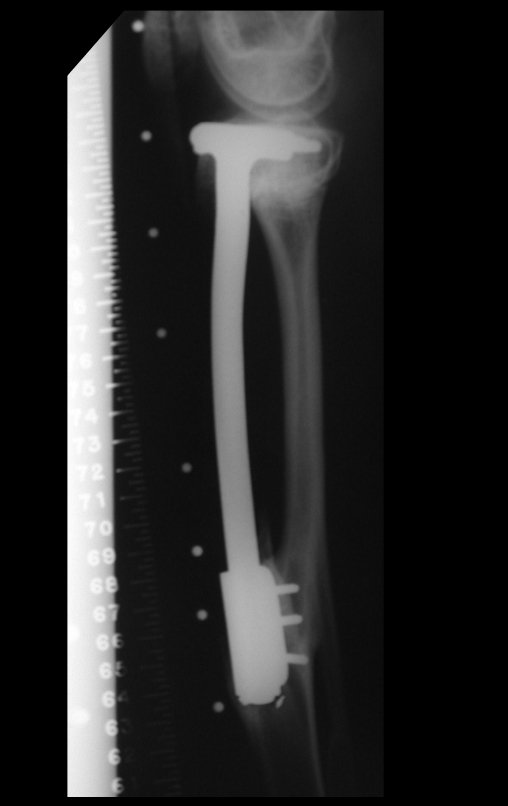
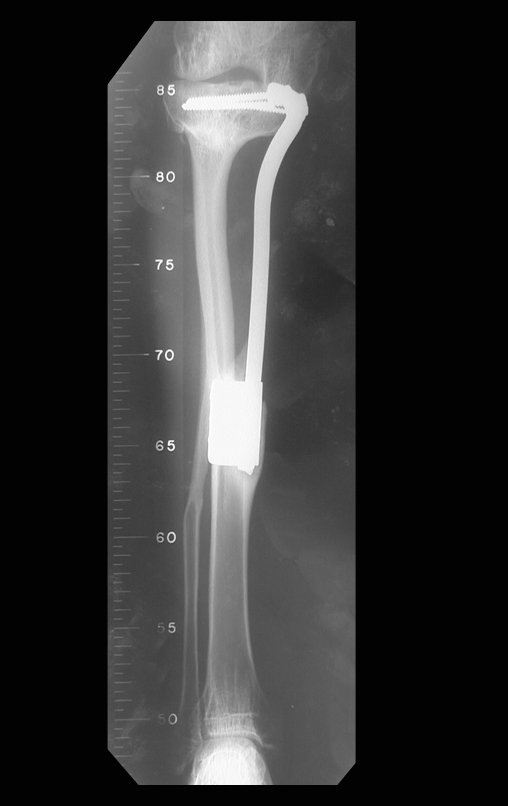
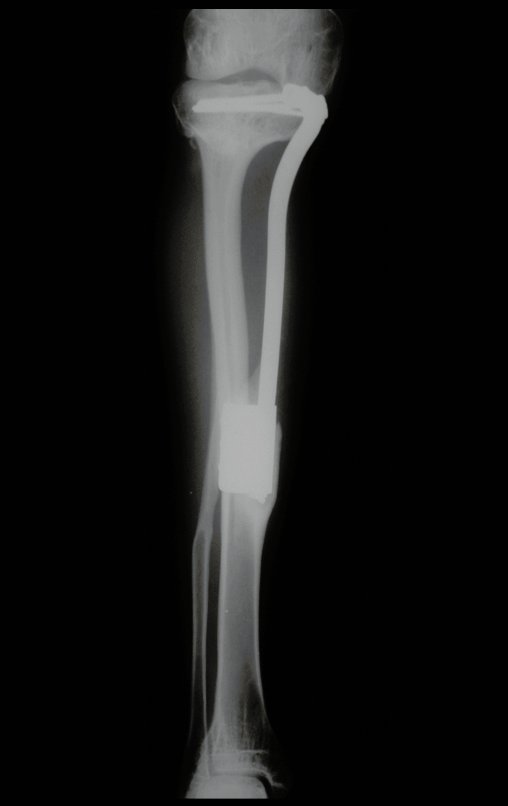
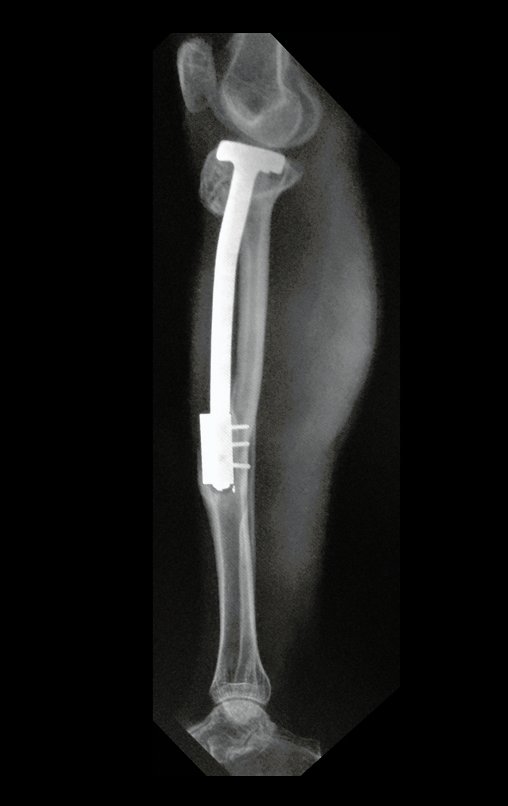
La epífisis proximal de la tibia junto con la tuberosidad anterior se aíslan de la región metafisaria (figura 2d). A través de esta epífisis se pasa una aguja de Kirschner, de manera horizontal, en el punto donde se realizará la fijación proximal y luego se verifica la posición de la placa (figura 3a).
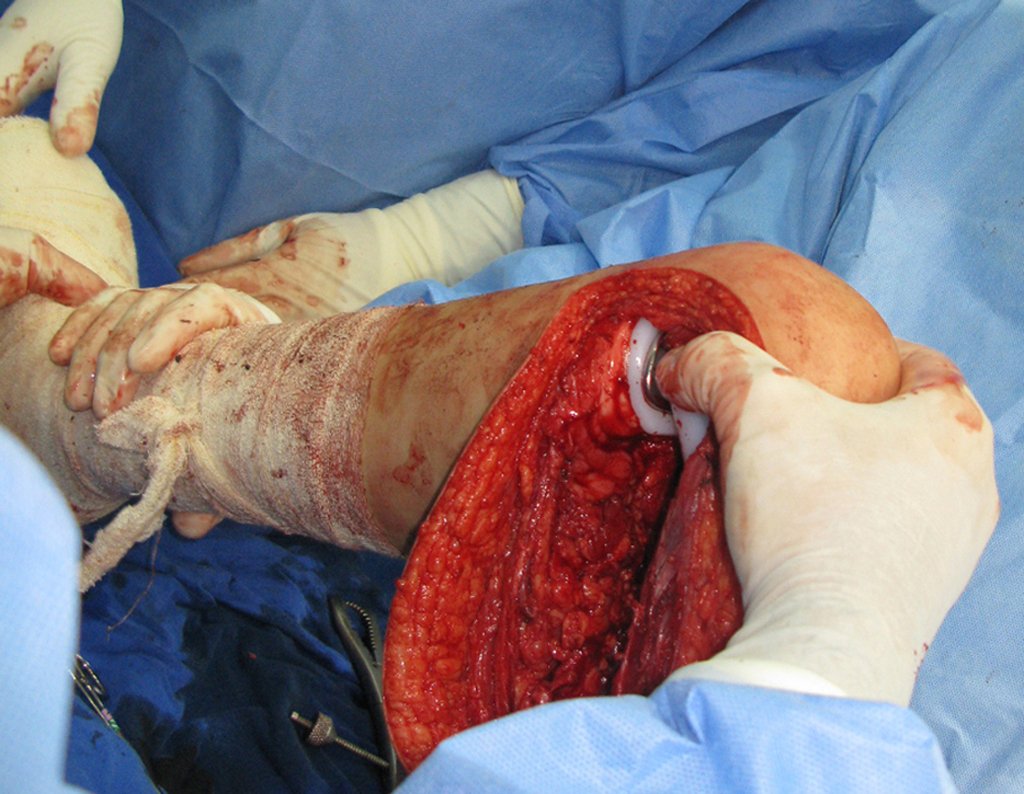
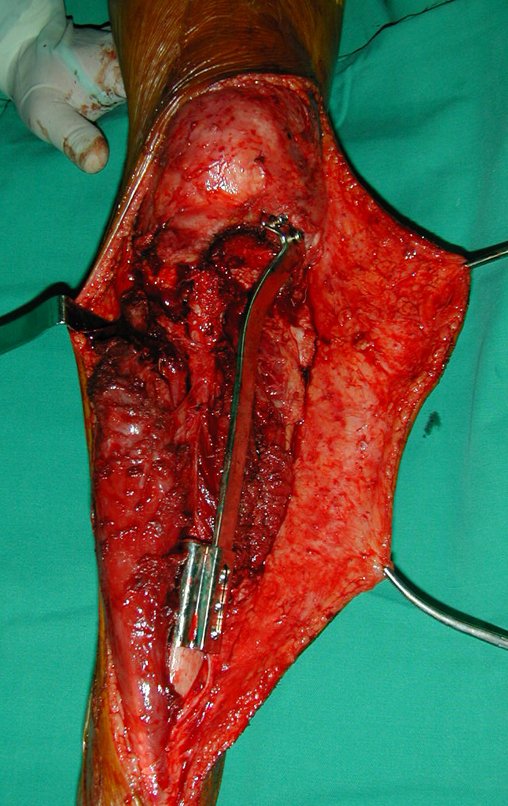
Se mide el segmento a resecar, siguiendo el margen oncológico, y se realiza una osteotomía distal de la tibia, en la región diafisaria. Los músculos posteriores de esta porción se desinsertan en la región epifisaria proximal. Luego se separa la epífisis tibial del tumor mediante osteotomía transepifisaria, preservando la mayor cantidad posible de hueso epifisario con su cartílago articular y se reseca el tumor (figuras 3b y 3c).
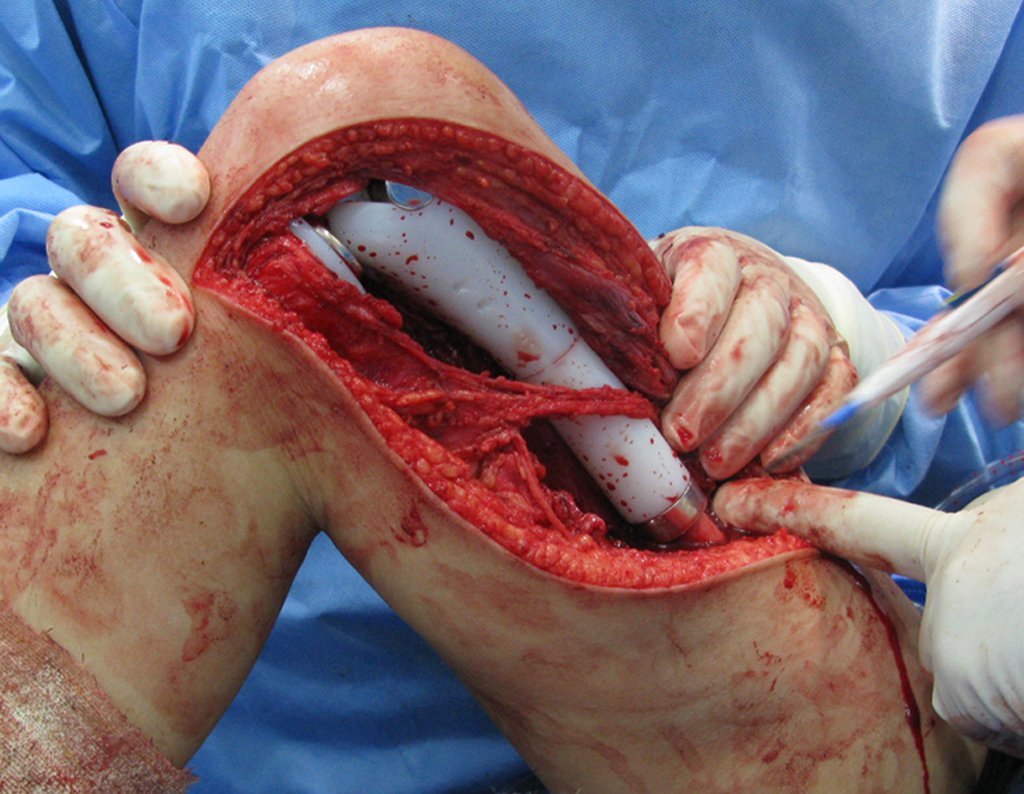
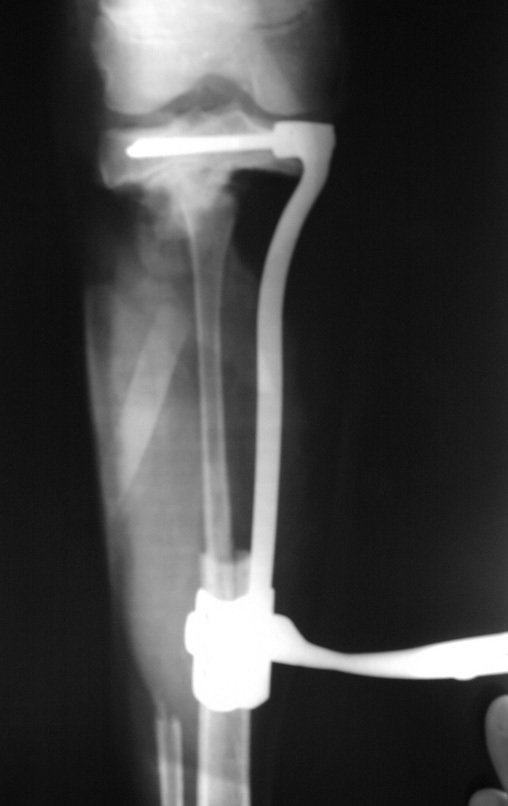
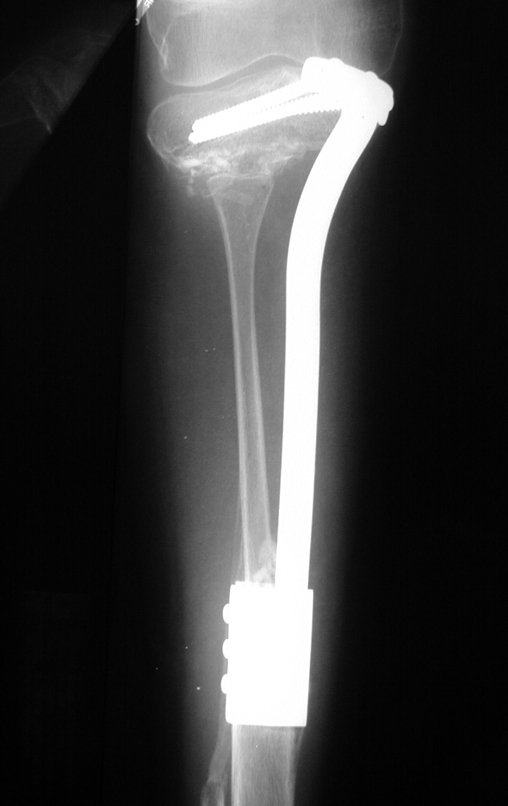
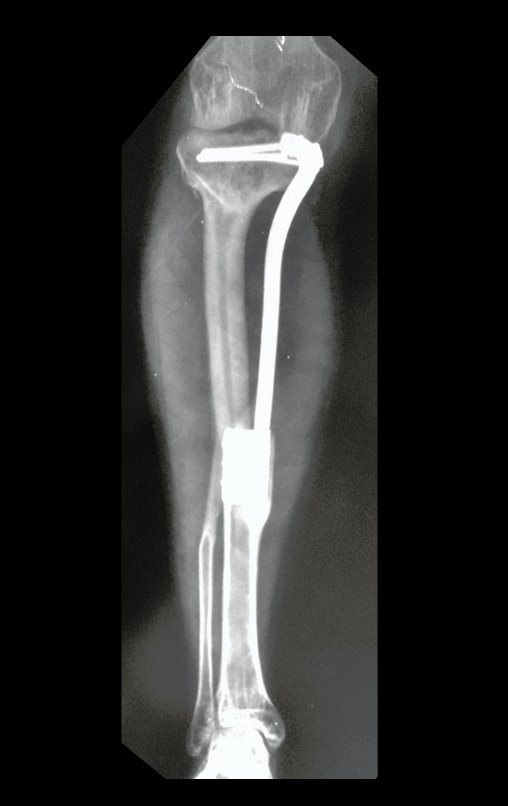
Para reemplazar este defecto óseo se utiliza el segmento proximal del peroné ipsilateral, que se aísla de la articulación tibioperonea y del ligamento colateral lateral. Se realiza una pequeña desperiostización, de uno a dos centímetros, a la altura donde se realizará la osteotomía en la diáfisis del peroné (figura 4a). Después de la osteotomía, esta parte desperiostizada se clava en la diáfisis tibial (figura 4b).
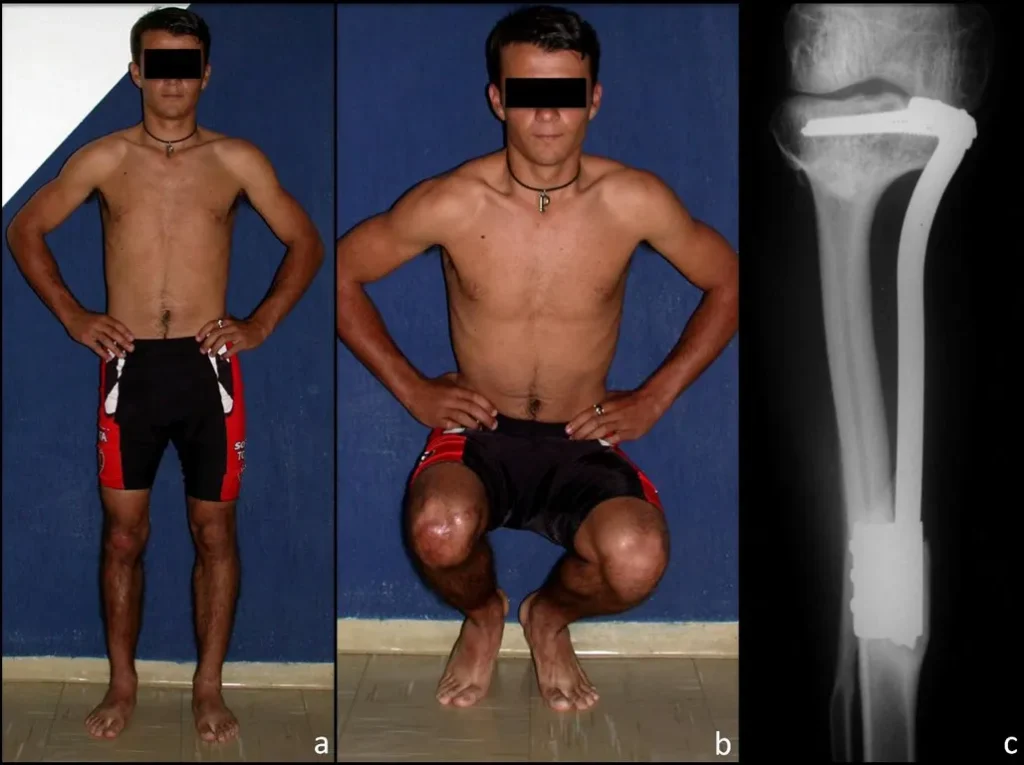
El segmento proximal del peroné, junto con todos los músculos y sus arterias nutricias, se transfiere al centro de la epífisis tibial restante y el ligamento colateral del peroné se inserta en el periostio de la tibia (figura 4c).
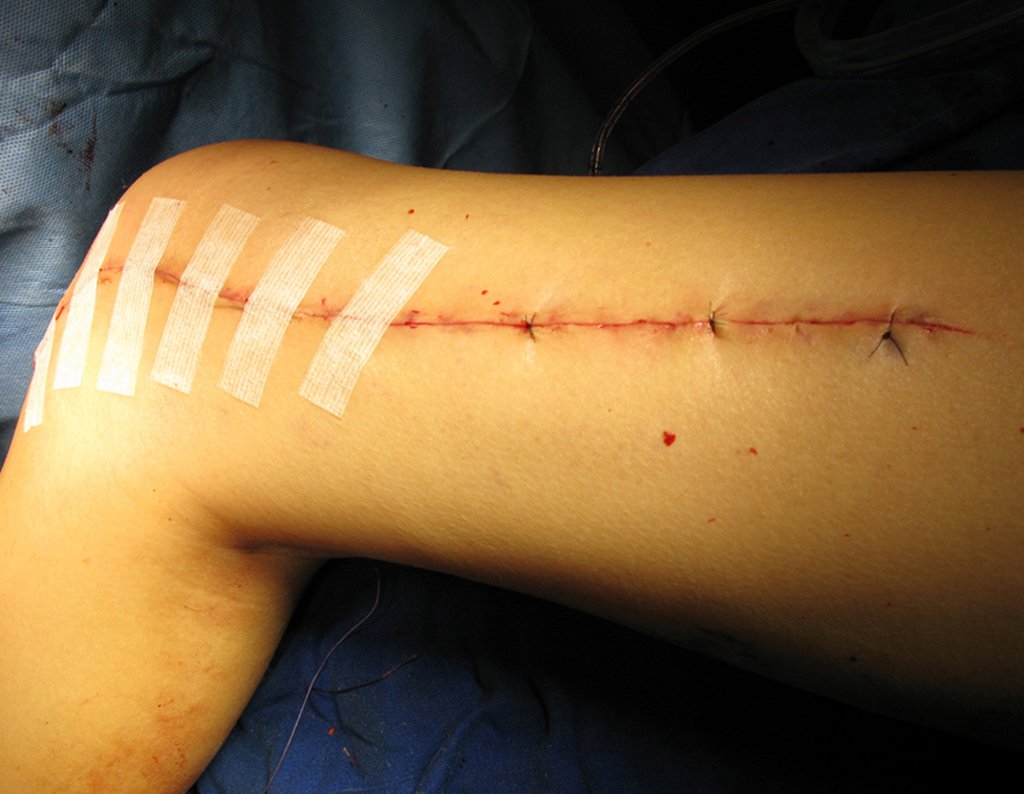
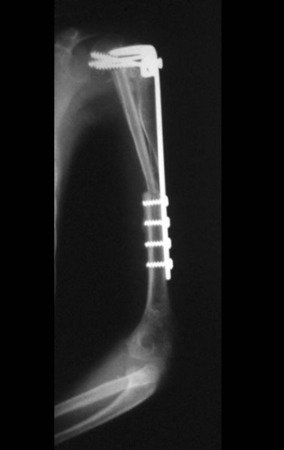
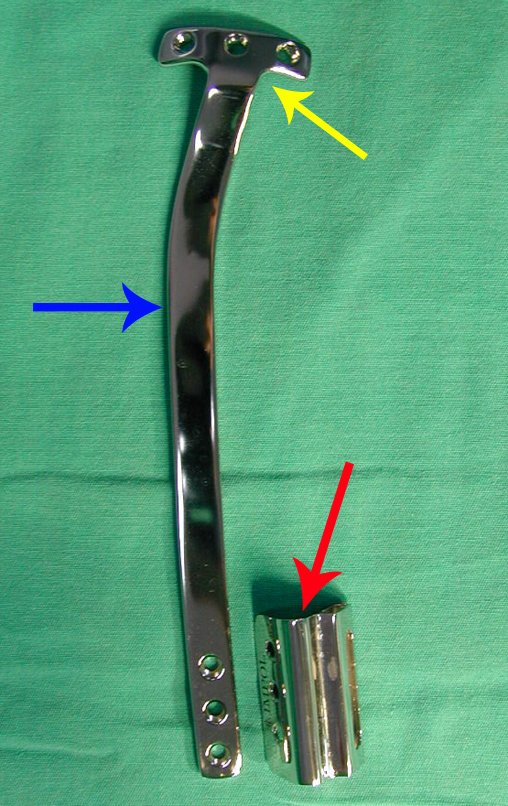
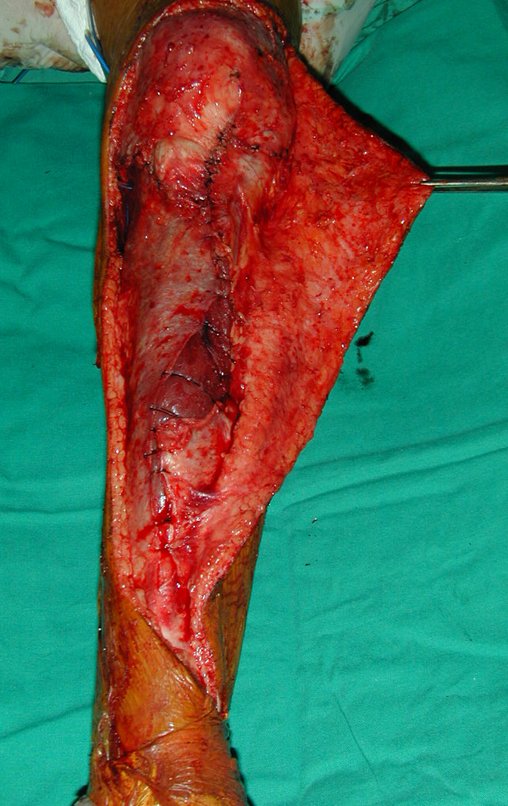
La osteosíntesis con tornillos se realiza mediante un dispositivo de fijación interna extensible, también desarrollado en el Departamento de Ortopedia de la Santa Casa de São Paulo, colocado en el lado medial de la pierna, previamente fabricado a medida para cada caso15,16 (figura 4d).