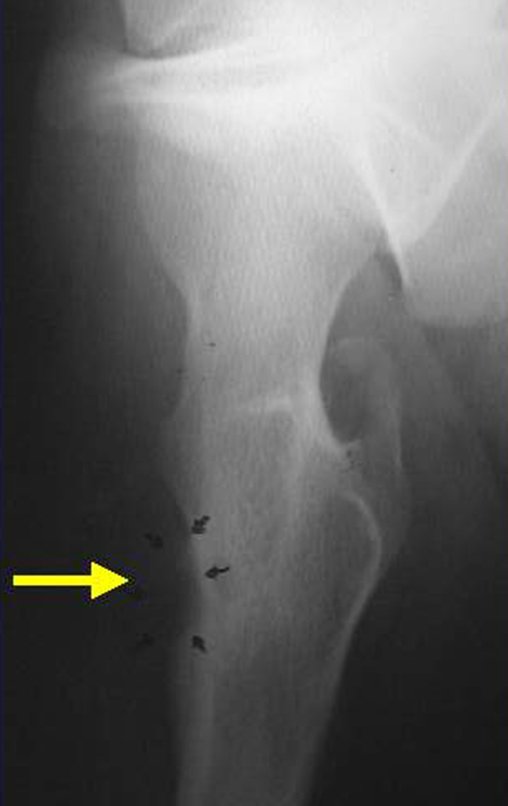
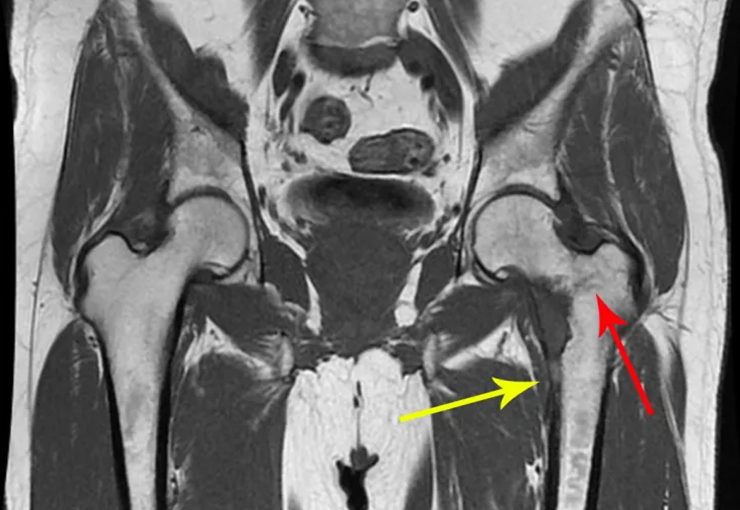
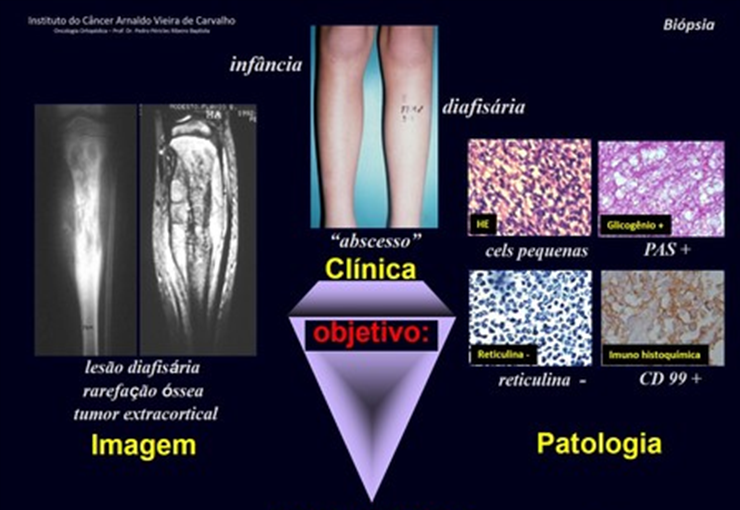
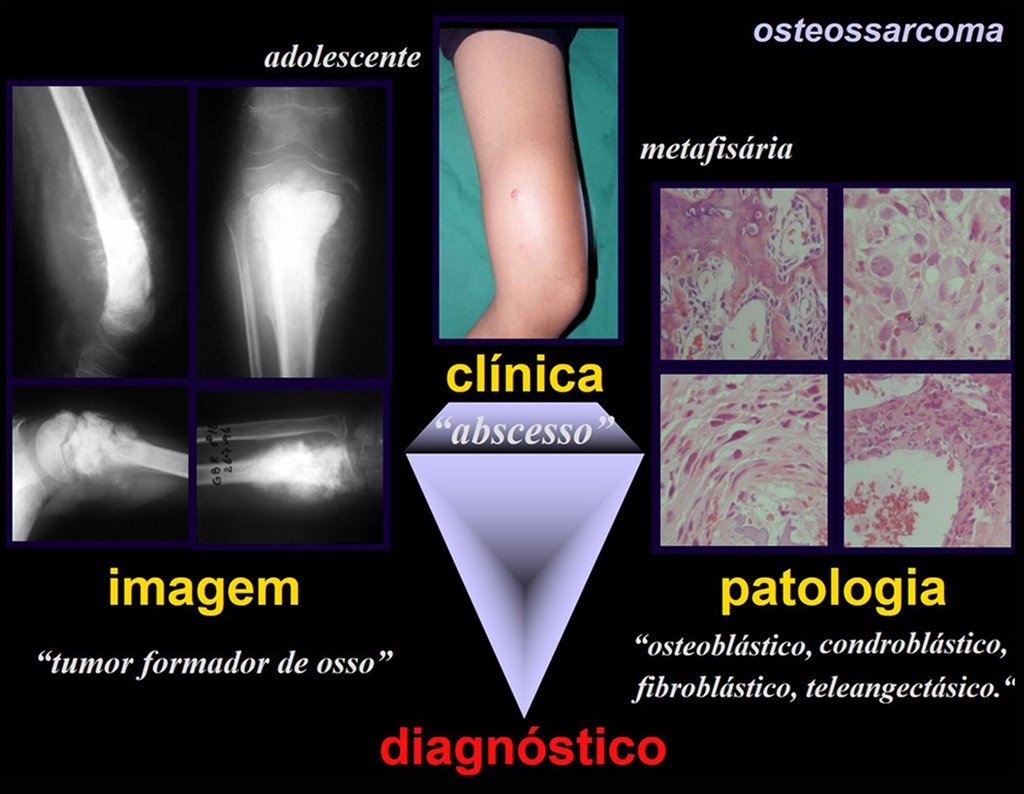
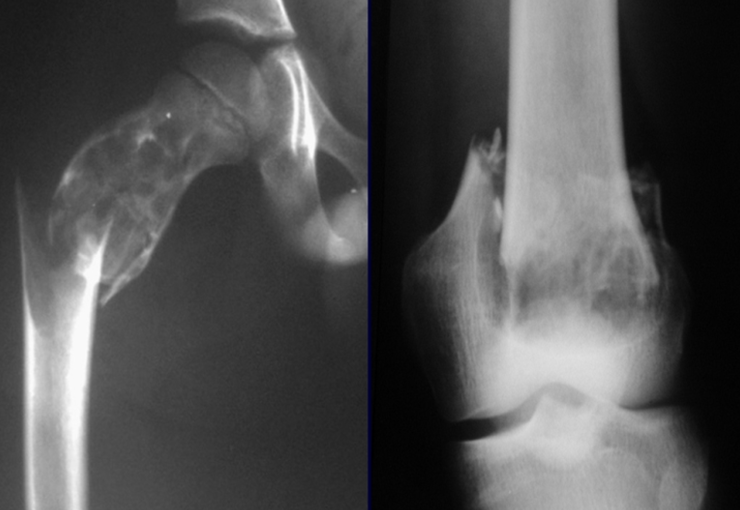
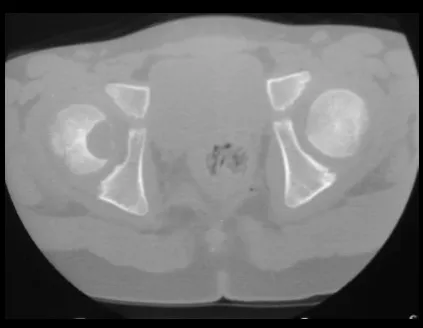
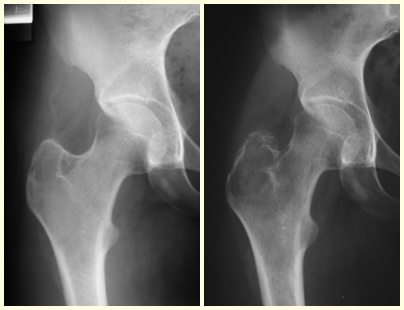
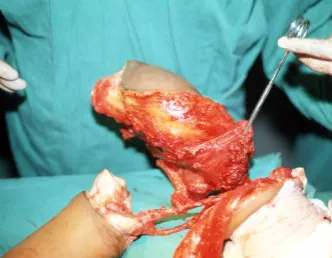
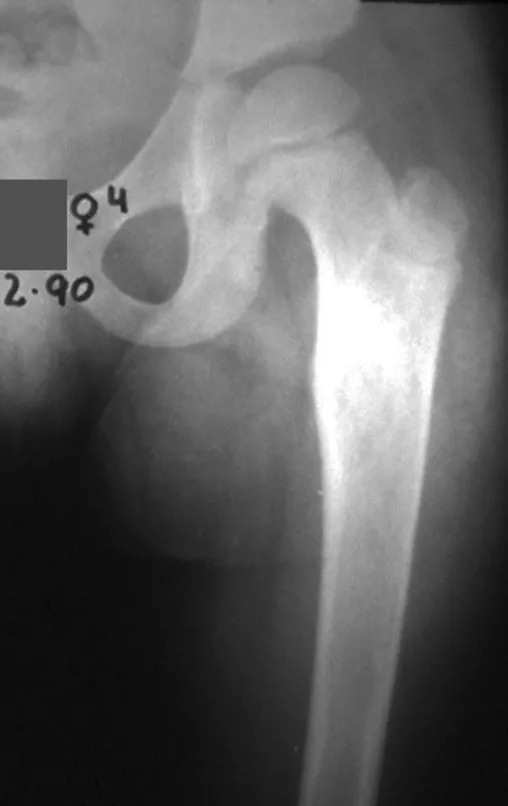
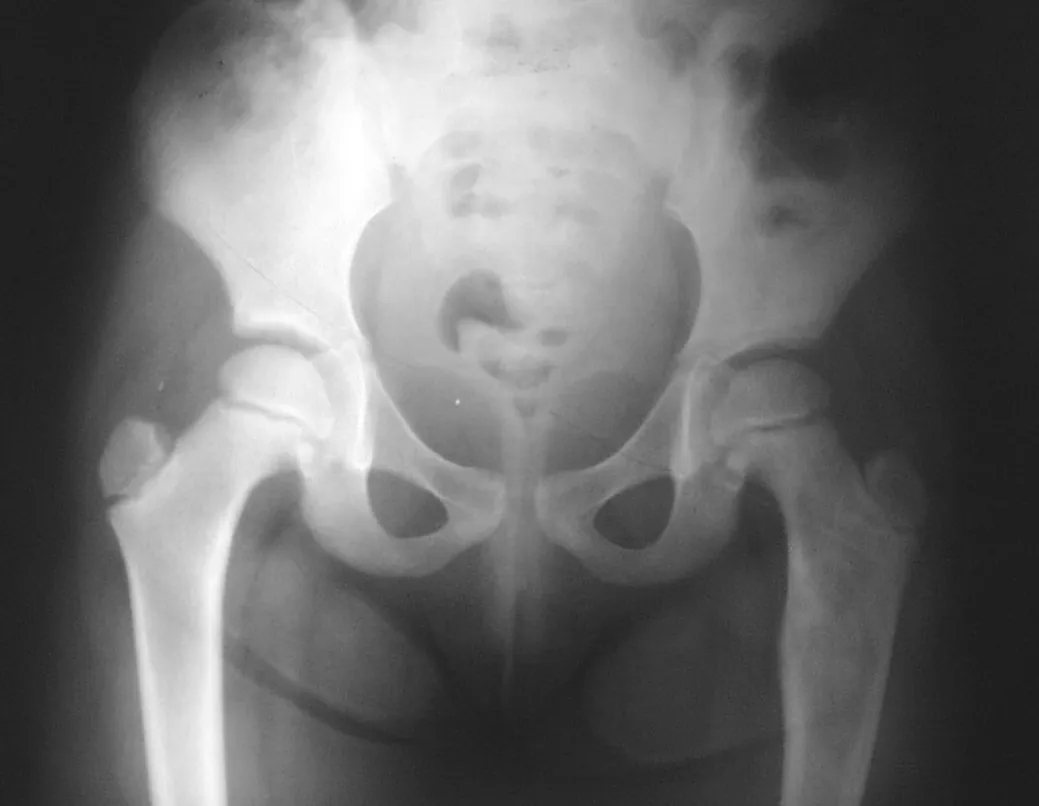
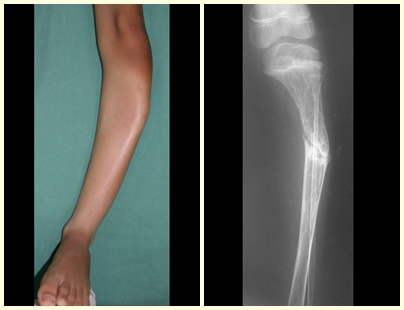
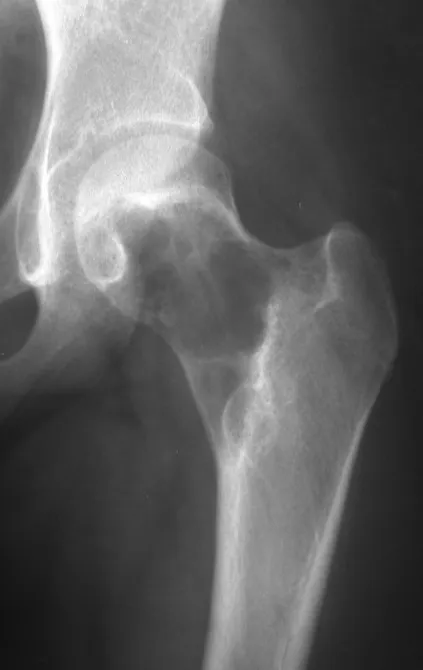
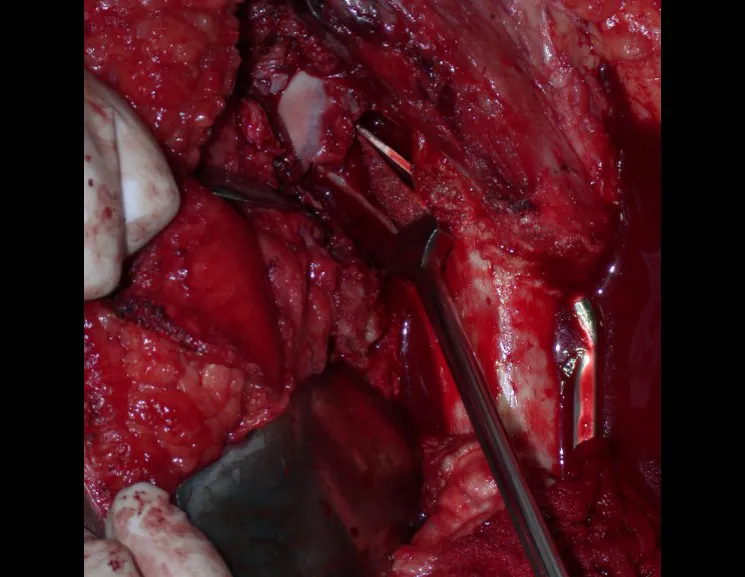
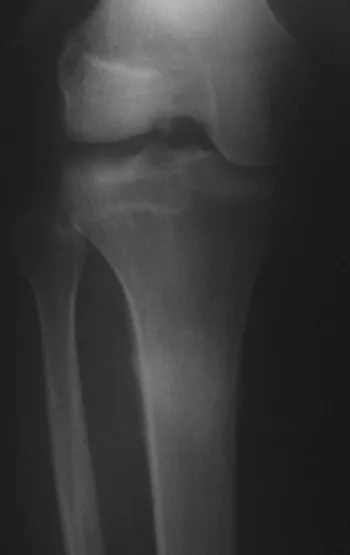
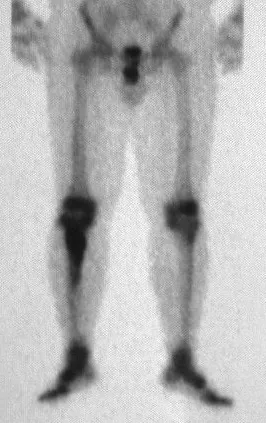
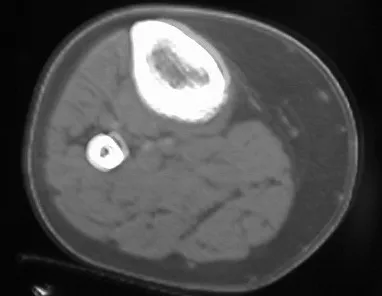
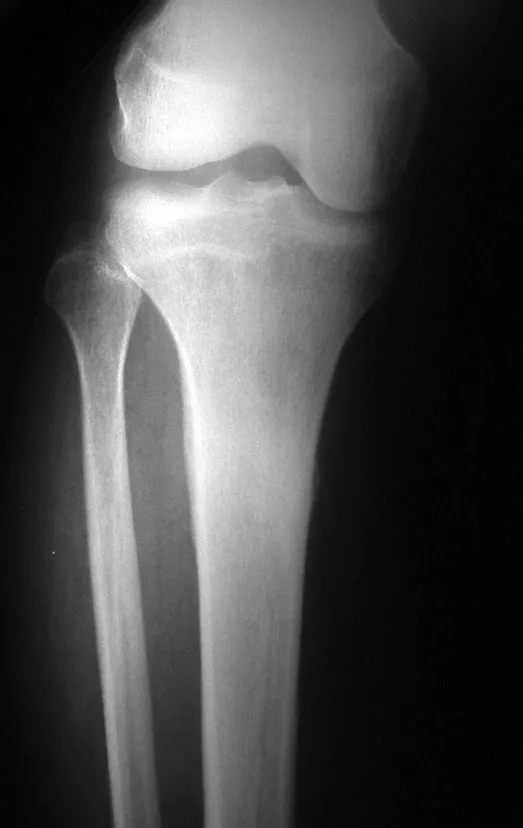
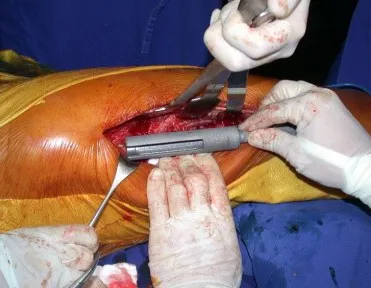
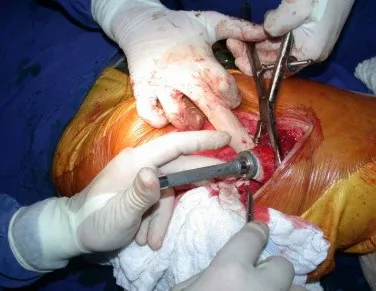
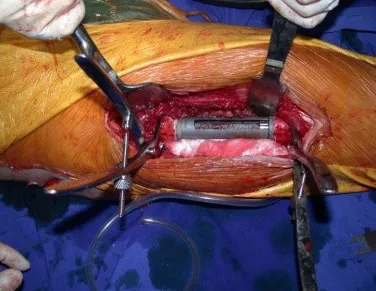
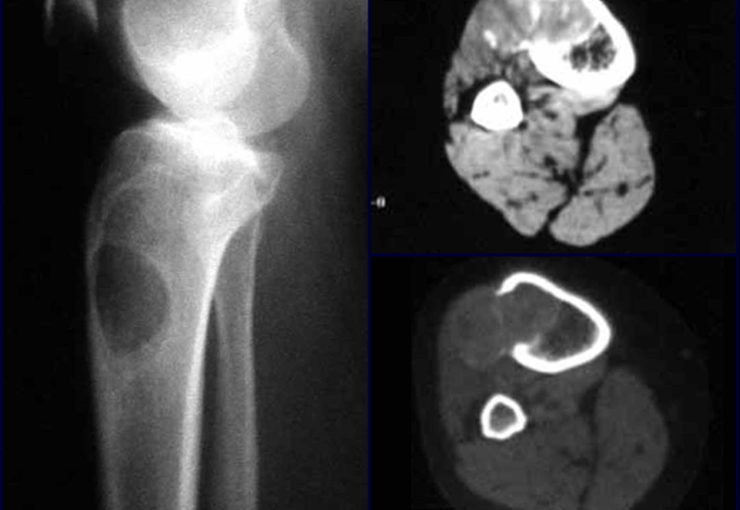
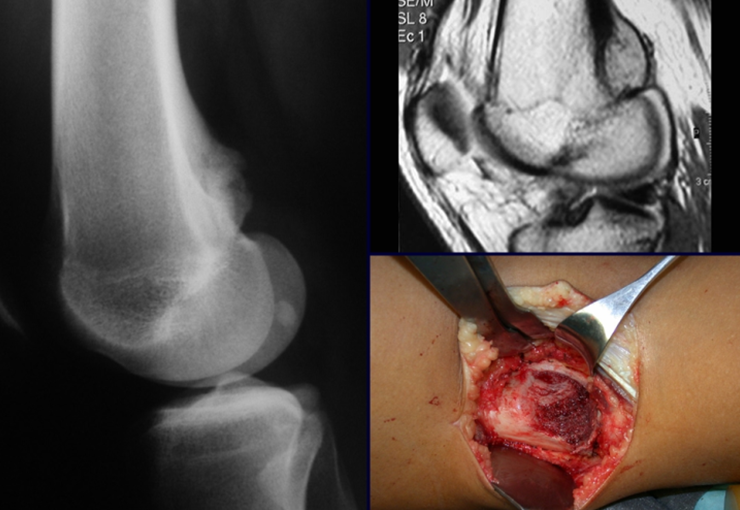
Lesiones pseudotumorales: quiste óseo simple, quiste aneurismático y fibroma no osificante:
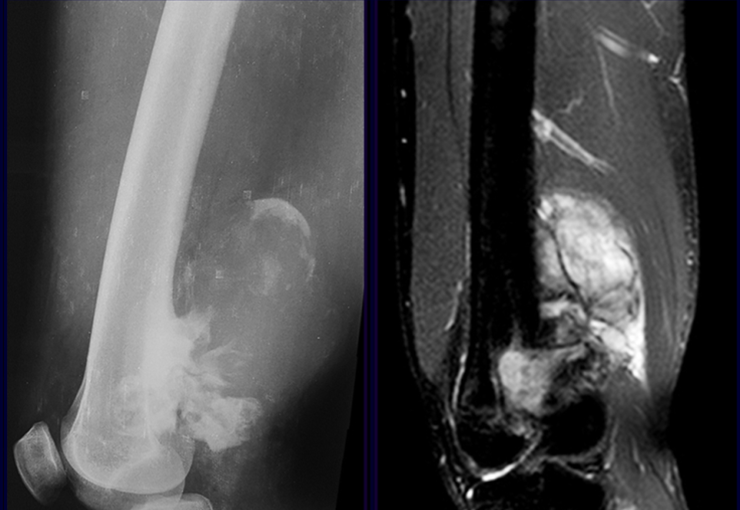
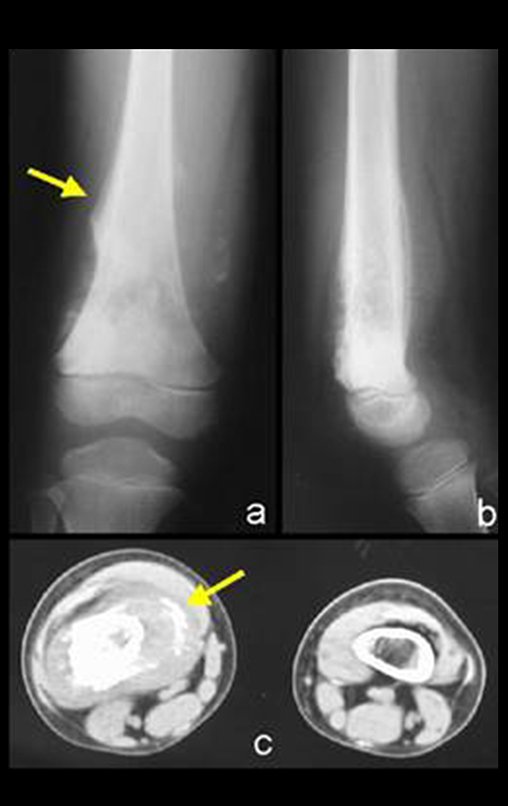
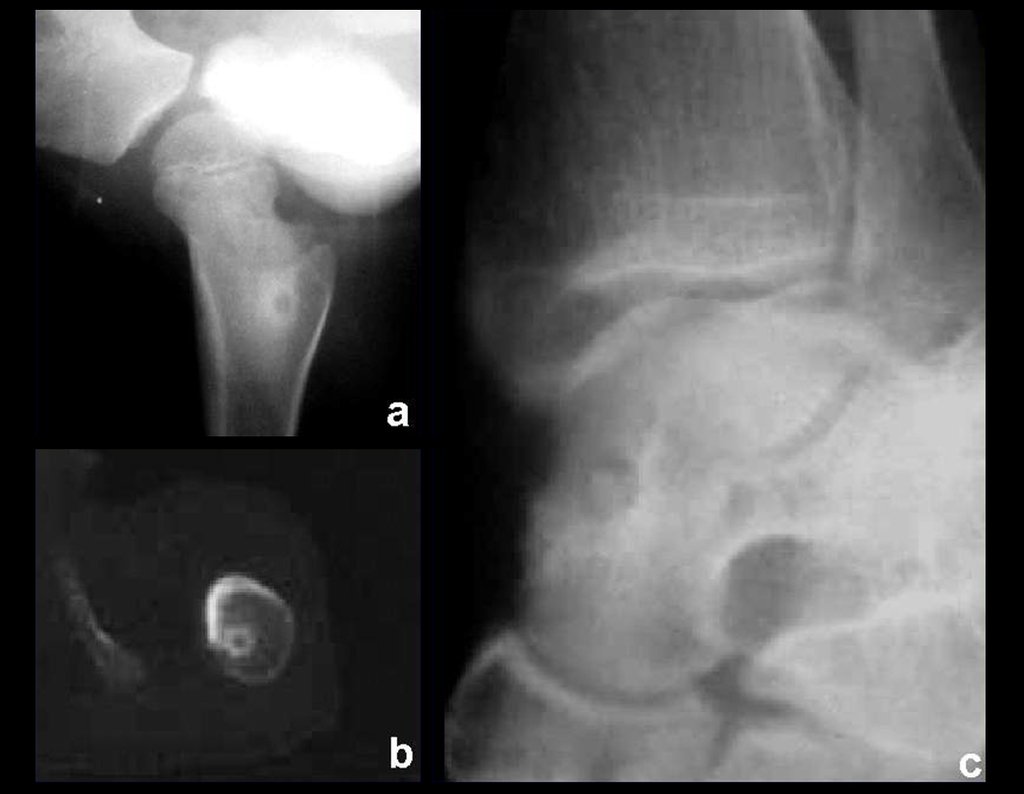
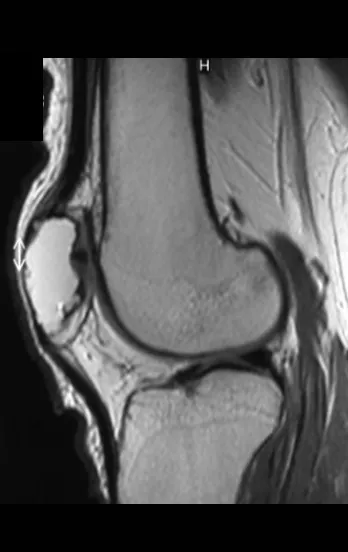
En cuanto a las lesiones pseudoneoplásicas , la que con mayor frecuencia provoca fracturas es el quiste óseo aneurismático . Este proceso, de etiología desconocida, que no tiene aspecto quístico y mucho menos es de carácter vascular, se conoce como la lesión benigna que presenta un comportamiento más agresivo, simulando muchas veces neoplasias malignas.
Otras lesiones pseudoneoplásicas que pueden fracturar son el quiste óseo simple de localización metafisaria, cuando en un hueso con mayor carga como el fémur y la tibia, es propenso a fracturarse. El fibroma no osificante , una evolución del defecto fibroso metafisario cortical, también puede fracturarse por su progresivo aumento de volumen, cuando se localiza en la metáfisis del fémur o la tibia.
No es raro que las fracturas óseas simples o complejas oculten cambios patológicos y puedan dar lugar a un tratamiento ortopédico inadecuado.
Para tratar las fracturas óseas patológicas es necesario estudiar todo el contexto que las rodea. Las fracturas óseas siempre deben analizarse bajo aspectos multidisciplinarios, que tengan en cuenta la historia, grupo etario de los pacientes, aspectos clínicos, imágenes, pruebas de laboratorio y examen anatomopatológico. El estudio conjunto multidisciplinar de estos datos es fundamental para el diagnóstico y manejo de cada caso. Con el diagnóstico correcto, el ortopedista definirá el tratamiento. Siguiendo lo descrito en este capítulo:
Displasias óseas:
1 – Osteopsatirosis u Osteogénesis imperfecta.
Tratamiento : Clínico: Actualmente se utiliza el uso de bifosfonatos.
Ortopédico: osteosíntesis intramedulares para apoyar el crecimiento alineado, con varillas telescópicas, asociadas o no a osteotomías para corregir deformidades.
2 – Osteopetrosis
Tratamiento : Clínico: Prevención de deformidades
Ortopédico: osteosíntesis de fracturas.
3 – Displasia fibrosa, mono o poliostótica,
Tratamiento : Clínico: El uso de bifosfonatos puede tener efecto.
Ortopédico: osteosíntesis
Cambios metabólicos:
1 – Osteoporosis
Tratamiento : Clínico: prevención de fracturas, evitar la cafeína, caminar. Puede estar indicado el uso de bifosfonatos.
Ortopédico: osteosíntesis de fracturas.
2 – Osteomalacia y raquitismo
Tratamiento : Clínico: Corrección de la homeostasis, vitamina D, prevención de deformidades.
Ortopédico: osteosíntesis de fracturas.
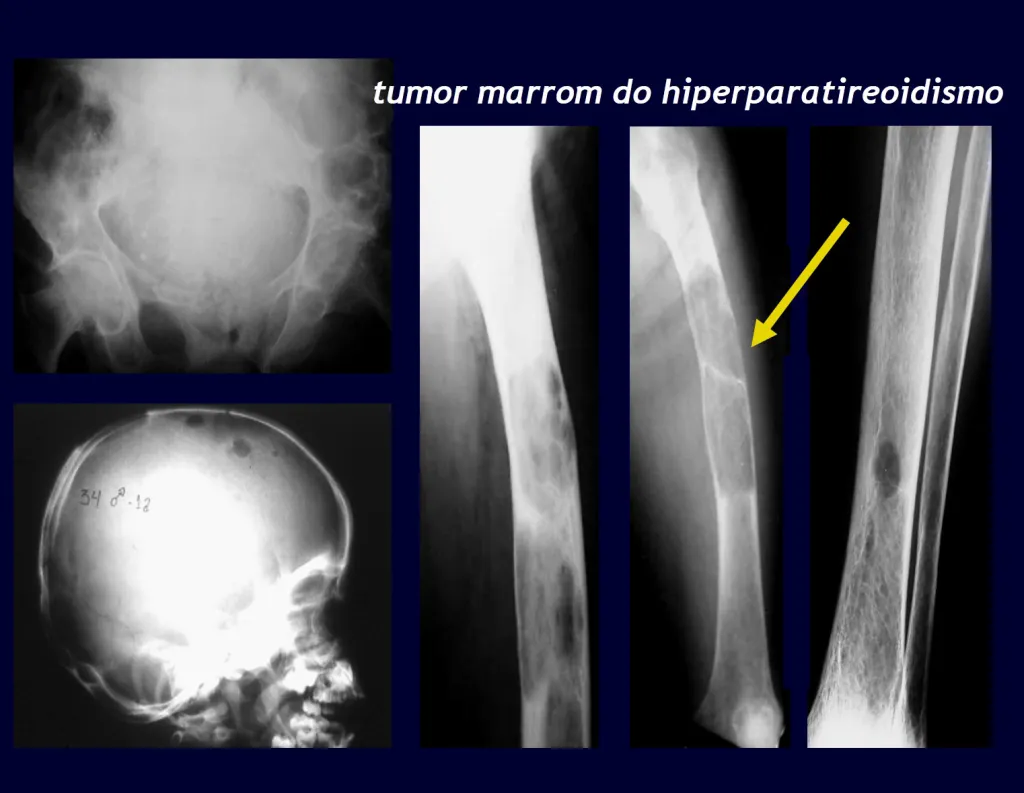
3 – Hiperparatiroidismo
Tratamiento : Clínico: resección del tumor de paratiroides y compensación de la condición metabólica, teniendo en cuenta la marcada hipocalcemia que se produce tras la cirugía, ya que el tejido óseo comienza a compensar rápidamente la desmineralización ósea existente. El aporte de proteínas es fundamental para la creación de la matriz ósea.
Ortopédico: osteosíntesis de fracturas, que curan rápidamente, ya que el hueso carece de calcio.
Enfermedades degenerativas:
1 – Granuloma eosinofílico
Tratamiento : Clínico: terapia con corticosteroides.
Ortopédico: curetaje de la lesión ósea. En la vértebra plana de Calvé, la propia fractura en cuña conduce a la curación del proceso. En niños y adolescentes el cuerpo vertebral crece espontáneamente corrigiendo la deformidad.
2 – enfermedad de Gaucher
Tratamiento : Clínico:
Ortopédico:
Trastornos circulatorios:
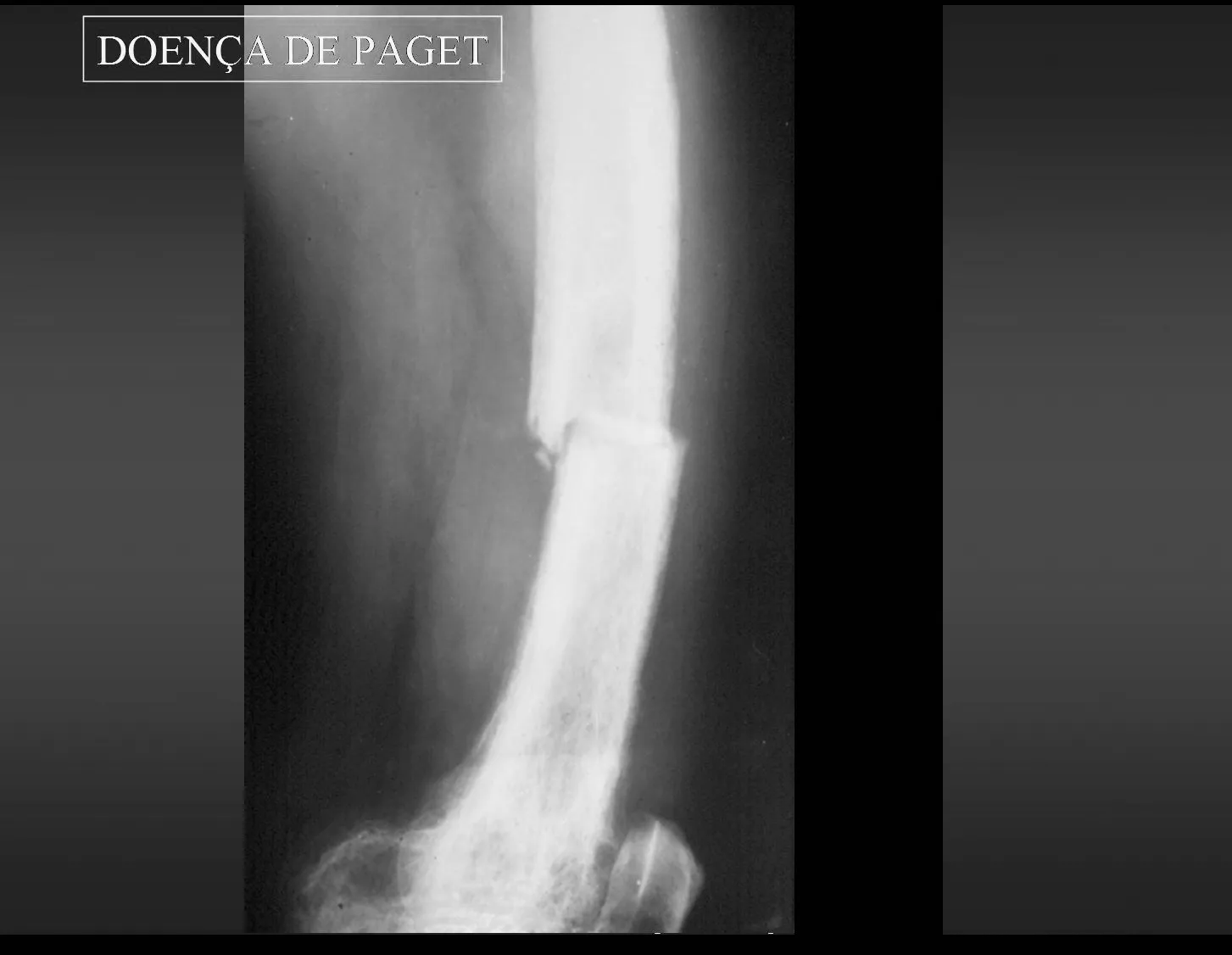
1 – enfermedad de Paget
Tratamiento : Clínico: Bifosfonatos y antiinflamatorios.
Ortopédico: osteosíntesis de fracturas.
2 – En discrasias sanguíneas
Tratamiento : Clínico:
Ortopédico:
Inflamaciones:
1 – Osteomielitis hematógena
Tratamiento : Clínico: terapia con antibióticos.
Ortopédico: drenaje de abscesos, eliminación de secuestros óseos y estabilización de fracturas.
2 – Tuberculosis
Tratamiento : Clínico: pauta triple para la tuberculosis.
Ortopédico: limpieza de abscesos caseosos e inmovilización, estando frecuentemente indicada artrodesis de las articulaciones afectadas y osteosíntesis de fracturas.
3 – Blastomicosis Sudamericana , cuyo agente es paracoccidioidis brasiliensis y
Tratamiento : Clínico: tratamiento farmacológico específico para la tiña.
Ortopédico: limpieza quirúrgica y cuidados específicos para cada caso.
4 – La equinococosis, en forma de quiste hidatídico, debe tratarse quirúrgicamente.
Neoplasias:
1 – Primitivos benignos : El tratamiento ortopédico puede incluir legrado intralesional, adyuvante local, reconstrucción con osteosíntesis e injerto autólogo o metacrilato de metilo.
2 – Primitivas Malignas : Pueden requerir tratamiento de quimioterapia orientada a la neoplasia y tratamiento quirúrgico de resección y reconstrucción con endoprótesis o reconstrucción biológica, si es posible, o cirugía ablativa.
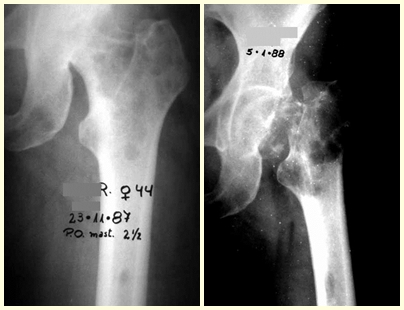
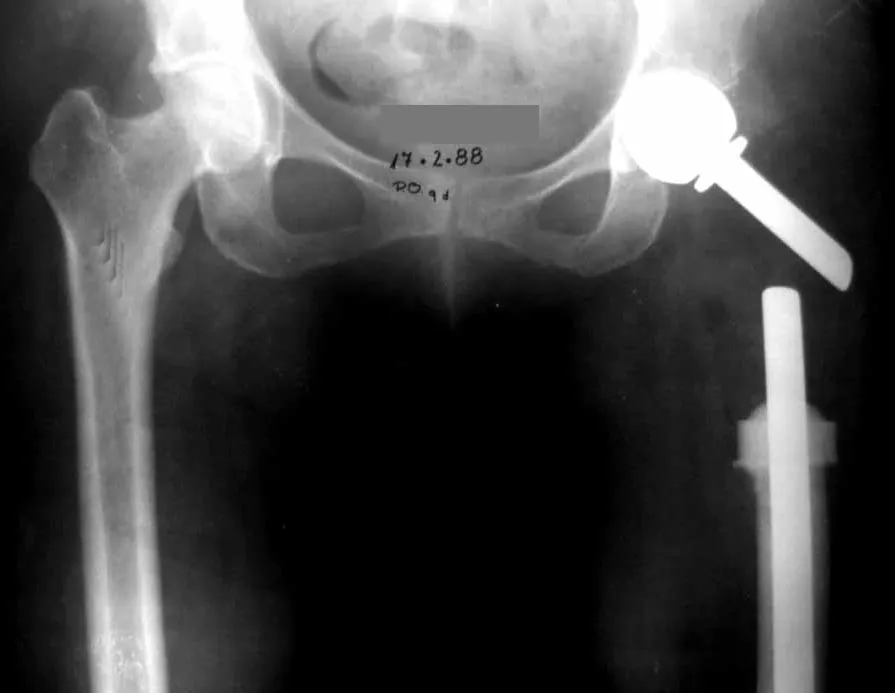
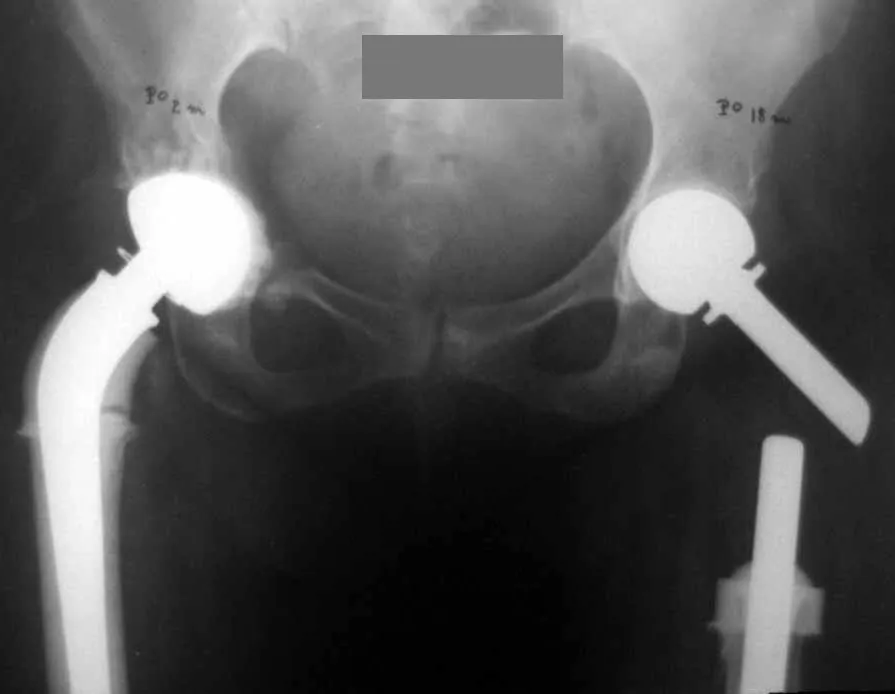
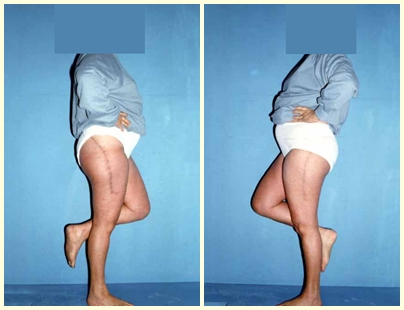
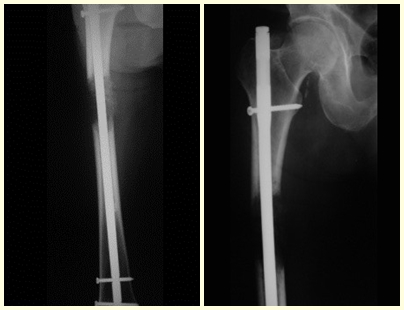
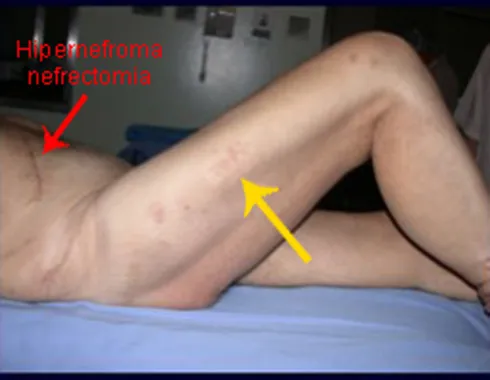
3 – Secundario a metástasis : Restaurar la función es fundamental para la calidad de vida del paciente. La opción de tratamiento para estas fracturas requiere cierta consideración para tomar la decisión adecuada para cada paciente. Algunas de ellas son subjetivas, ya que debemos asumir el tiempo probable de supervivencia del paciente, la posibilidad clínica de que recupere completamente sus funciones, la capacidad de resistir la anestesia, etc.
Buscamos sustentar nuestras decisiones en los siguientes parámetros:
- ¿La lesión es en el miembro superior, miembro inferior, cintura pélvica o columna?
- ¿La lesión es única o hay múltiples lesiones?
- ¿La fractura ya se ha producido o existe riesgo de fractura?
- Si no se produjo ninguna fractura, ¿ya está comprometido 1/3 de la circunferencia del hueso? ¿La lesión cubre un área larga?
- ¿El paciente caminaba antes de la fractura? ¿Tenía una función motora normal?
- ¿Cuánto tiempo lleva el paciente tratado por la enfermedad primaria?
- ¿Está actualmente recibiendo tratamiento de quimioterapia?
- ¿Cuál es el pronóstico temporal de este paciente?
- ¿Qué comorbilidades tienes además de la neoplasia?
- El tipo de neoplasia primaria responde a la radioterapia.
El análisis de estas cuestiones permitirá tomar una decisión terapéutica que ayude al paciente a recuperar su función motora, en consonancia con el tratamiento de su enfermedad de base.
Los pacientes con mieloma tienen una alta tasa de infecciones postoperatorias y suelen beneficiarse de la radioterapia local, especialmente en lesiones de la columna torácica o del miembro superior, en los primeros años de la enfermedad. Después de unos años, cuando la enfermedad se vuelve refractaria a la quimioterapia o al trasplante de médula ósea, incluso las opciones quirúrgicas se ven limitadas debido a la intensidad de la afectación ósea.
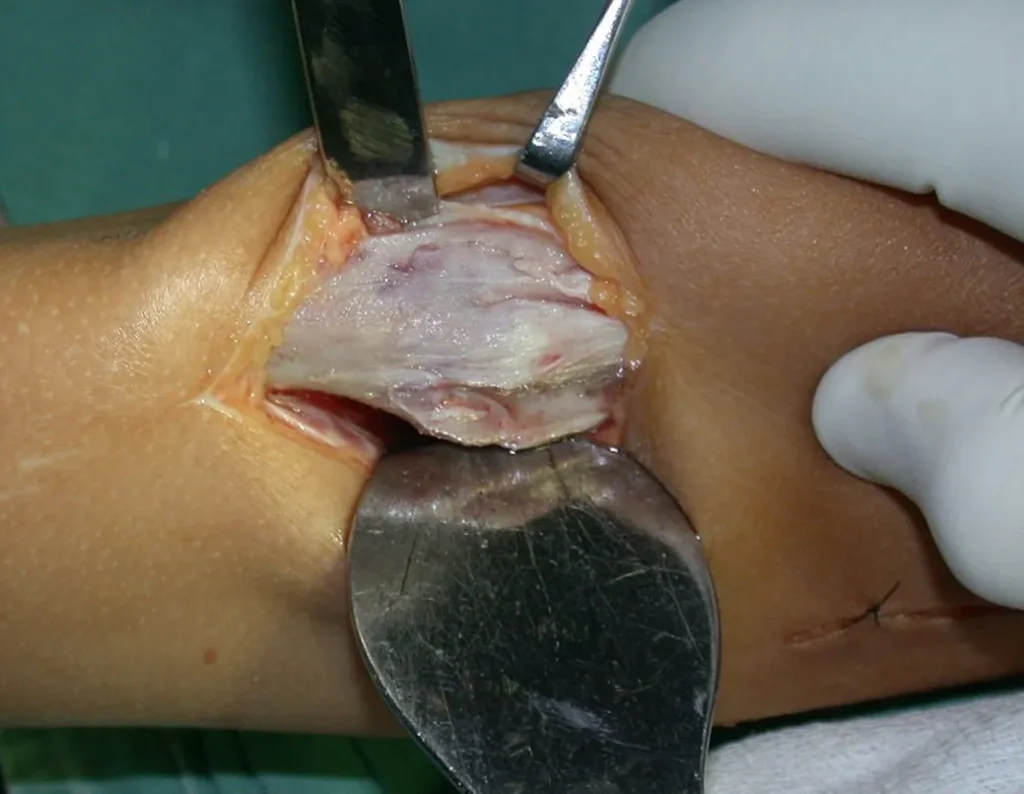
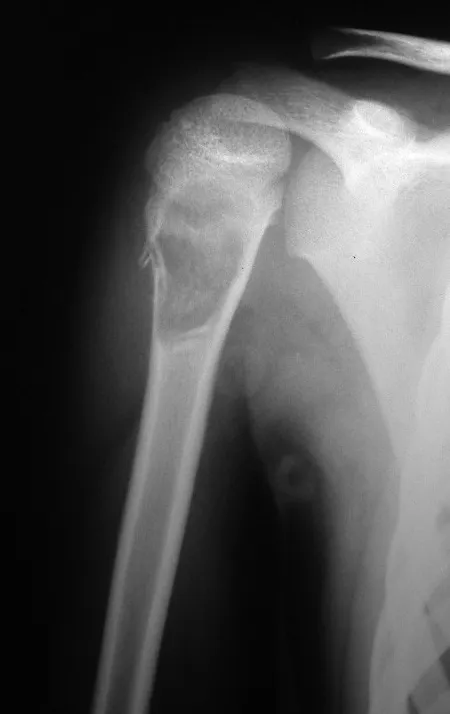
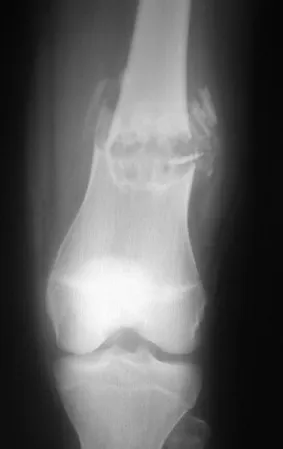
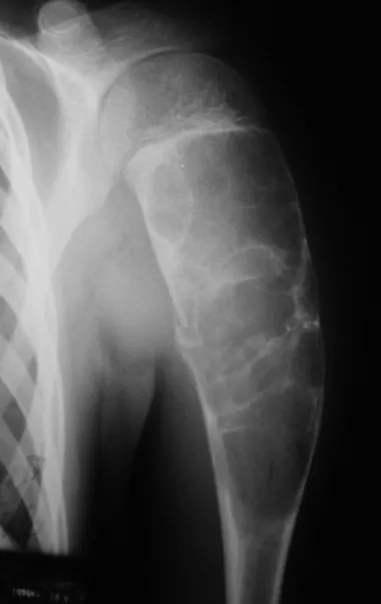
Este caso en las figuras 8 a 12 ejemplifica un paciente con mieloma múltiple, que presenta una lesión extensa en la mitad proximal del húmero derecho. A pesar de ser mieloma, que responde bien a quimioterapia y radioterapia e incluso en el miembro superior, existe indicación de resección de la lesión y reconstrucción con endoprótesis no convencional debido a la destrucción de la anatomía y al rápido restablecimiento de la función.