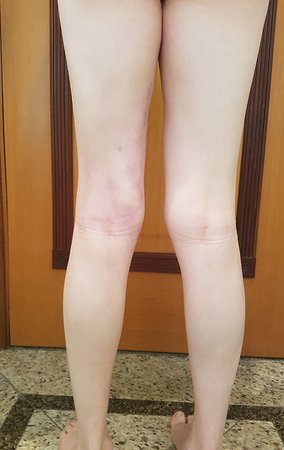
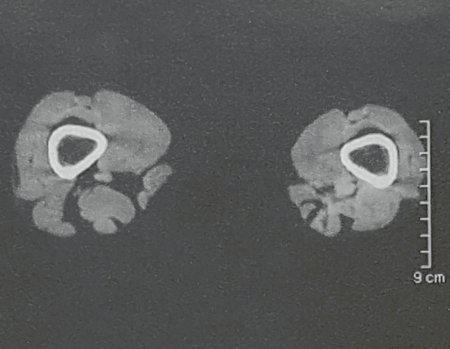
Para una mejor comprensión, le sugerimos leer primero los capítulos:
https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/
Consideraciones de biopsia
1. Sólo después de la evaluación clínica, con una cuidadosa anamnesis y exploración clínica, que nos permitirá plantear hipótesis diagnósticas, debemos solicitar pruebas adicionales.
Con el análisis de los exámenes complementarios debemos verificar:
A- Si nuestras hipótesis son compatibles con las pruebas y continúan calificándose como posibles diagnósticos;
B- Ha aparecido una nueva hipótesis, en la que no habíamos pensado, y tendremos que rehacer nuestro razonamiento clínico.
C- Si los exámenes son correctos, bien hechos, imágenes centradas en la lesión, con buena calidad o tendremos que repetirlos.
2. Las hipótesis diagnósticas deberán formularse previamente mediante la exploración clínica, pruebas de laboratorio y de imagen.
3. La patología debe utilizarse como “herramienta” para confirmar o no el diagnóstico sospechado.
Si el examen anatomopatológico revela un diagnóstico que no estaba en nuestra lista, debemos volver a analizar el caso, rehacer nuestro razonamiento. Si no existe correlación clínica, radiológica y anatomopatológica , algo puede estar mal y necesitaremos revisarlo juntos, en un equipo multidisciplinario, para determinar el mejor curso de acción. ¿Nueva biopsia?
4. Para razonar sobre el diagnóstico, primero es necesario enmarcar la condición que estamos analizando dentro de los cinco capítulos de patología, figuras 1 y 2.
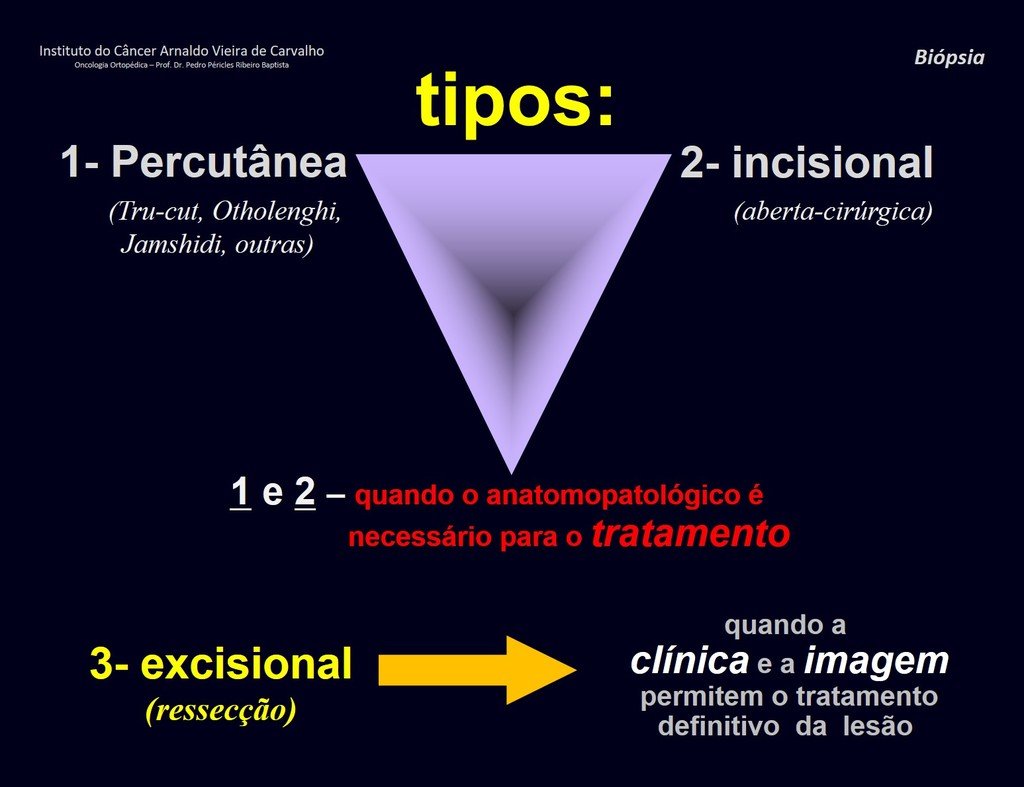
Biopsia – concepto – tipos – indicaciones – planificación
5. Si concluimos que nuestro paciente tiene una neoplasia, debemos realizar el ejercicio de razonamiento ya descrito en los capítulos Introducción al Estudio de los Tumores y Diagnóstico de Tumores (Enlaces: https://oncocirurgia.com.br/introducao-ao -estudo-dos-tumores-osseos/ y https://oncocirurgia.com.br/diagnostico-dos-tumores/ ).
Tras estos pasos, podemos pensar en la biopsia como una “herramienta” para el diagnóstico definitivo.
Antes de abordar el tema “biopsia”, analicemos algunos casos.
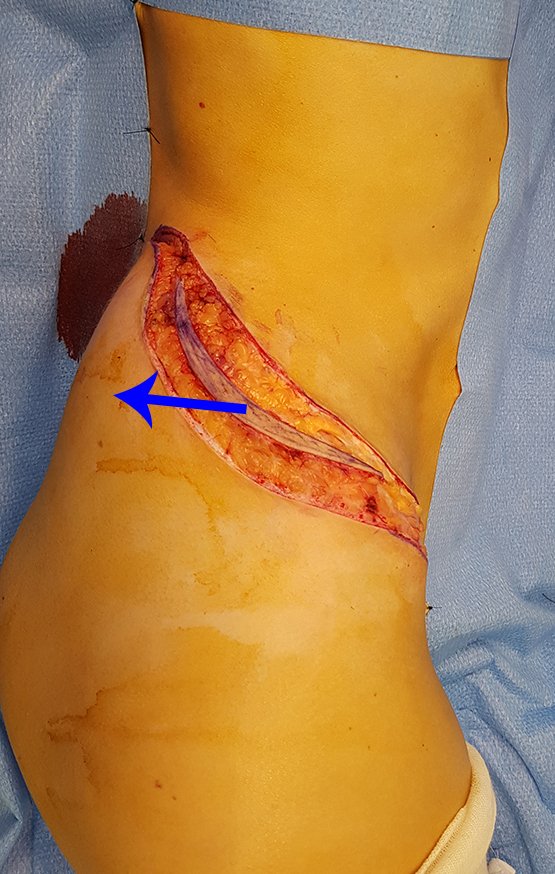
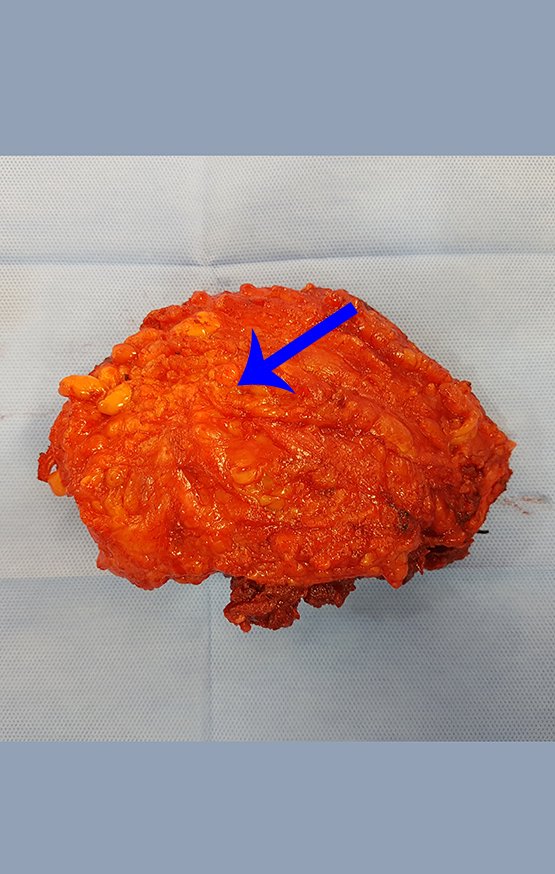
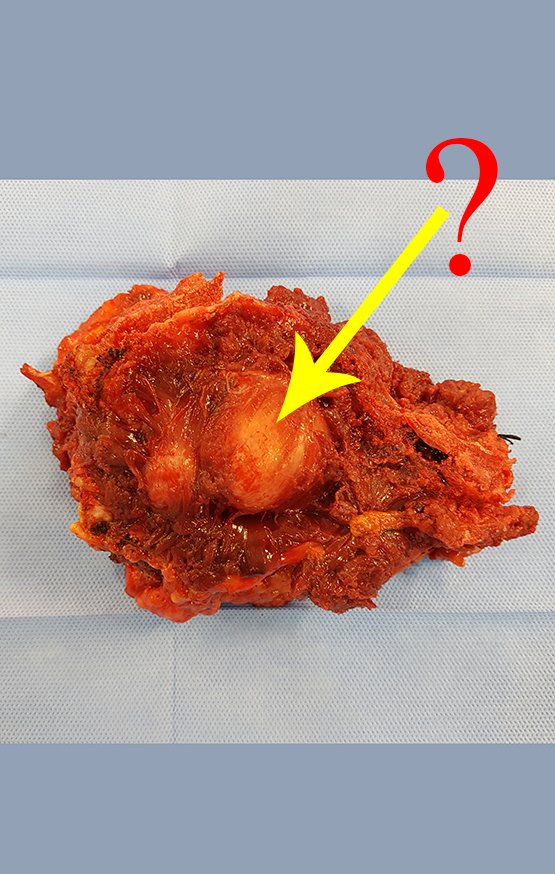
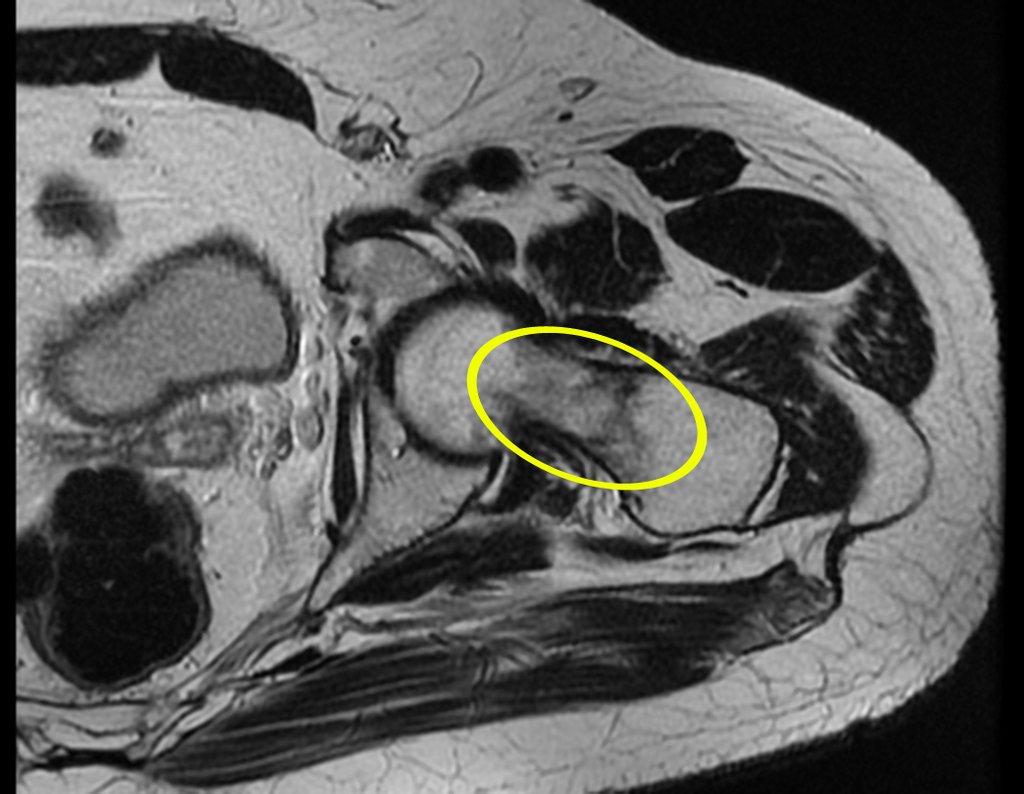
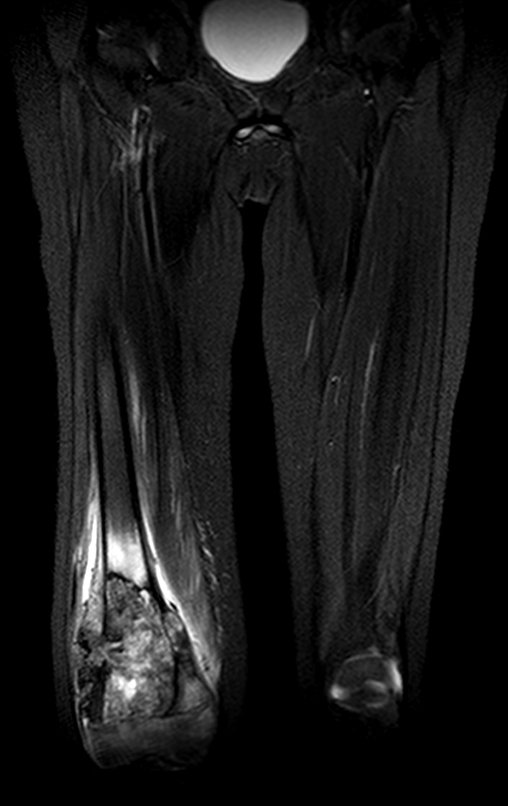
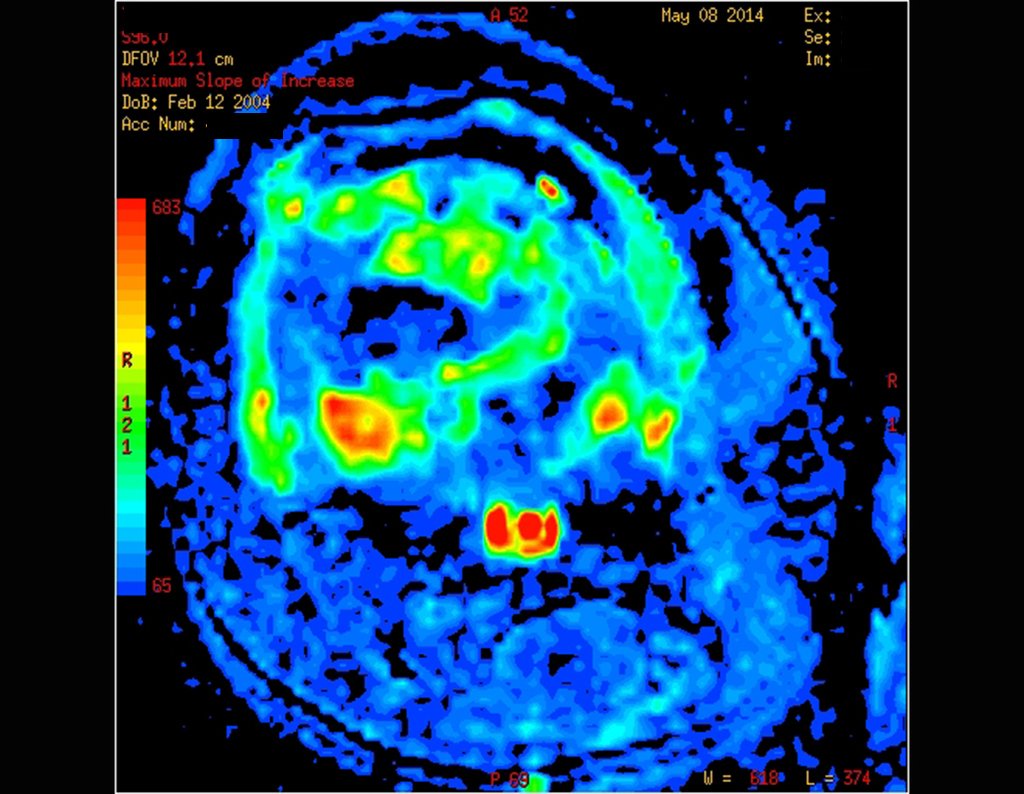
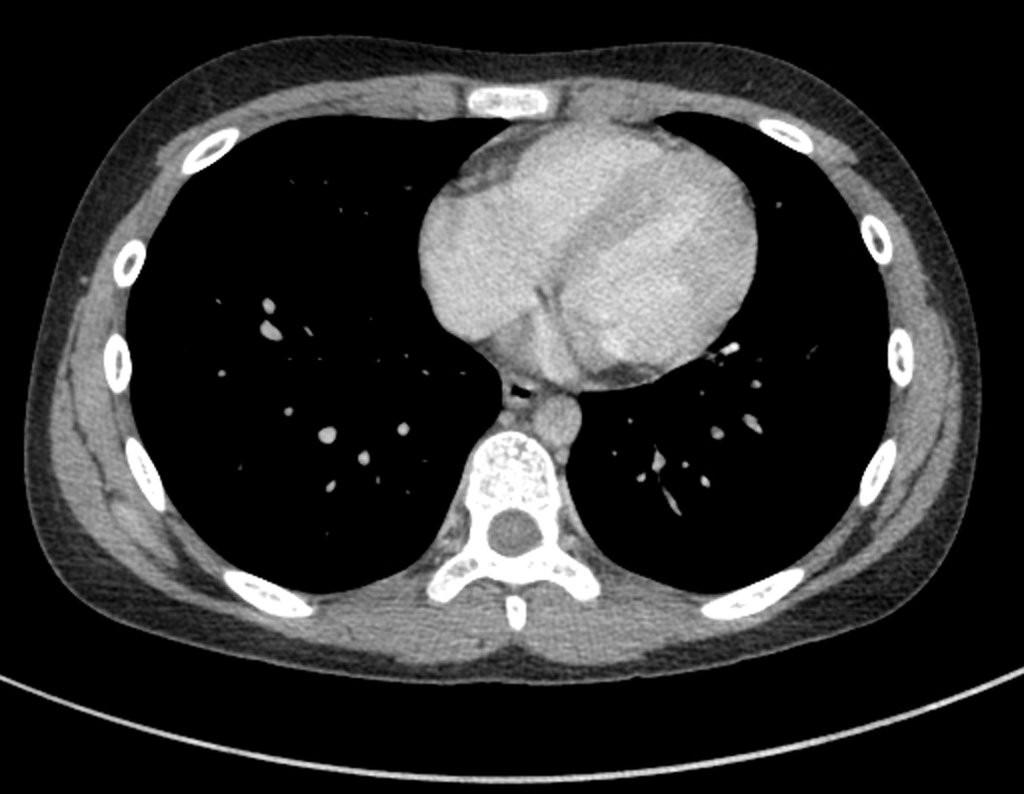
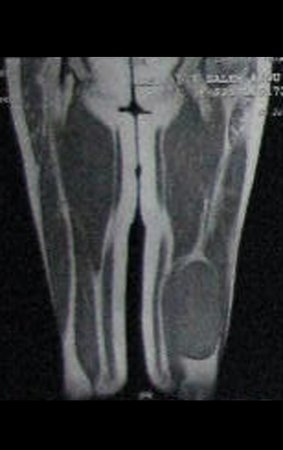
Paciente A : figuras 3 y 4.
Hace treinta días solicitaron una biopsia de una lesión de la pared abdominal a un paciente ingresado para investigación.
El médico del paciente me encontró en la sala de radiología, analizando la tomografía computarizada.
Siguiendo el “cómo pienso” sobre las lesiones me pregunté: – ¿qué estructuras forman la pared abdominal? El. piel (carcinoma de células escamosas, carcinoma de células basales, melanoma) ; B. subcutáneo (lipoma, liposarcoma) ; w. fascia muscular (fibroma desmoide) ; d. músculo estriado (fibroma, fibrosarcoma, fibroma desmoide, rabdomiosarcoma) ; Es. vaso (hemangioma, leiomiosarcoma) ; F. peritoneo y cavidad abdominal (ya no es mi jurisdicción).
Parecía una lesión extensa y le sugerí buscar un cirujano de la zona, ya que no sabría conducir si fuera una neoplasia maligna. Lo ideal es que la biopsia la realice la persona que operará al paciente.
Me dijo que la paciente estaba ictérica, que le habían realizado una ecografía y varios exámenes de laboratorio, insistiendo en que le hiciera una biopsia. Le pedí algunos datos y como no sabía cómo averiguarlo, le sugerí que visitáramos la cama. Podríamos extraer la historia clínica y examinar al paciente.
El paciente refirió ser asmático y refirió que el síntoma comenzó abruptamente luego de un ataque de tos hace once días, en un cambio brusco de clima, frío y llovizna. Tenía fuertes dolores en la pared anterior del abdomen, donde apareció una “bola”. El abultamiento y el dolor iban disminuyendo y la pared lateral se había endurecido.
Al salir de la habitación le sugerí que no le hiciéramos biopsia, que le diéramos el alta al paciente, que la ictericia con bilirrubina elevada era consecuencia de un gran hematoma que se había infiltrado en la pared lateral, por la rotura espontánea del recto anterior del abdomen. Esta lesión ya estaba en reparación y la biopsia sólo mostraría el proceso inflamatorio cicatricial (con riesgo de miositis proliferativa).
Aún no convencido, me preguntó si alguna vez había visto un caso de rotura espontánea del músculo recto abdominal. Respondí que no, pero eso era lo que decía el sentido común. Bajando las escaleras nos encontramos con un cirujano general y le pregunté sobre el asunto. Esto aclaró que era común en pacientes con bronquitis crónica que tomaban corticoides, como fue el caso de nuestro paciente. La historia clínica hizo el diagnóstico.
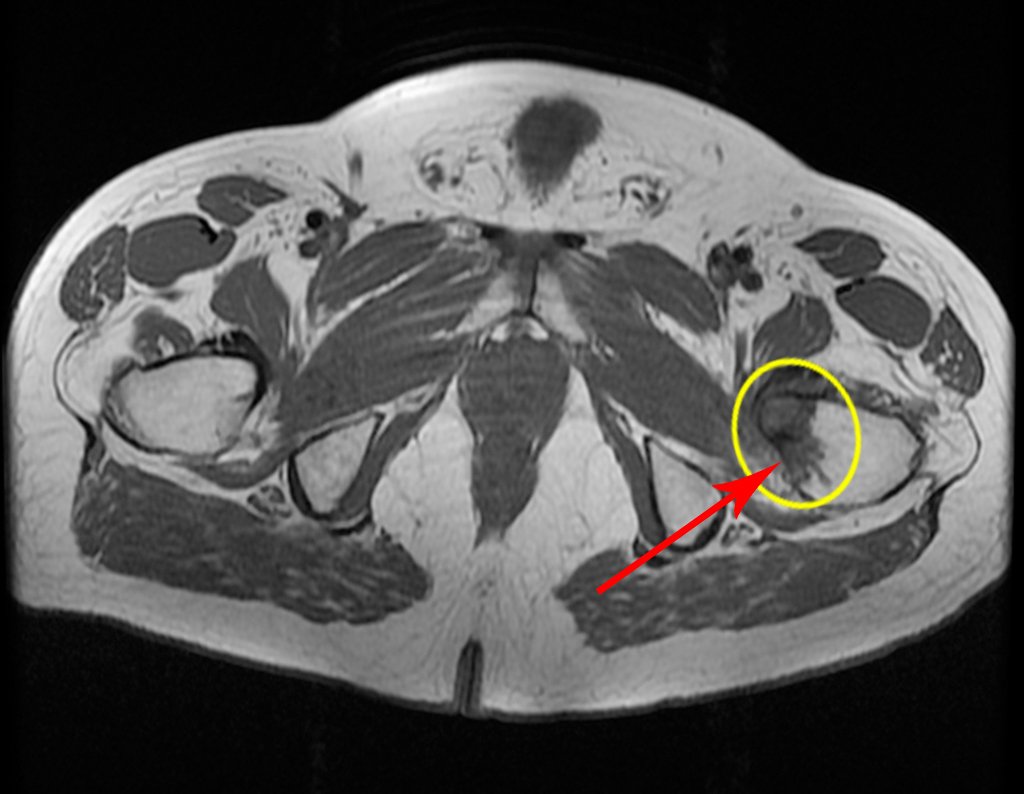
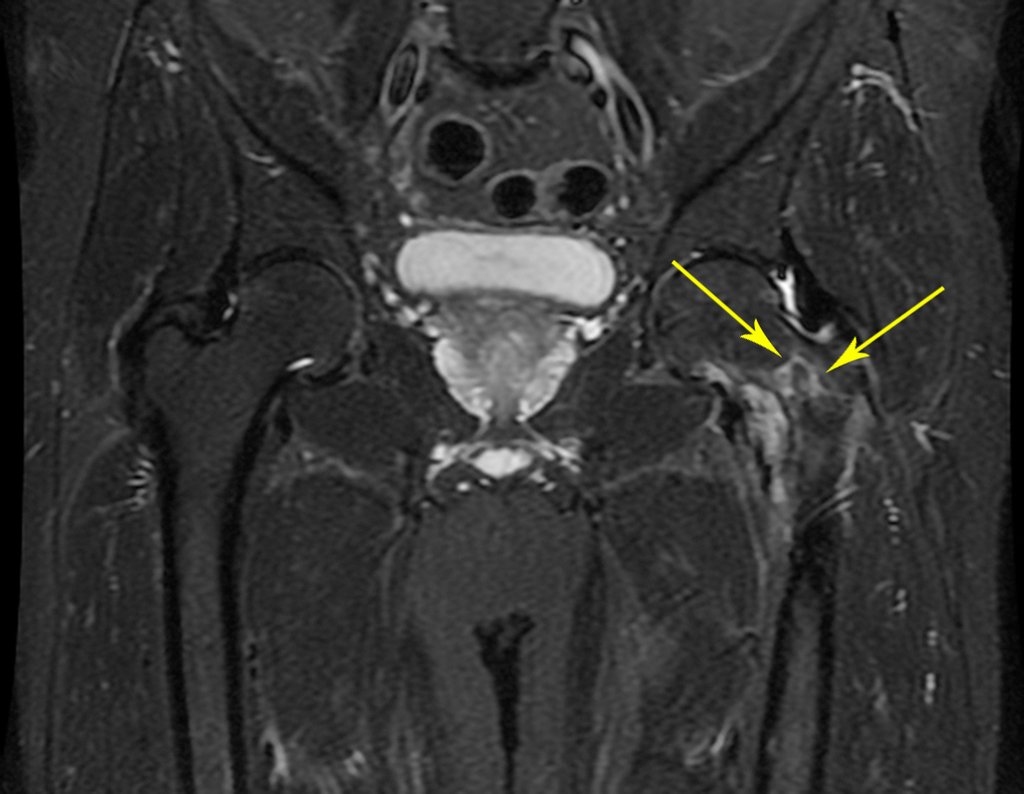
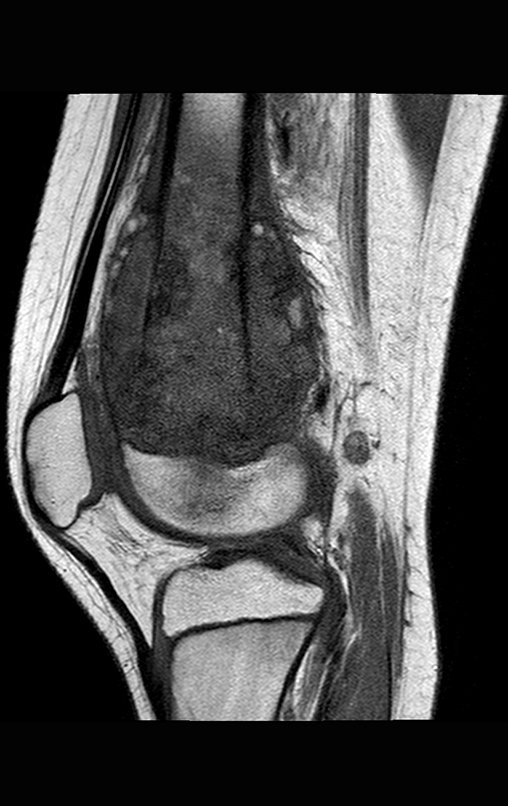
Pacientes B : Figura 5.
En el ambulatorio el residente pregunta:
– “¿Por qué vía de acceso debemos realizar la biopsia?”
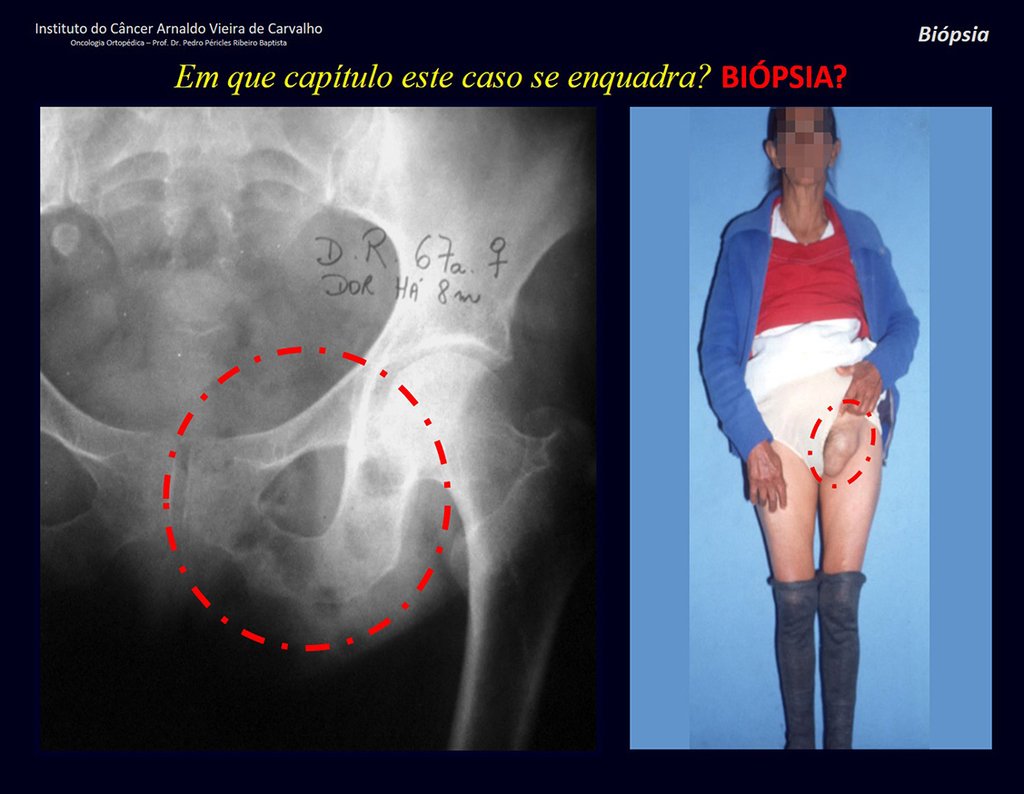
Veo la imagen y pregunto: – ¿Cuántos años tiene el paciente?
– “Um… Doña María, ¿cuántos años tiene?”
Reflexiono en silencio, evaluando la falta de conocimiento del alumno. El paciente responde ¡67 años DOCTOR!
… ¿Sesenta y siete años, múltiples lesiones, metástasis? ¿Mieloma múltiple? ¿Tumor marrón del hiperparatiroidismo? – ¿Hace cuánto que tiene síntomas?
– “Um… Doña María, ¿hace cuánto que tiene este problema?”
En la historia clínica veo anotados síntomas de dolor en la tuberosidad isquiática , mediciones de Ca ++ , P ++ , FA, Na + , K + , electroforesis de proteínas, hemograma, VSG, glucemia, urea, creatinina, ecografía, rayos X,…, …
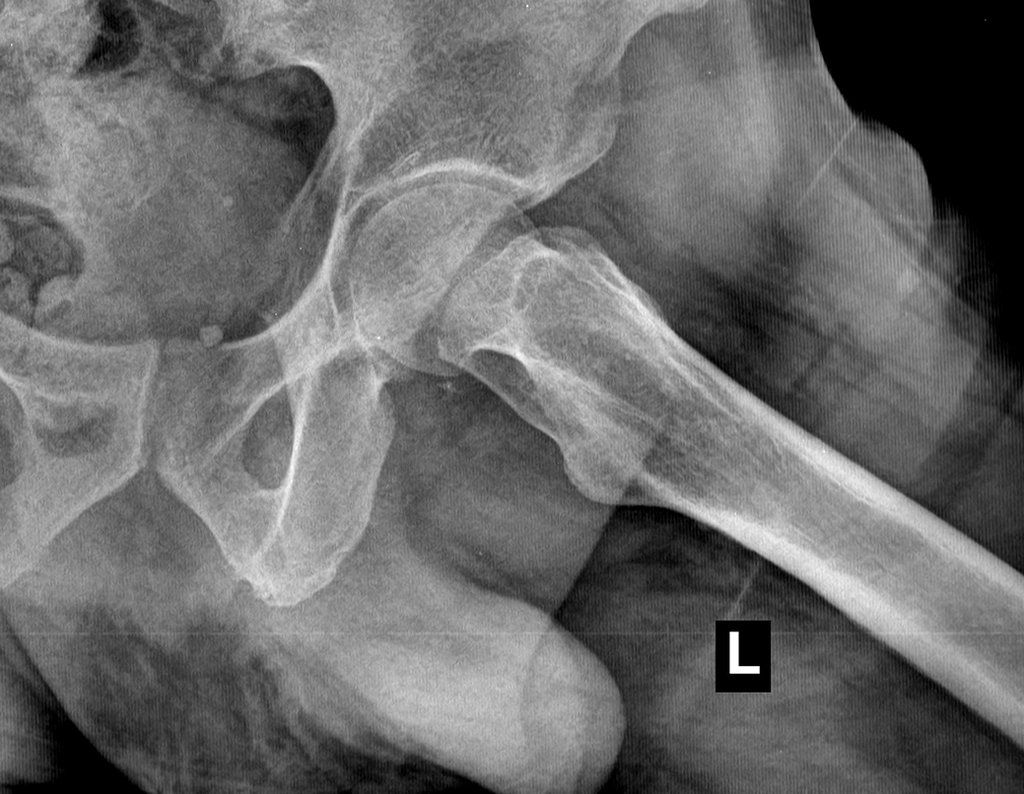
Al examinar al paciente observé que el “tumor” es anterior , en la región inguinal, y no posterior , como consta en la historia clínica, “tuberosidad isquiática”. ¡¡¡El paciente no había sido examinado !!! Tenía una hernia inguinal-crural. Las imágenes de rayos X de la pelvis representan gas del intestino. La “biopsia” resultaría en una perforación intestinal. El examen físico hizo el diagnóstico.
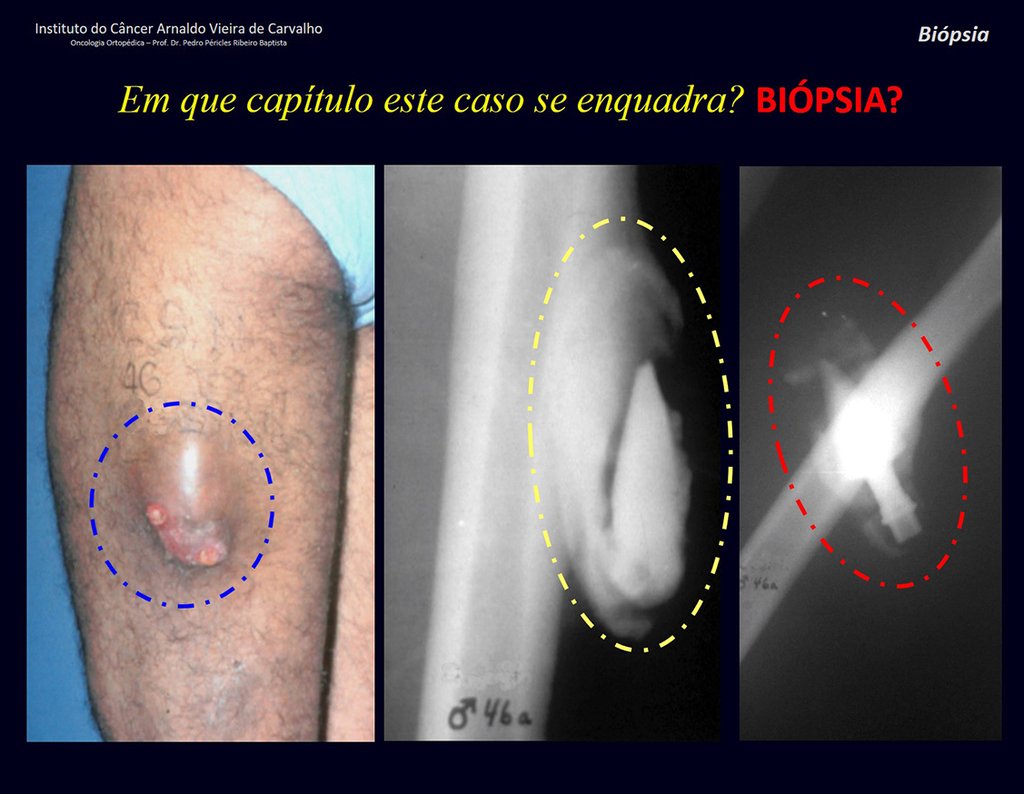
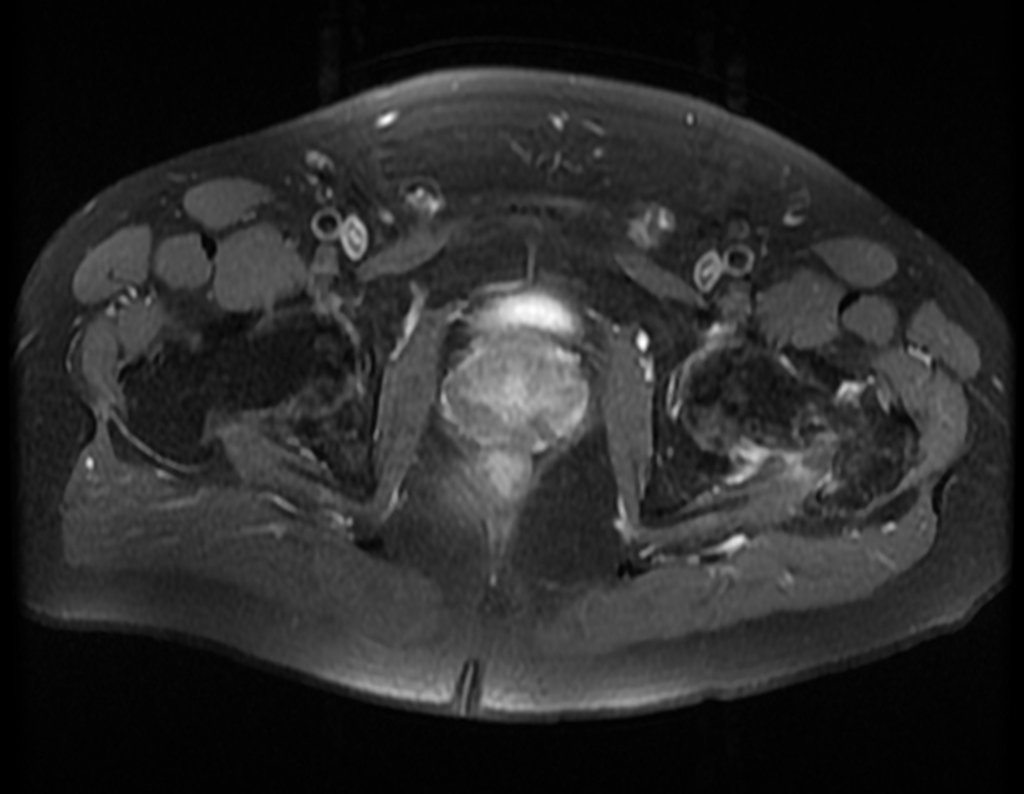
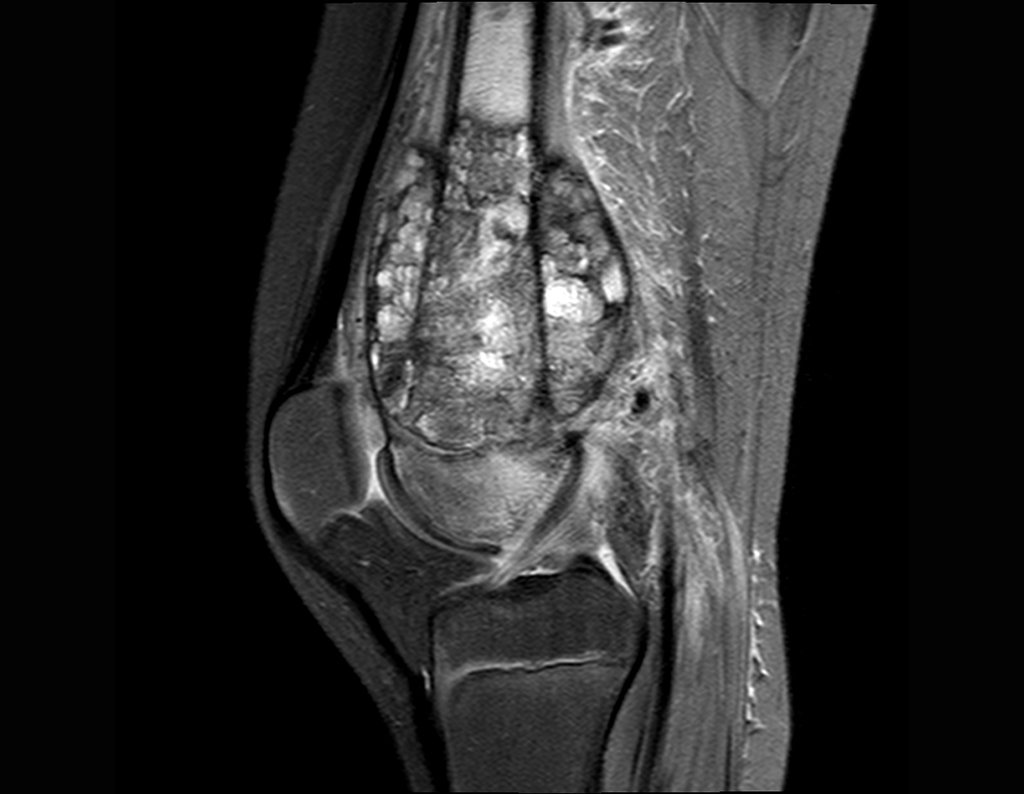
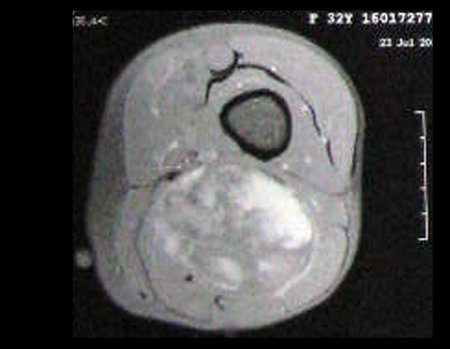
Paciente C : Figura 6.
Al pasar por urgencias, la persona de guardia pregunta:
– “Doctor, ¿qué tumor cree que tiene este paciente? ¿Podemos programar la biopsia?
¡¡¡El residente no sabía nada de la historia y sólo le había tomado la radiografía frontal!!! Cuando se le pregunta, el paciente refiere que los síntomas inflamatorios comenzaron hace seis meses, con dolor caliente y liberación de secreción purulenta. Cuando estuvo abierto, secretando, los síntomas mejoraron. Cuando la fístula se cerró, empezó a hincharse, a dolerme y tuve fiebre.
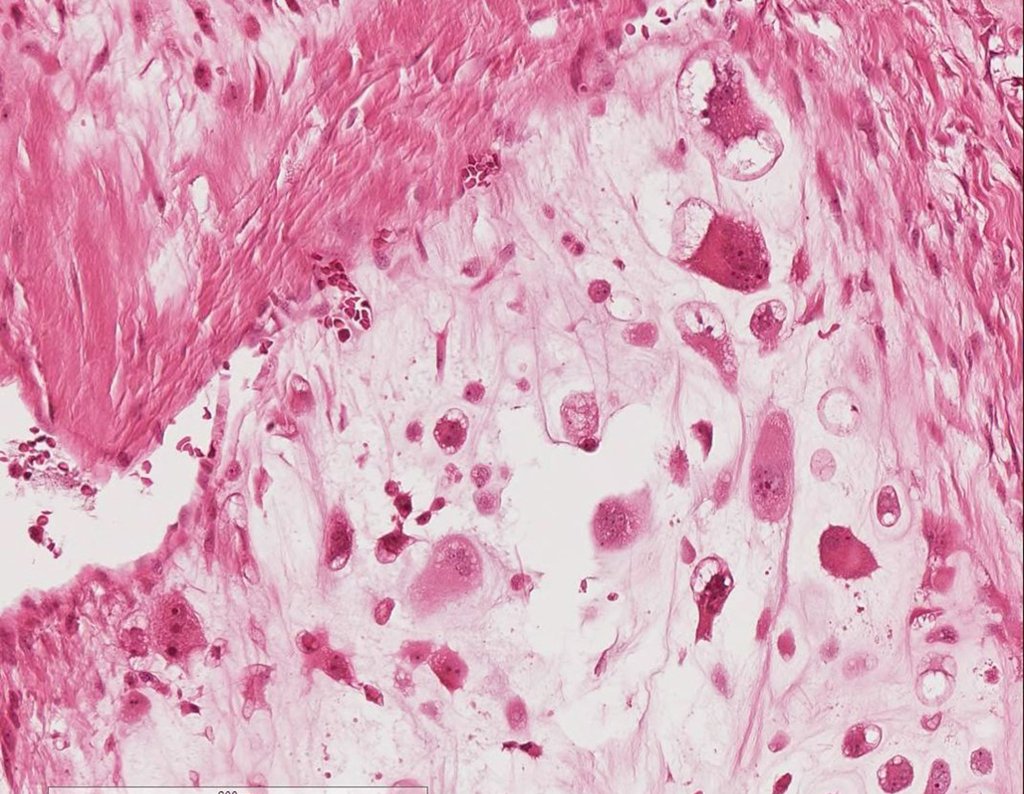
Con dificultad, como el paciente muchas veces oculta información, supimos que había sido herido en el muslo hace dos años, al saltar la barandilla de una casa, que sangró mucho, pero no buscó tratamiento ( historia clínica ) . Solicitamos una radiografía lateral que confirmó que se trataba de un cuerpo extraño. La punta de la lanza de la rejilla estaba rodeada por una reacción perióstica sólida, dando la falsa impresión de un tumor esclerótico. Las imágenes adecuadas confirmaron el diagnóstico.
NOSOTROS NECESITAMOS:
1- Definir las hipótesis de posibles diagnósticos, para nuestro caso, en primer lugar con la historia clínica y el examen físico ;
2- Realizar pruebas de laboratorio y de imagen, para corroborar o no nuestras hipótesis, nuestros razonamientos y
3- Sólo después de estos pasos podremos realizar la biopsia, para que la patología “ reconozca la firma ” del diagnóstico, previamente pensado con nuestra anamnesis, examen físico, de laboratorio y de imagen.
“La anatomía patológica no es un camino corto hacia el diagnóstico. Siempre debemos correlacionarlo con la clínica, el laboratorio y las pruebas de imagen”.
Respecto a la biopsia, podemos subdividir las lesiones musculoesqueléticas en tres grupos:
- Casos en los que el diagnóstico CLÍNICO – RADIOLÓGICO (imagen) es suficiente para el diagnóstico y tratamiento, y no está indicada la biopsia.
- En los casos que no requieran este procedimiento por dificultad en el diagnóstico histológico, y por las características de agresividad clínica y radiológica , no se debe alterar el procedimiento quirúrgico necesario.
- Casos que requieren confirmación patológica para tratamiento de quimioterapia previo a la cirugía
Discutiremos los tres grupos, analizando algunos ejemplos, figuras a continuación.
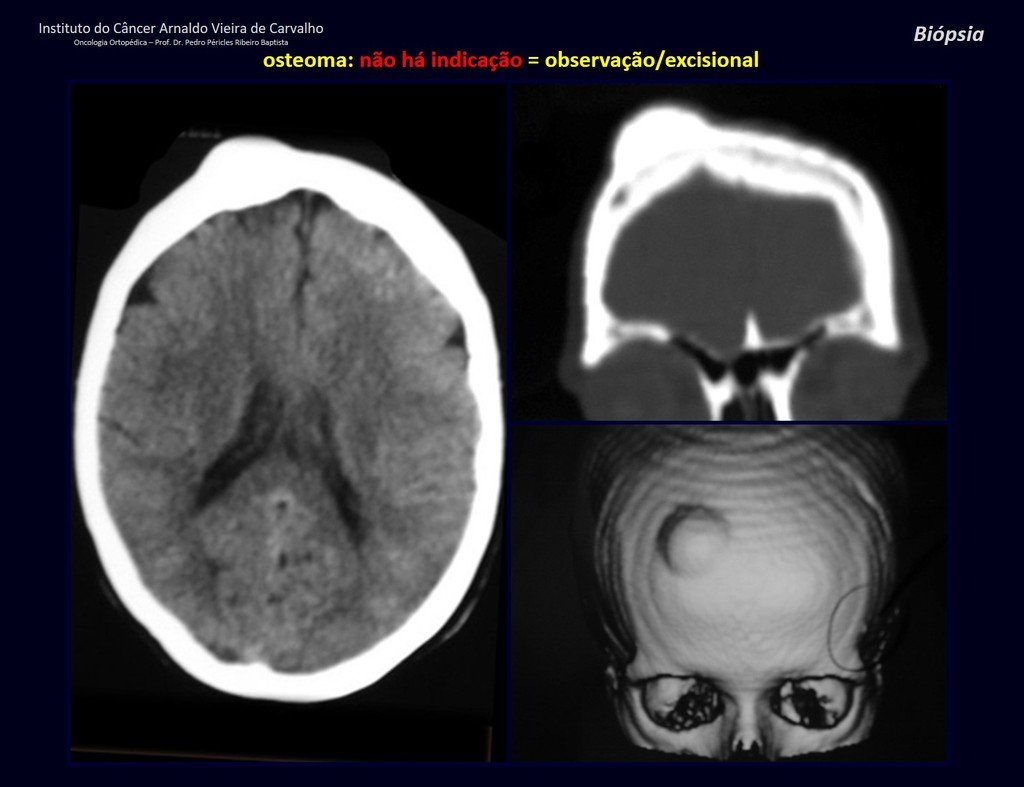
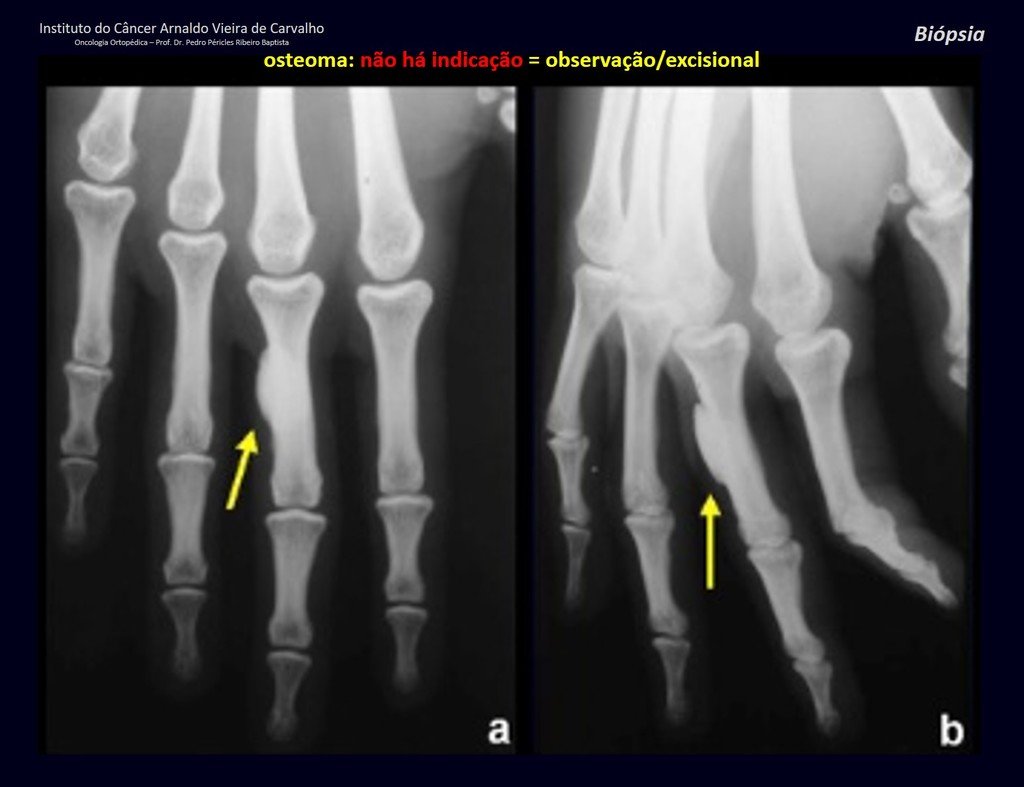
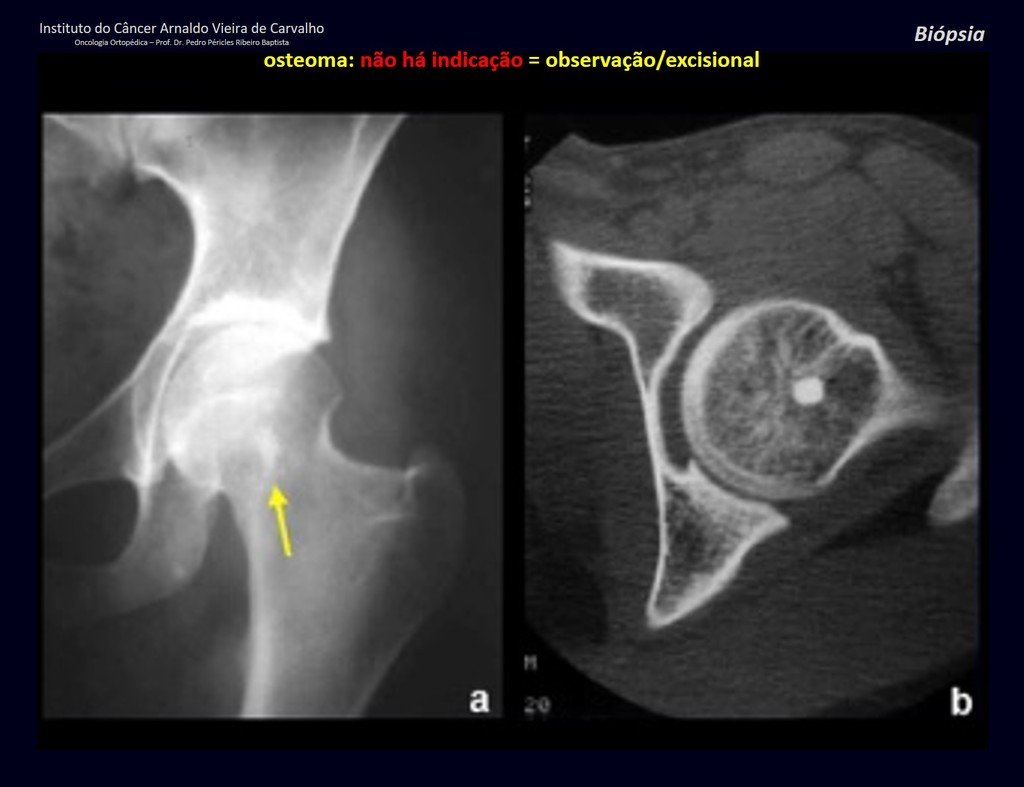
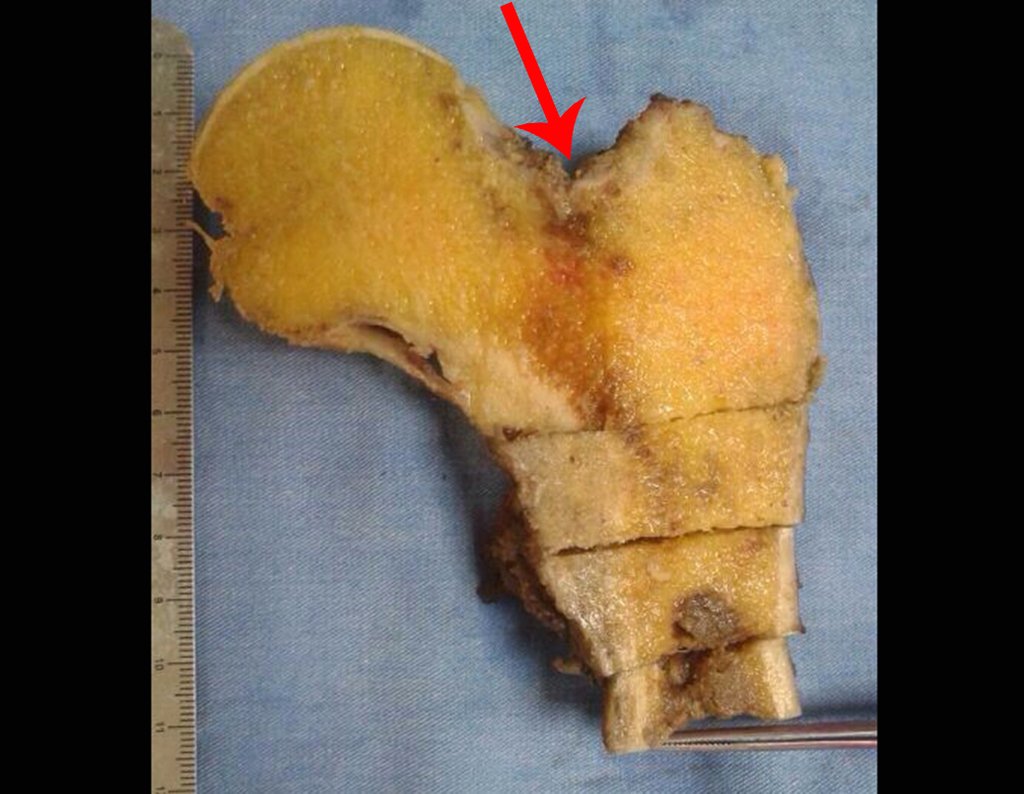
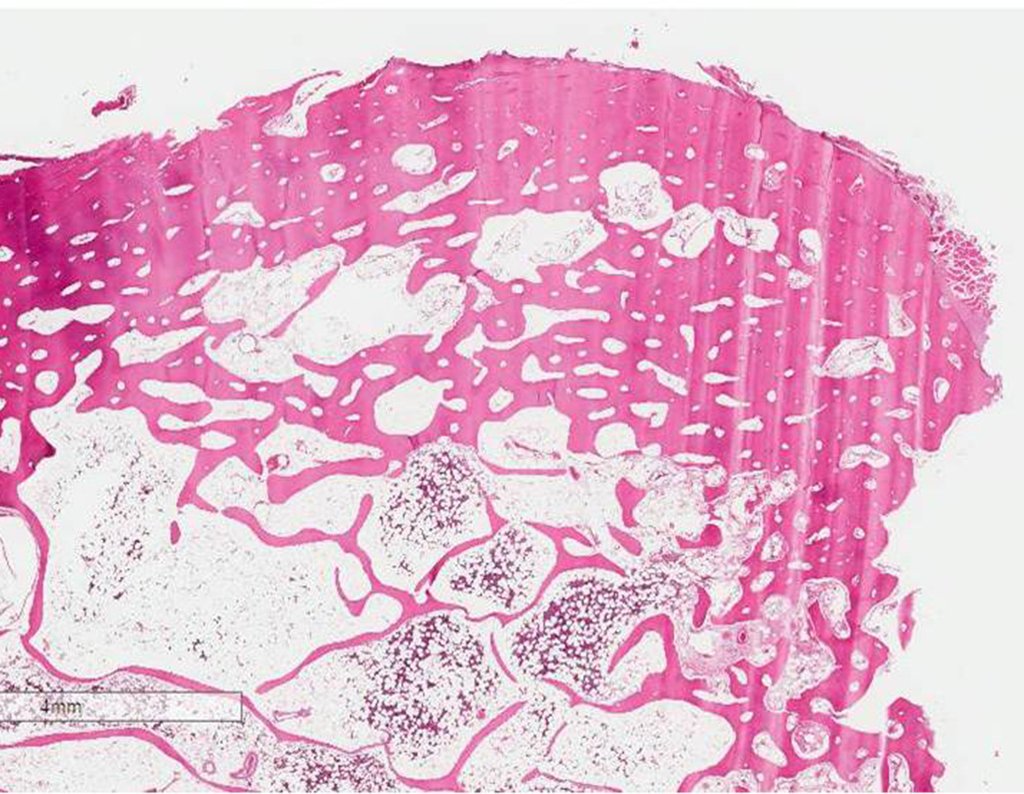
1a . OSTEOMA, figuras 13 a 18.
IDENTIDAD: Lesión neoplásica benigna, bien definida, caracterizada por una tumoración homogénea, esclerótica y densa, de tejido óseo maduro. Es hueso dentro de un hueso.
Estas lesiones son bien definidas, homogéneas y asintomáticas. Se diagnostican por hallazgos imagenológicos ocasionales o por presentar cambios estéticos. En ocasiones, pueden ser sintomáticos, como en el caso de que la cavidad nasal estuviera obstruida, dificultando la respiración. El diagnóstico es clínico y radiológico, y no requiere biopsia. El tratamiento se limita a la observación y el seguimiento. Son raros y ocasionalmente operados.
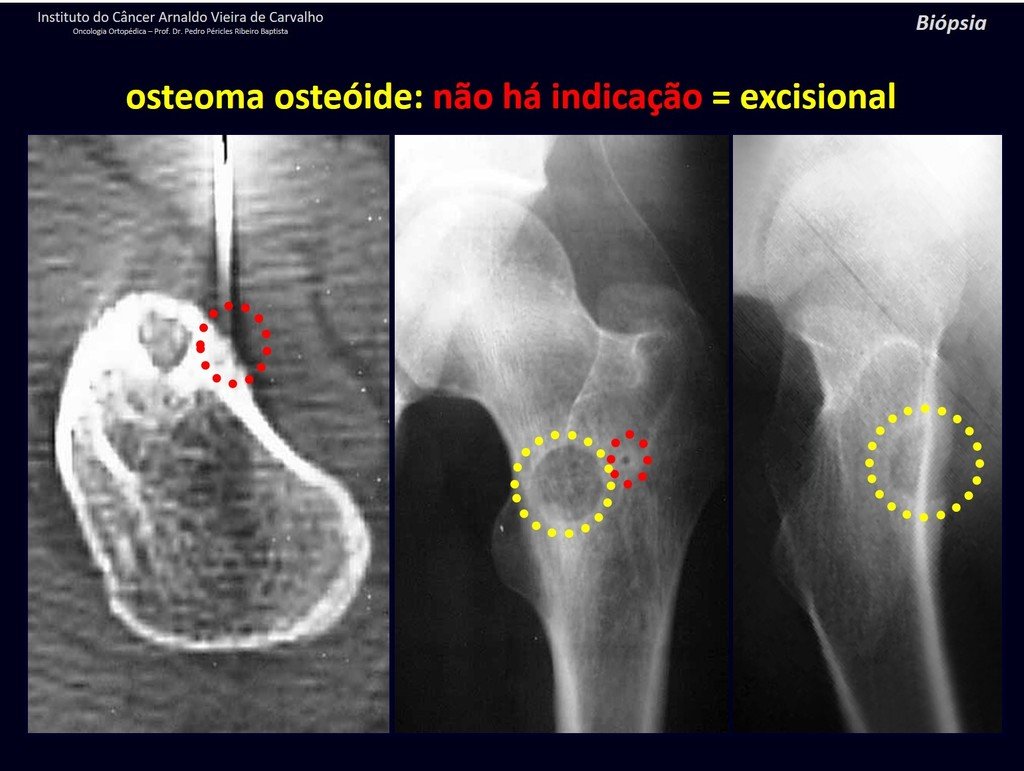
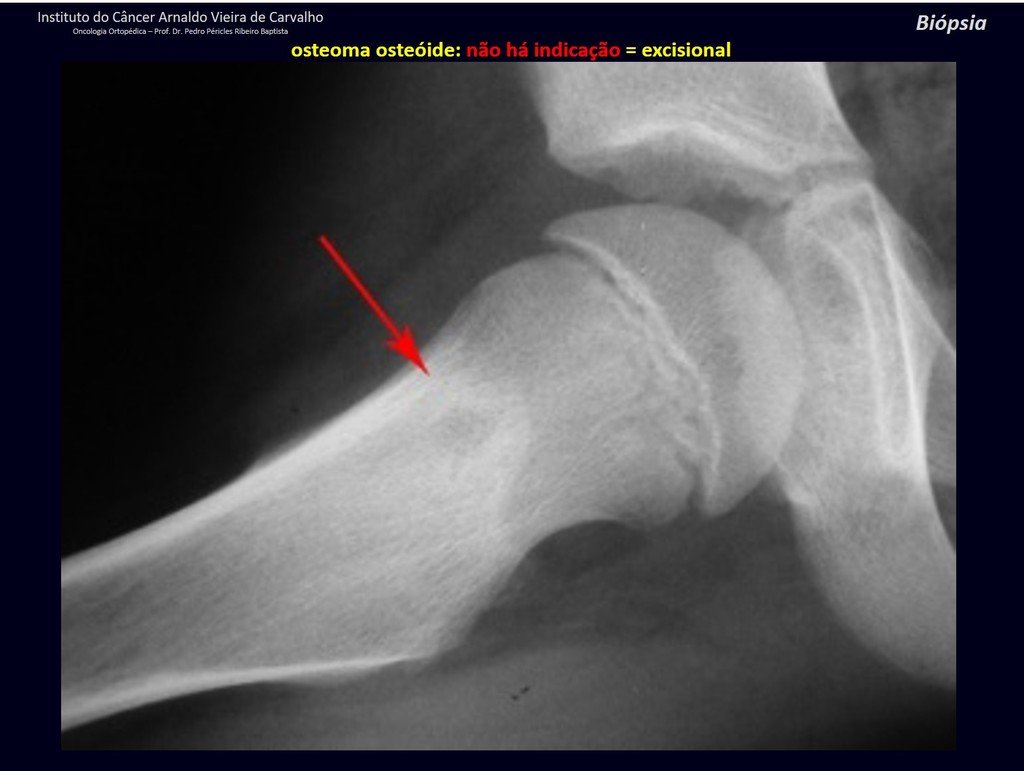
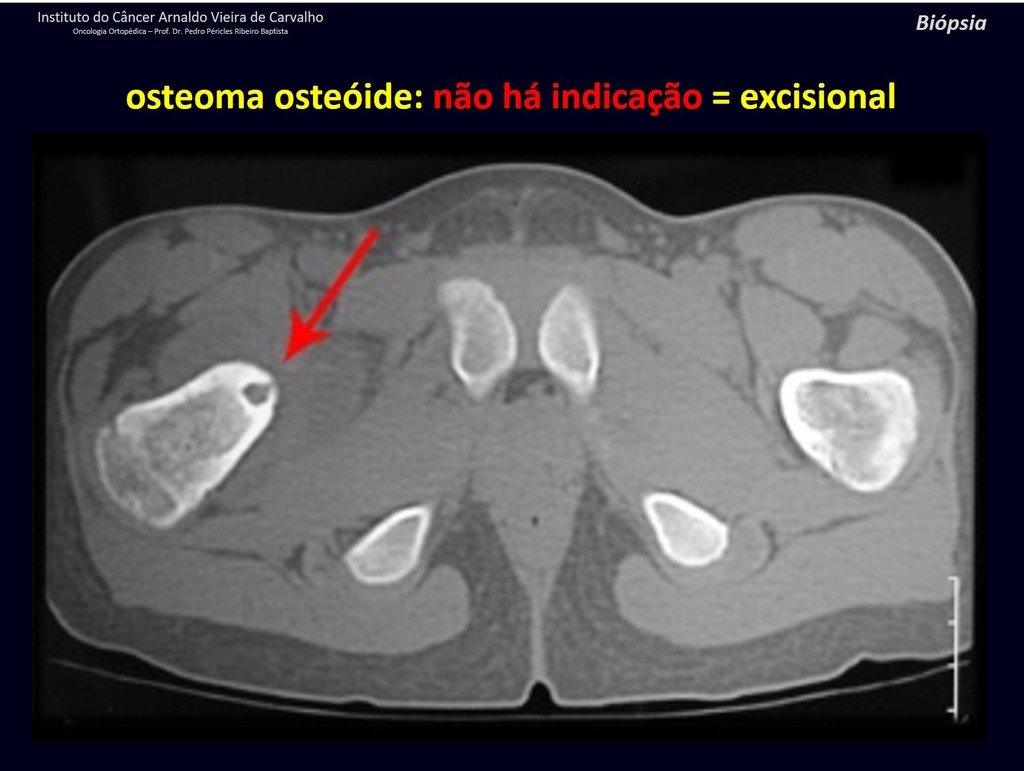
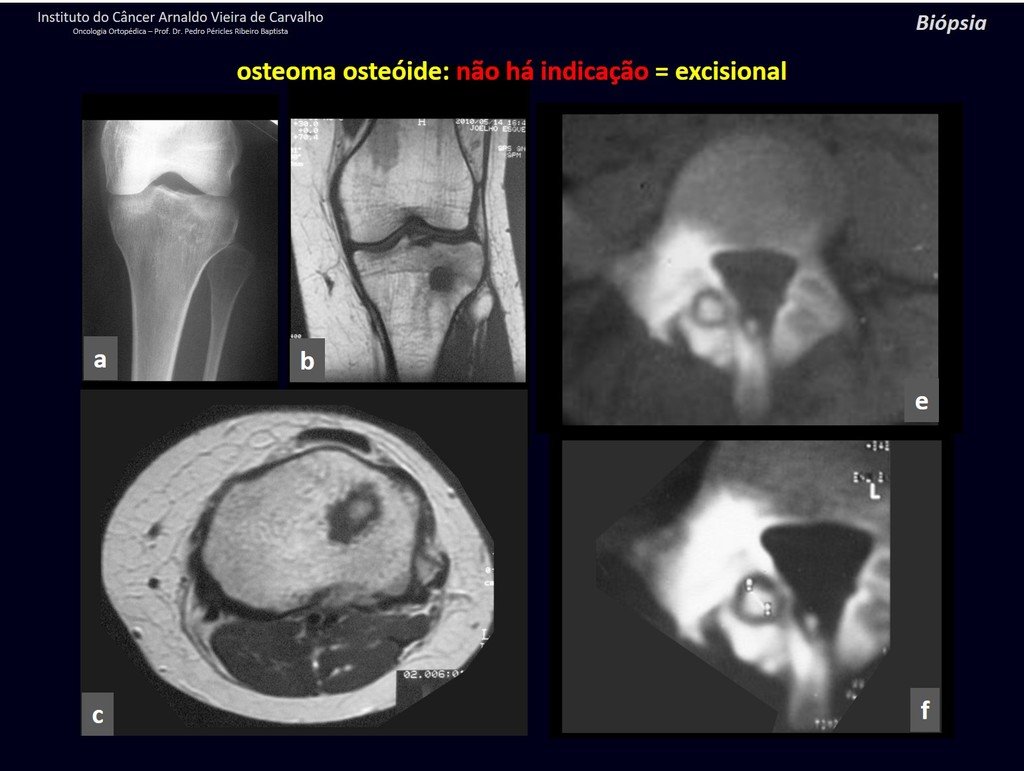
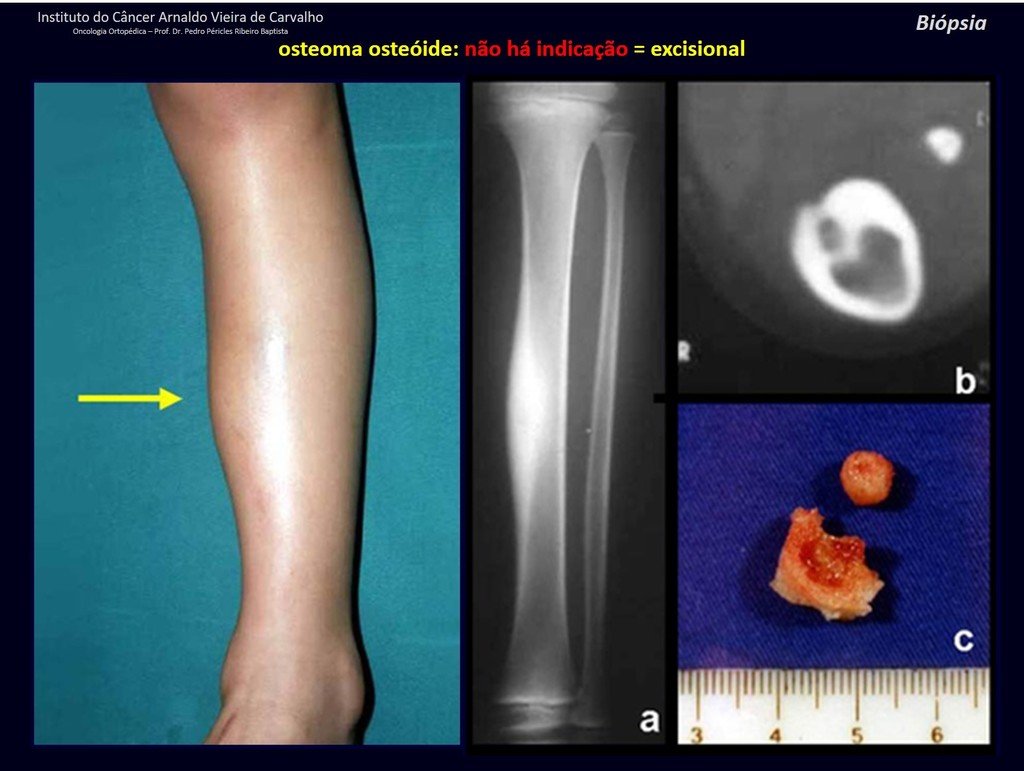
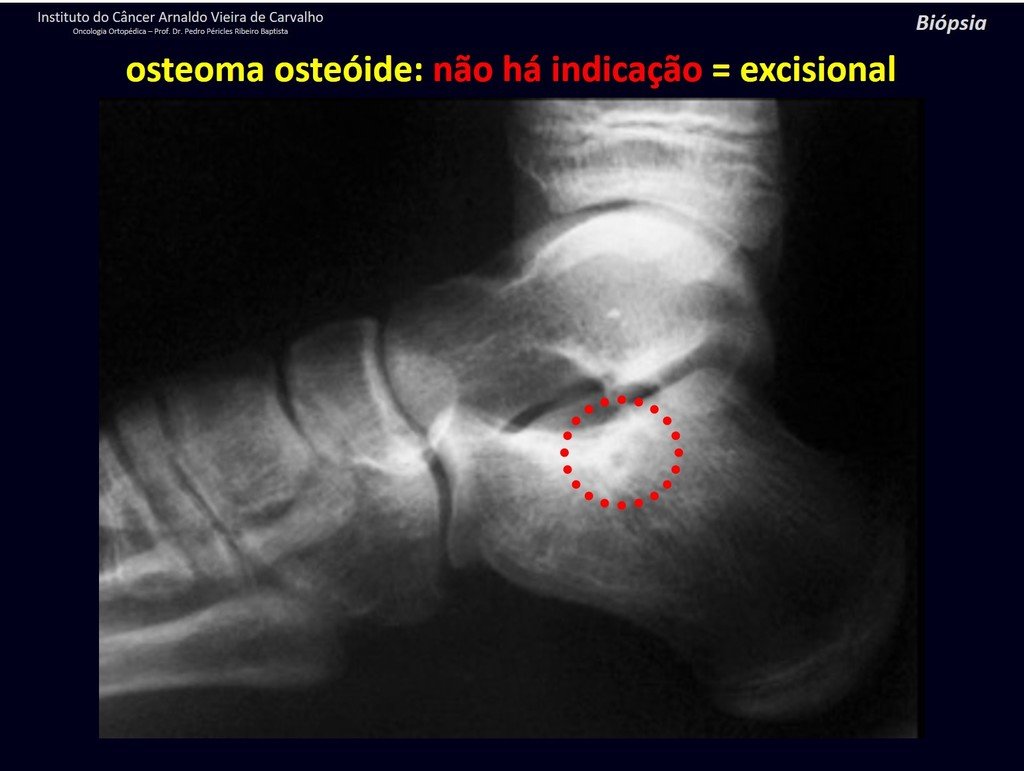
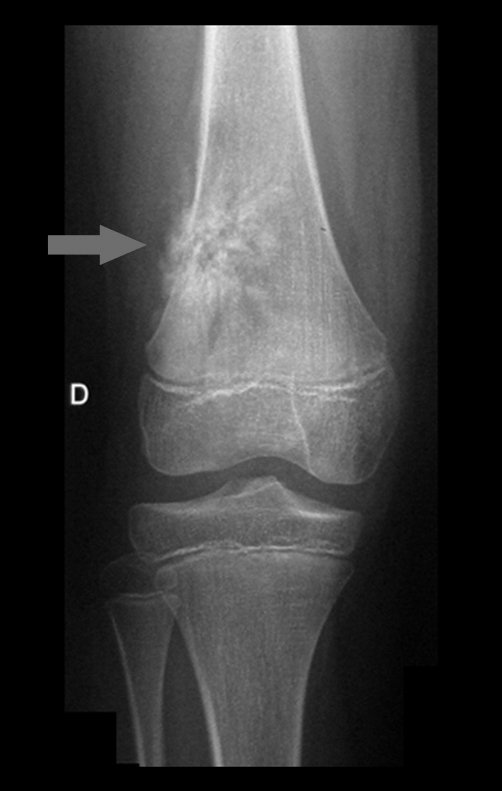
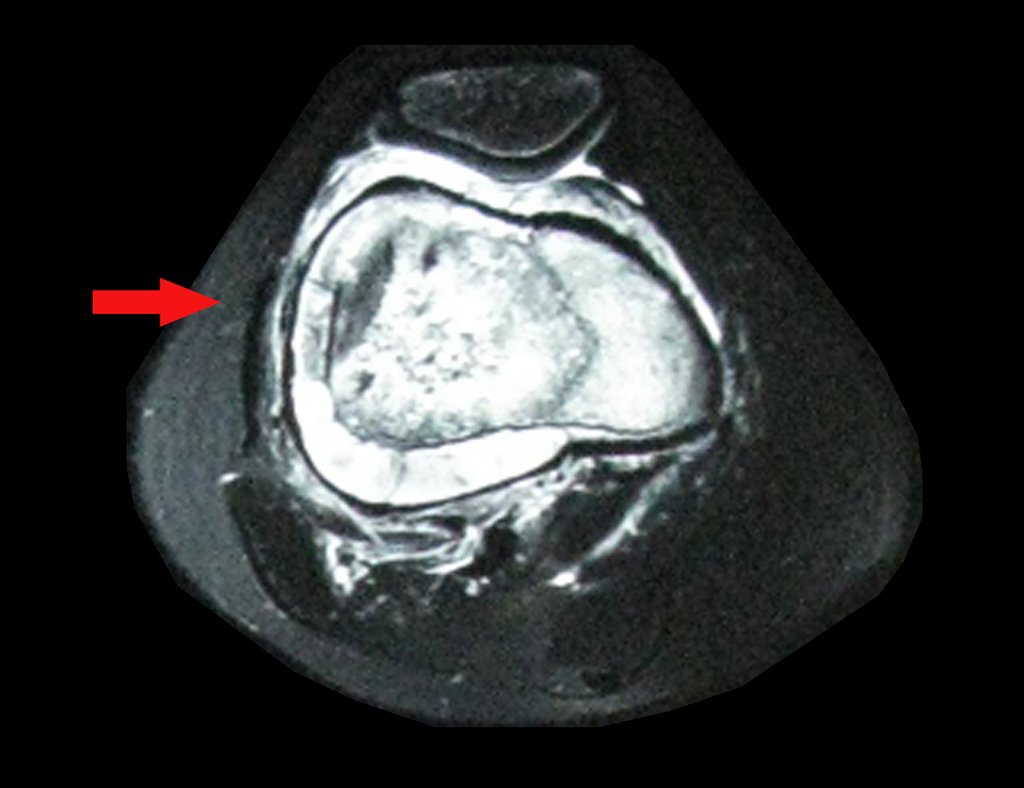
1b . OSTEOMA OSTEOIDE, figuras 19 a 26.
IDENTIDAD: Lesión neoplásica benigna, caracterizada por un tumor circunscrito, de hasta aproximadamente un centímetro de diámetro, que presenta un nicho osteoide central, rodeado por un halo de esclerosis y ubicado en la corteza de los huesos largos, la parte más compacta.
La región del cuello femoral está cubierta por un delgado periostio que no presenta reacción perióstica. Esto dificulta la localización de la lesión durante la cirugía.
Realizar un agujero en el hueso cortical, cerca de la lesión, guiado por radioscopia, facilitará la operación.
Tras este marcaje, realizamos una tomografía para medir la distancia desde el agujero hasta el centro de la lesión, localizándola. Ver la técnica completa en: http://técnica de resección del osteoma osteoide
El osteoma osteoide es una lesión del hueso cortical. En la columna se produce en el pedículo, que es la parte más compacta y dura, asemejándose a la corteza.
Tiene una hornacina central con un halo de esclerosis a su alrededor y no supera el centímetro.
No existe un “osteoma osteoide gigante”, mayor de 1,5 cm, ya que en esta situación hay erosión cortical, no hay delimitación por el halo de esclerosis y, aunque puede presentar una histología similar, estamos ante un osteoblastoma. , que es una lesión benigna, pero localmente agresiva. El osteoblastoma puede estar asociado o no con un quiste óseo aneurismático y también puede requerir un diagnóstico diferencial con el osteosarcoma teleangiectásico. Lea también: http://osteoma osteoide
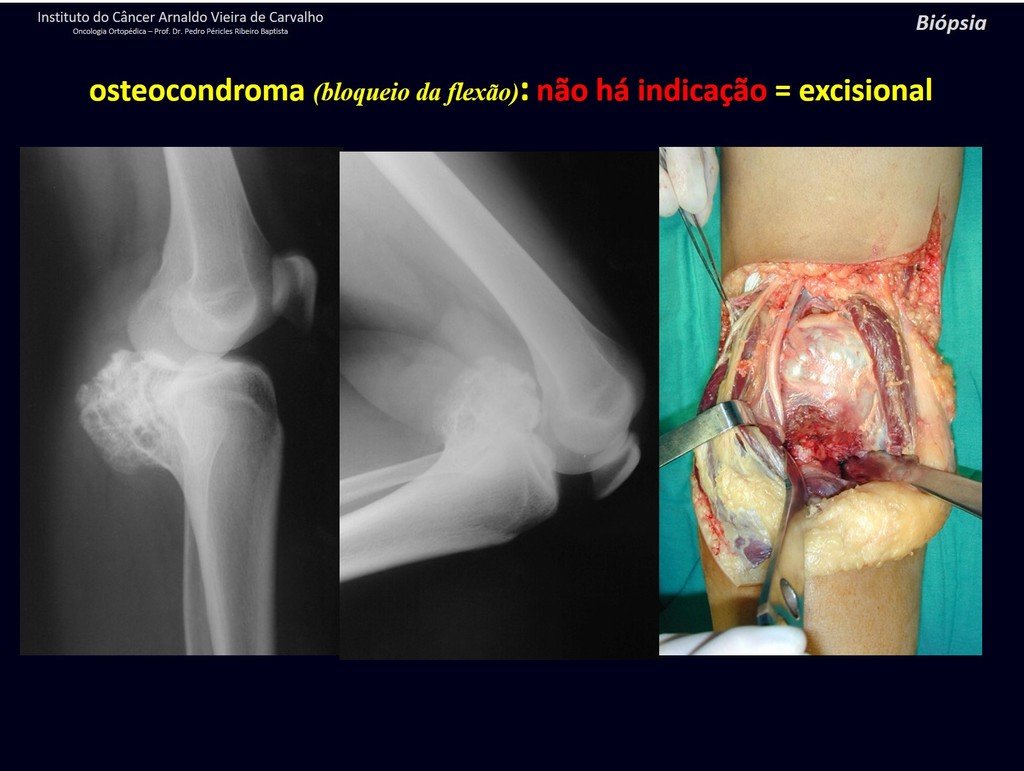
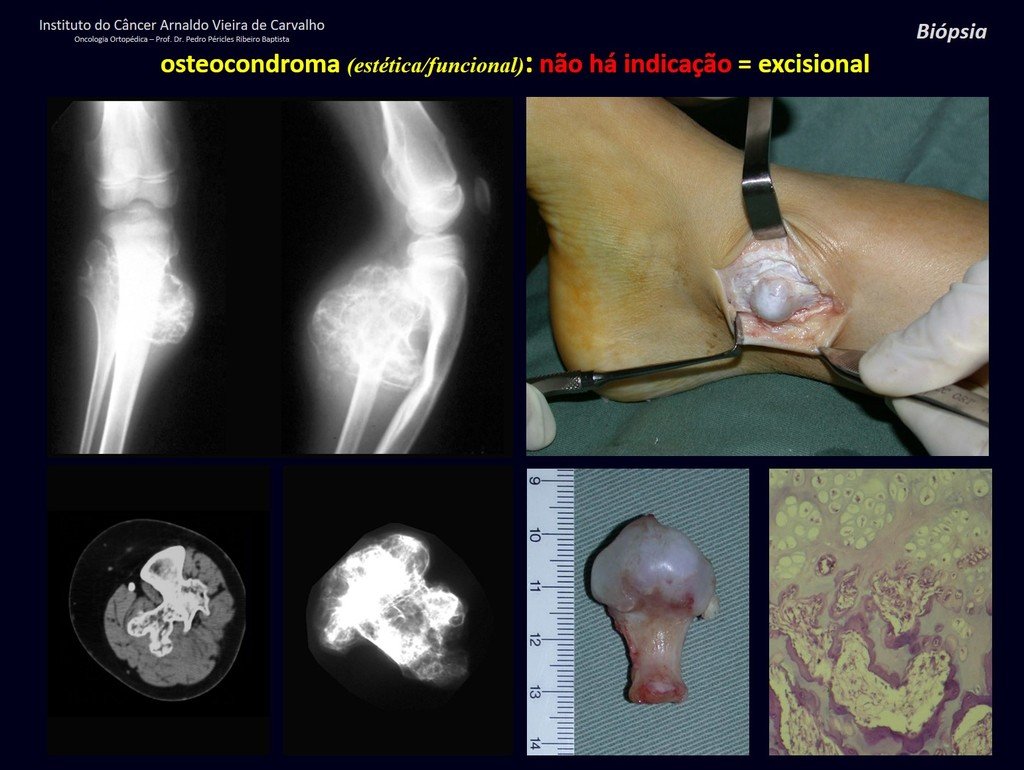
1c . OSTEOCONDROMA, figuras 27 a 32.
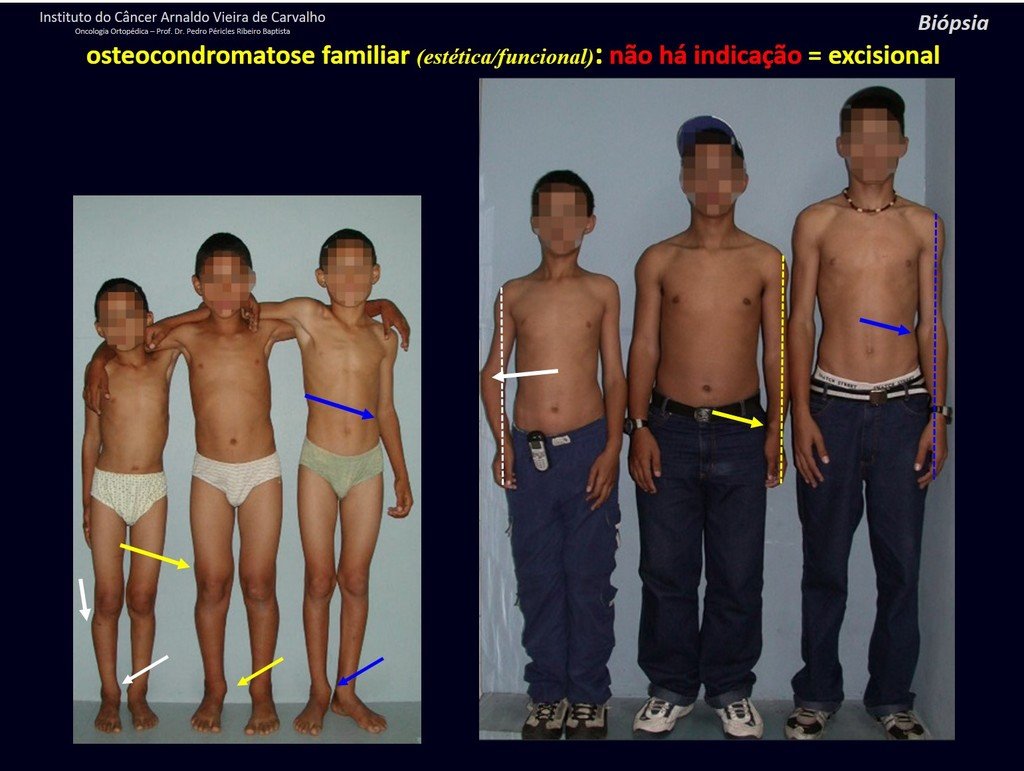
IDENTIDAD: Es una exostosis en la que el hueso esponjoso central continúa con la medular del hueso afectado y la capa cortical periférica densa del tumor continúa con la capa cortical del hueso afectado. Se presenta con una base pediculada agrandada, sésil o estrecha . Puede ser única o múltiple (osteocondromatosis hereditaria).
Los osteocondromas requieren tratamiento quirúrgico cuando alteran la estética o la función, desplazando y comprimiendo estructuras vasculares-nerviosas, limitando el movimiento o generando deformidades angulares. Es la lesión ósea benigna más común.
Generalmente crecen mientras el paciente se encuentra en la fase de crecimiento. Cuando un osteocondroma aumenta de tamaño después de completar la madurez esquelética, puede significar bursitis postraumática o malignidad a condrosarcoma y debe tratarse como tal, resecando con margen oncológico.
El osteocondroma solitario tiene una tasa de malignidad del 1%. La osteocondromatosis múltiple puede alcanzar el 10%.
El diagnóstico del osteocondroma es clínico y radiológico y no requiere biopsia para su tratamiento.
Leer: http://osteocondroma
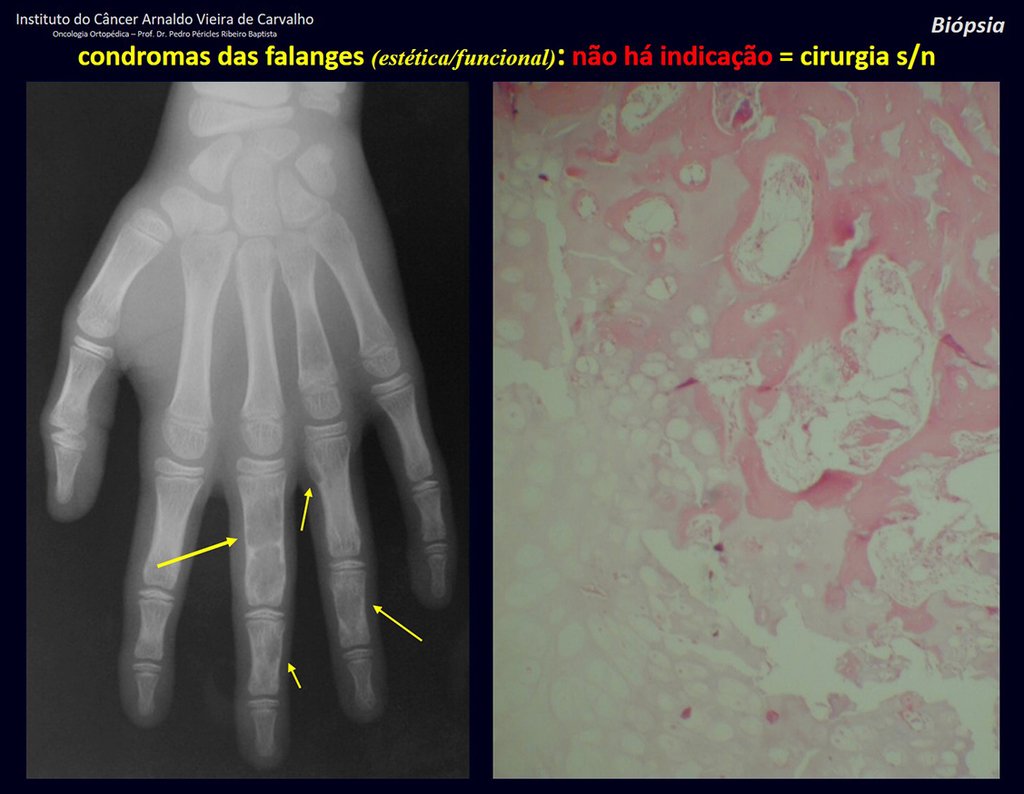
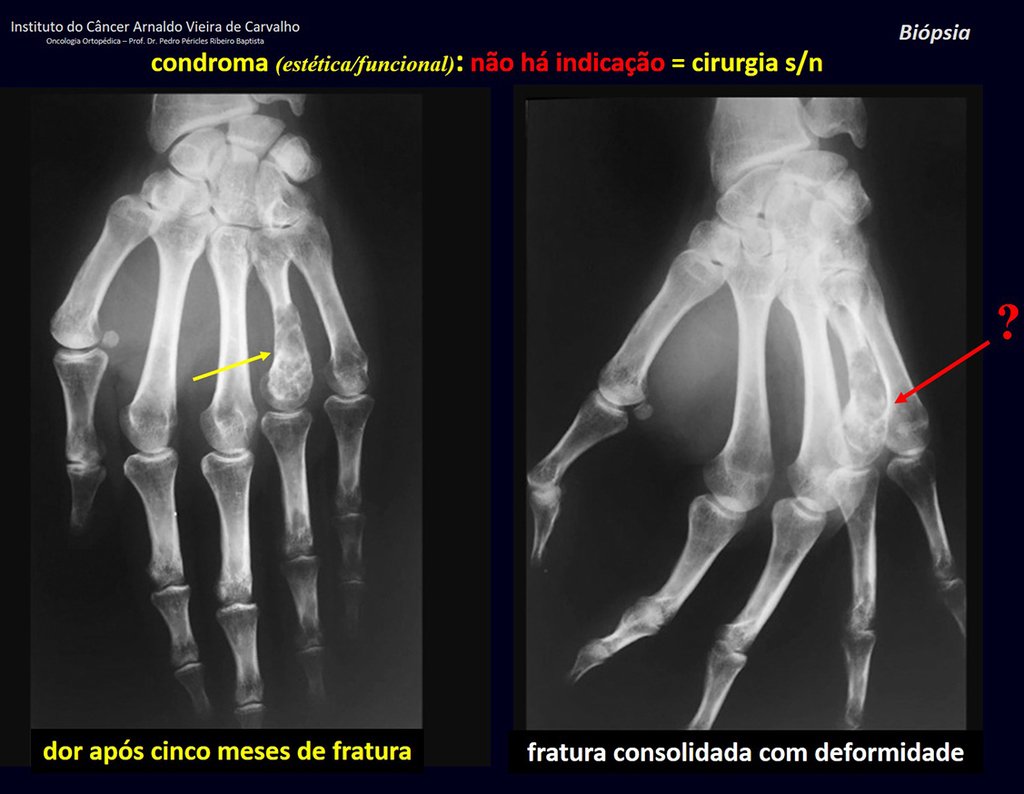
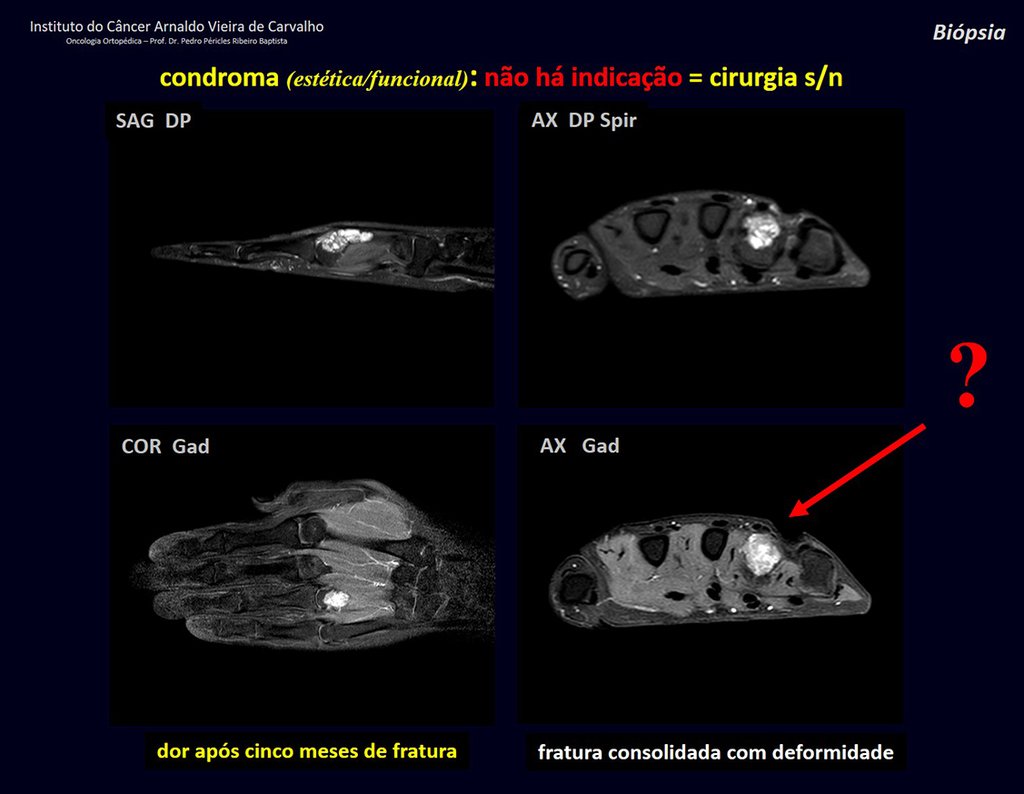
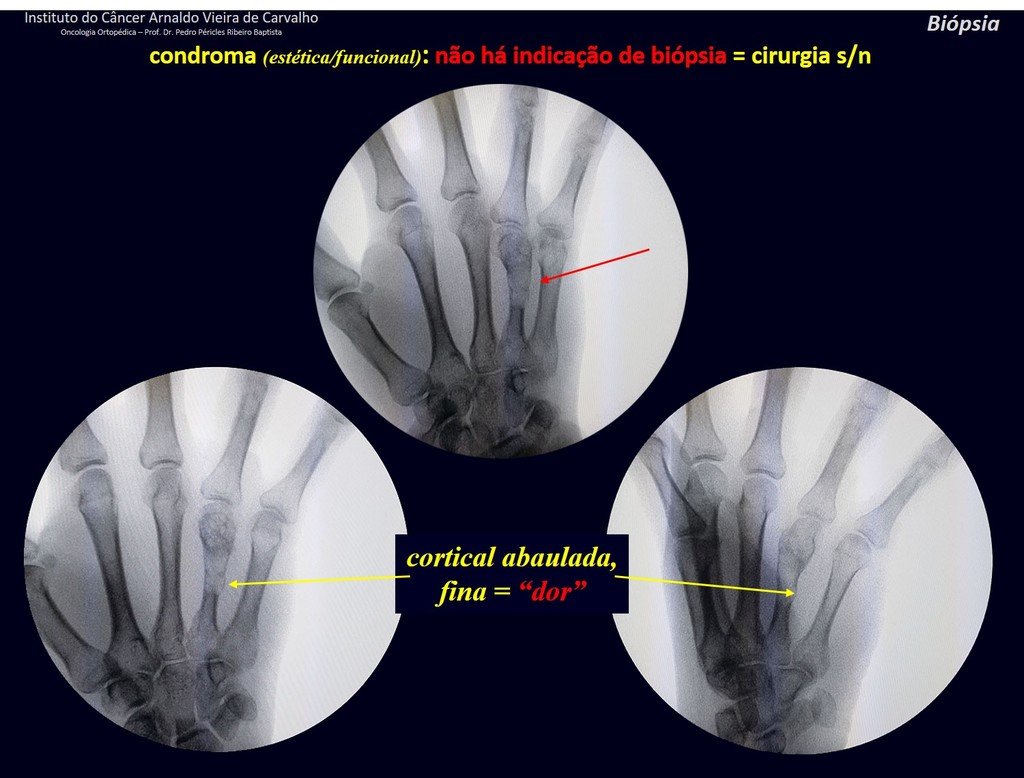
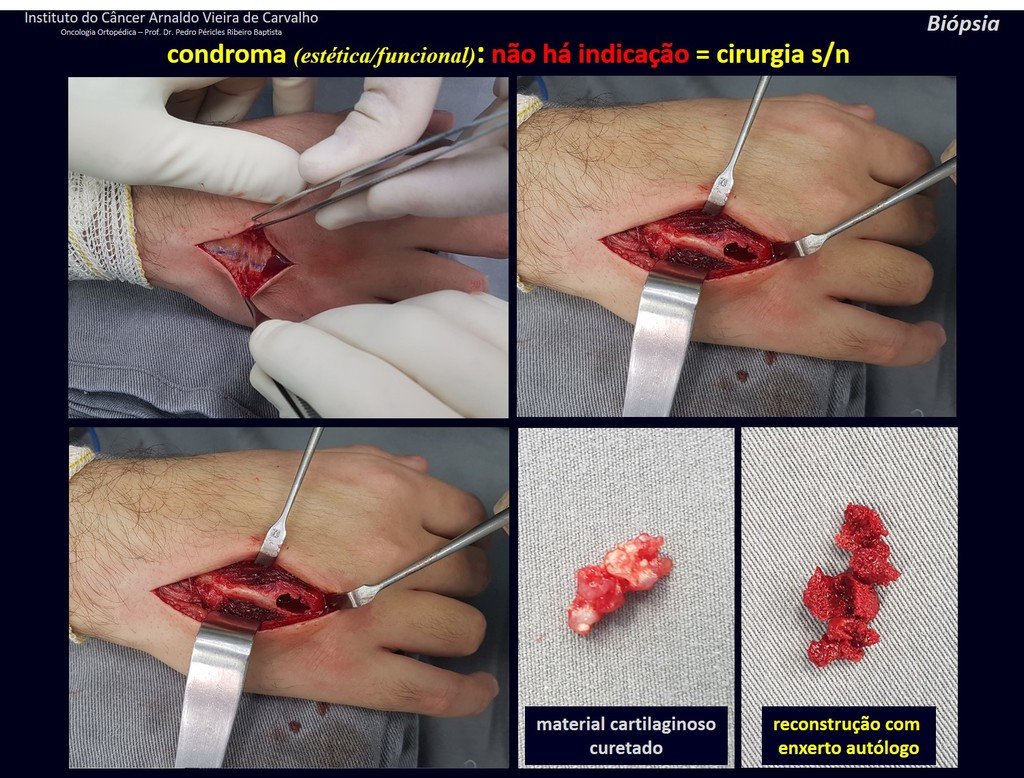
1d . CONDROMA, figuras 33 a 50.
IDENTIDAD: Tumor benigno, indoloro, formador de cartílago, con focos de calcificación en huesos cortos de manos y pies, diagnosticado por casualidad o por deformidad o fractura. Puede ser solitario o múltiple (endondromatosis, síndrome de Maffucci, enfermedad de Ollier).
En los dedos de manos y pies, las lesiones cartilaginosas generalmente se comportan de manera benigna.
La eventual evolución no deseada a condrosarcoma, resultante de la cirugía de legrado en estas localizaciones, no compromete la posibilidad de curación, ya que la resección completa del dedo, que es el tratamiento del condrosarcoma , seguiría siendo posible.
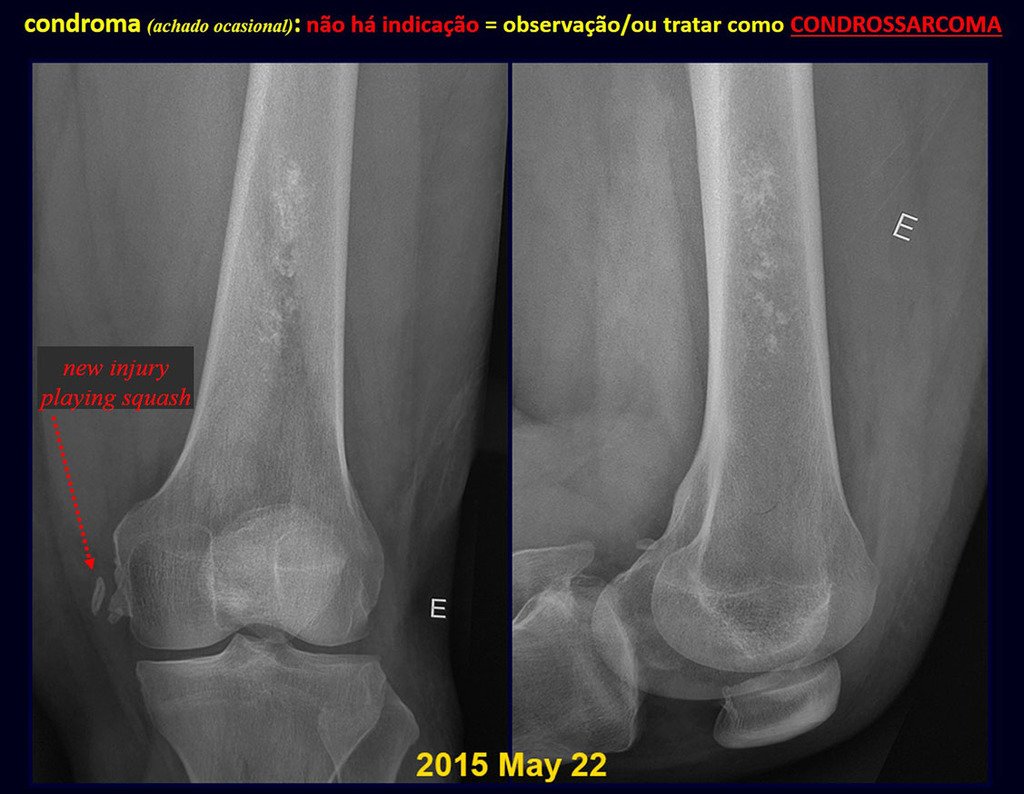
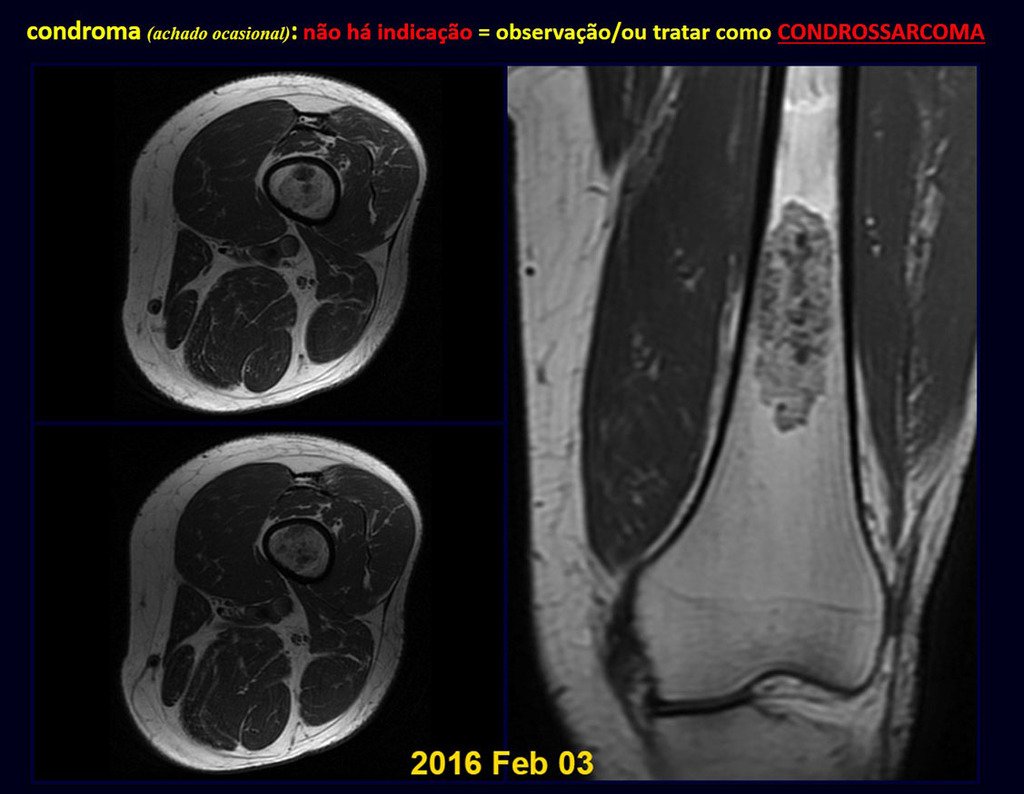
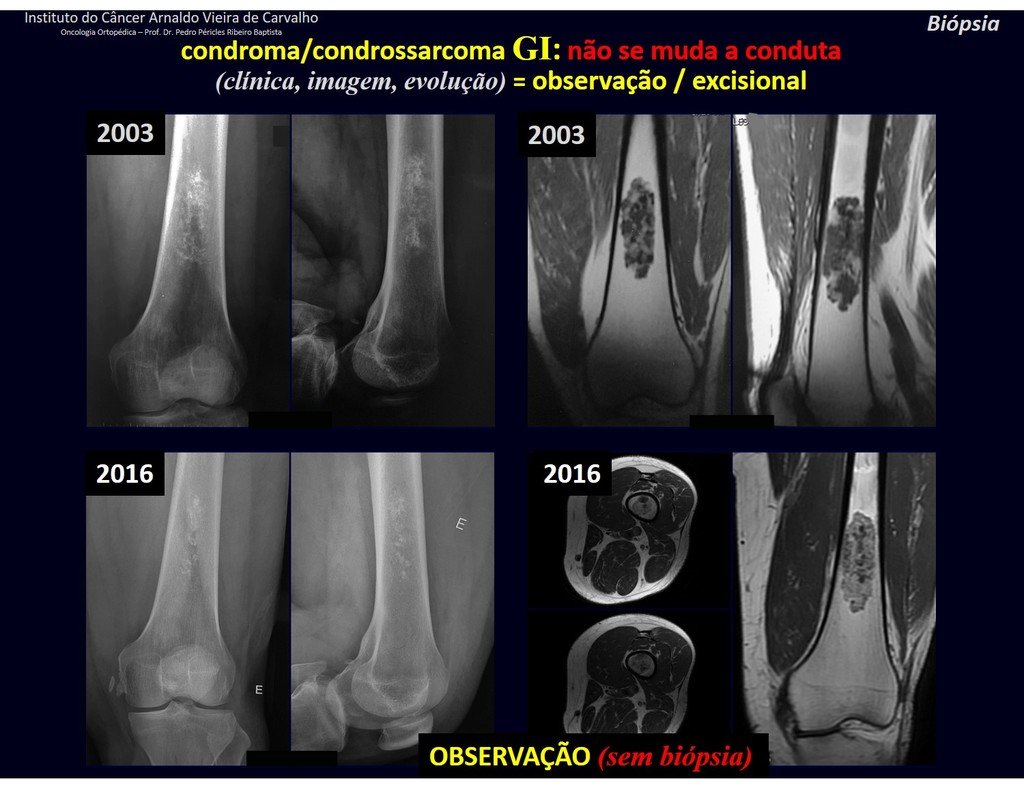
CONTROVERSIA : ¿CONDROMA O CONDROSSARCOMA GRADO I?
El condroma ocurre ocasionalmente en la metáfisis de los huesos largos (fémur distal, húmero y tibia proximal) y en las raíces de las extremidades (hombro, pelvis) . En estos casos se puede confundir con infarto óseo o condrosarcoma grado I.
En hallazgos ocasionales, como el diagnóstico anatomopatológico entre condroma y condrosarcoma grado I es controvertido , es preferible no realizar biopsia y controlar clínica y radiográficamente si hay evolución.
El condrosarcoma grado I es de lenta evolución, lo que permite su seguimiento, posibilitando la observación para un diagnóstico seguro de su actividad o no.
Los exámenes se repiten al mes, a los tres y a los seis meses, y luego anualmente. El tumor debe tratarse quirúrgicamente como condrosarcoma en cualquier momento si la comparación entre imágenes revela cambios en la lesión.
Si la lesión no cambia, lo mejor es seguir monitoreando. Algunos pacientes preguntan ¿hasta cuándo? La respuesta es: – Siempre. La reevaluación debe continuar independientemente de si el paciente se somete a cirugía o no.
Tratar una lesión asintomática, un hallazgo casual, sin cambiar la imagen con cirugía menor es un “ sobretratamiento”, que también requerirá seguimiento o peor, si el examen anatomopatológico revela una histología maligna.
Como ejemplo de esta conducta, analizaremos el siguiente caso, seguido durante 14 años, figuras 39 a 42.
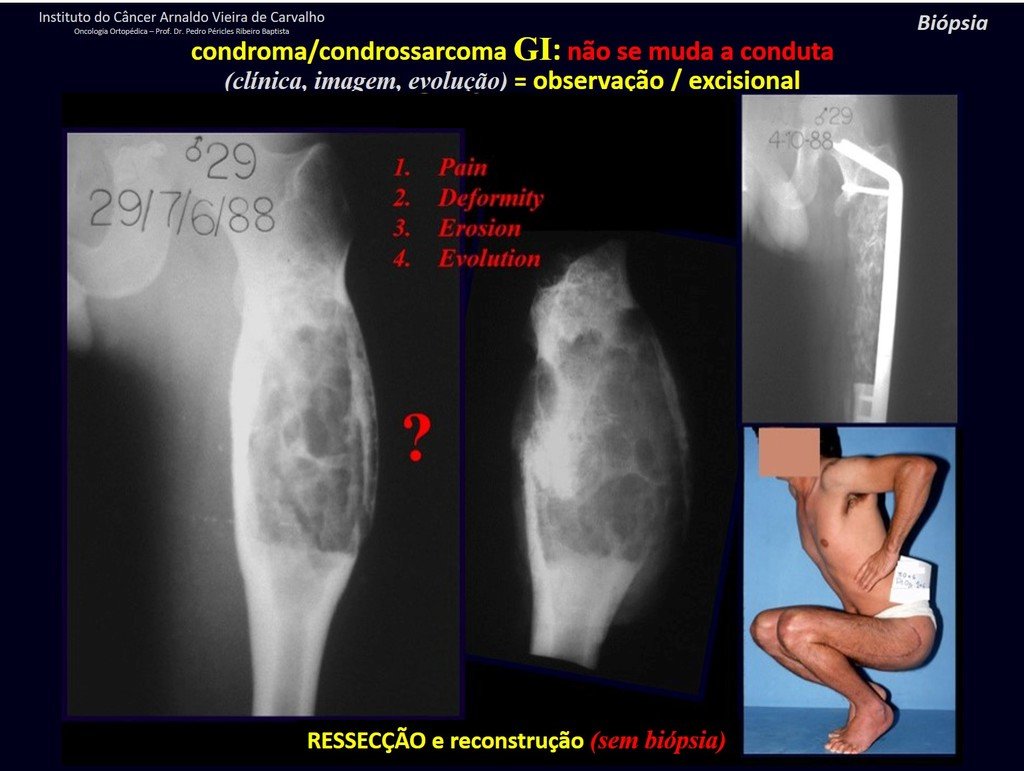
¿CONDROMA o CONDROSSARCOMA? En estos casos debe prevalecer el sentido común , nos advierte que el periódico acepta cualquier escrito.
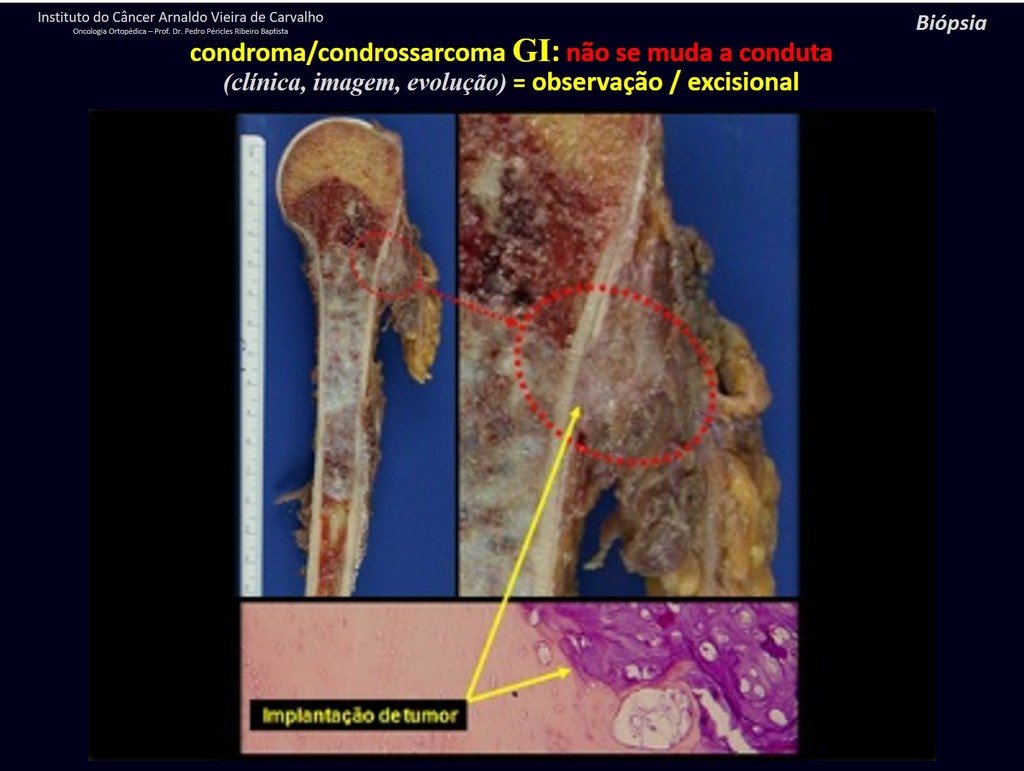
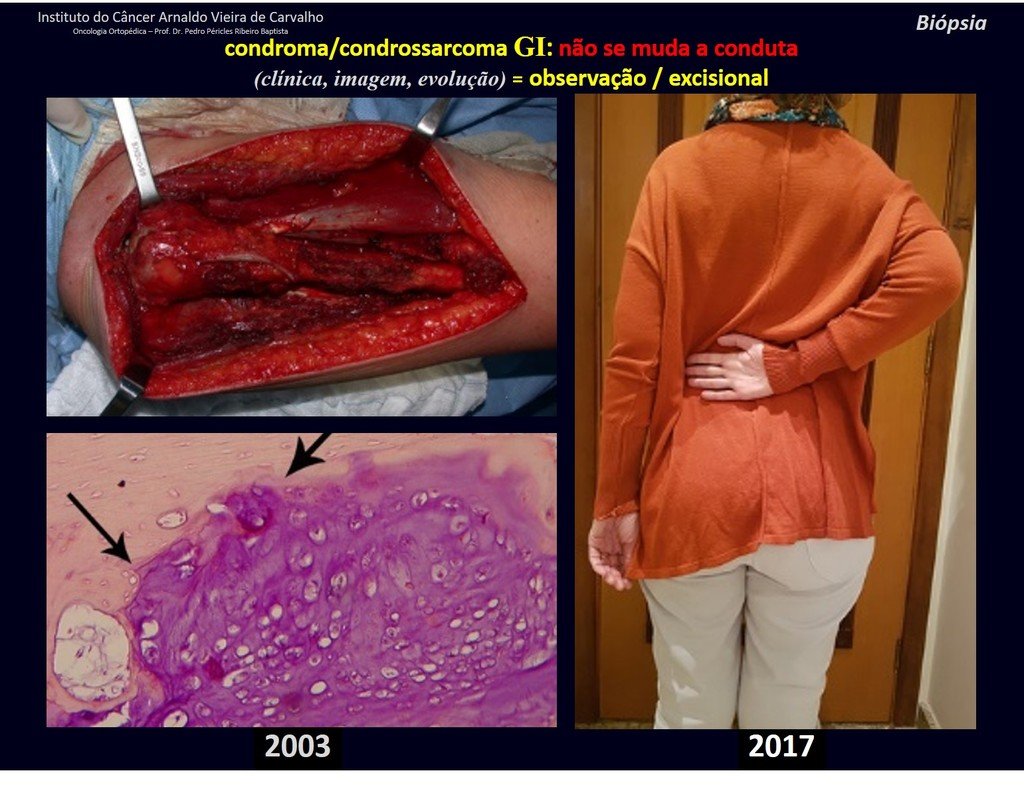
Debemos basarnos en el comportamiento clínico de la lesión. ¿Hubo un cambio o no? Si optamos por realizar una biopsia sólo podemos añadir si se trata o no de una “lesión cartilaginosa” . No podemos cambiar nuestro comportamiento: OBSERVAR U OPERAR COMO CONDROSSARCOMA . Para estar seguros, si optamos por operarnos, debemos tratarlo quirúrgicamente como condrosarcoma, que es nuestra única “ herramienta” , ya que no responden a la quimioterapia ni a la radioterapia.

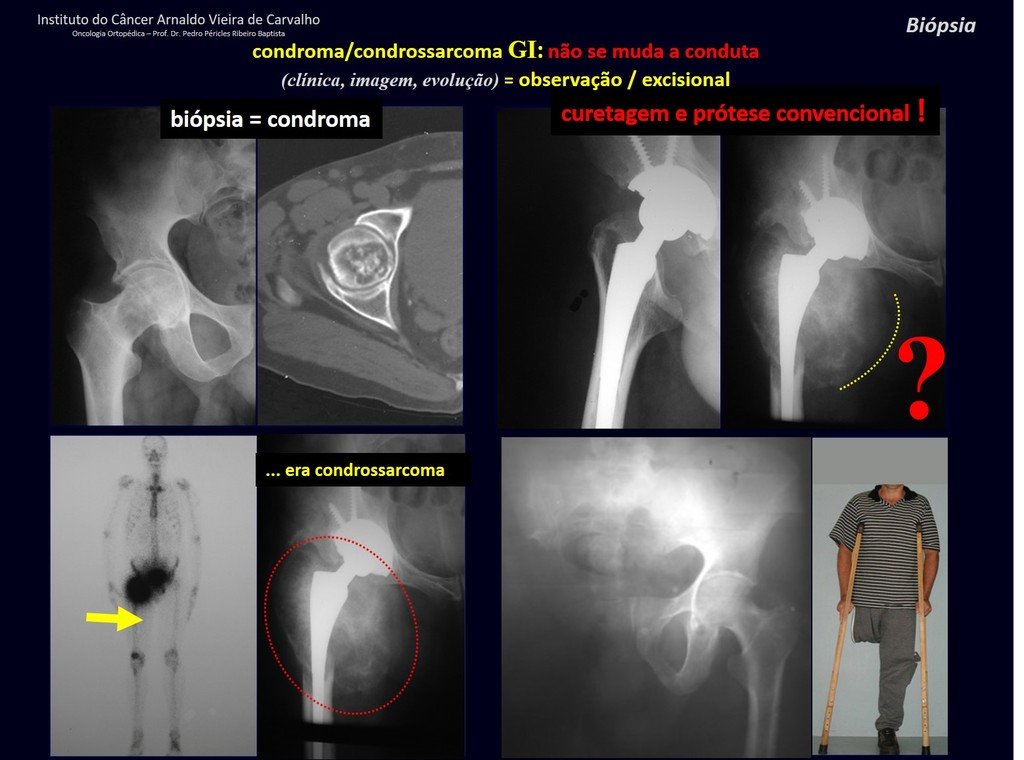
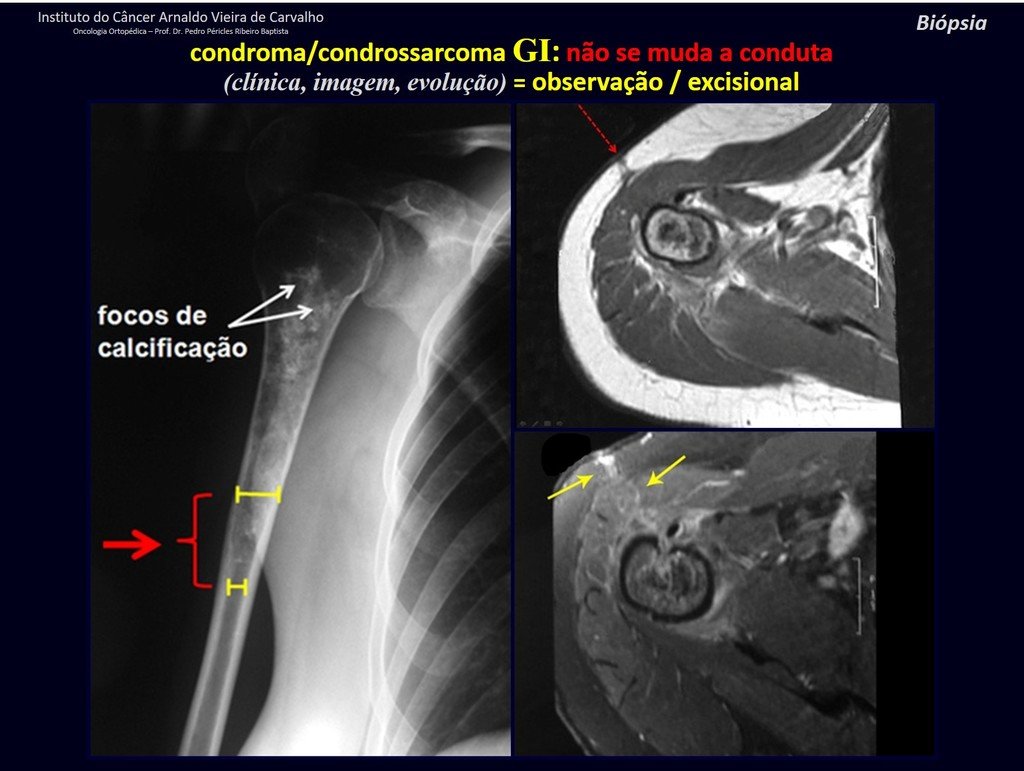
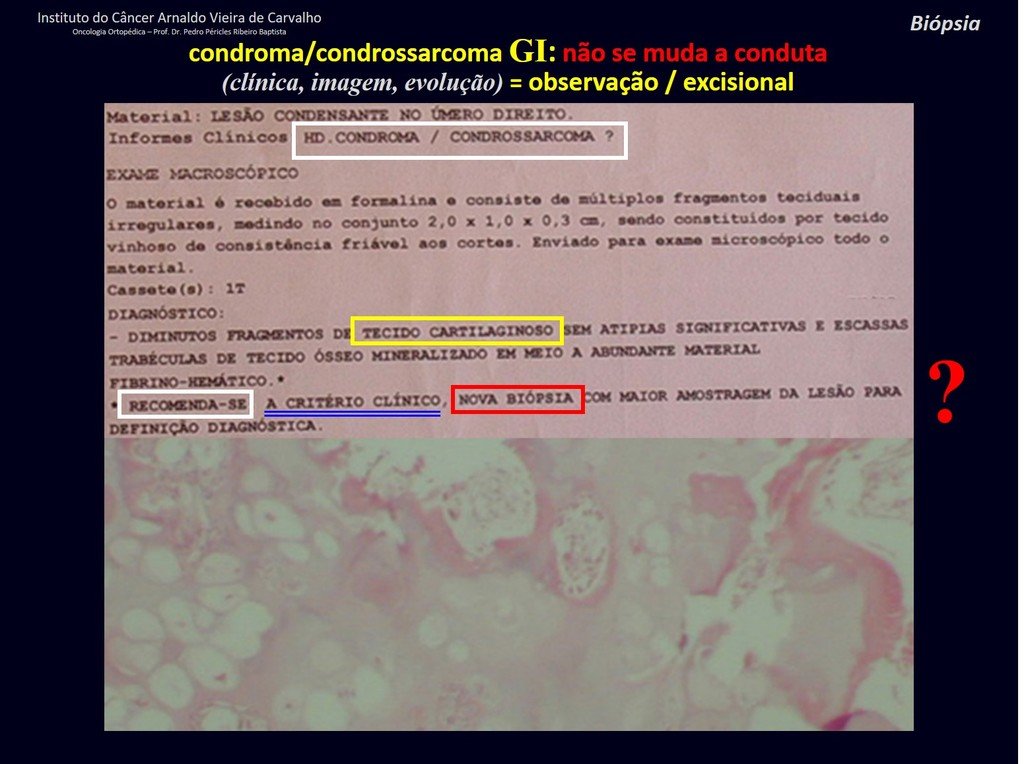
¨El médico puede realizar la biopsia , ya que es un procedimiento académico, lo que le da mayor sustento de si se trata de una lesión cartilaginosa. Pero no se debe operar con una técnica de legrado , como el condroma, ya que los condromas latentes de huesos largos, hallazgos casuales, no requieren tratamiento quirúrgico sino observación. La biopsia dificulta esta observación porque no sabremos si el dolor y los cambios en la imagen que se pueden producir tras la biopsia se deberían a la agresión de la biopsia o si se trata de un condrosarcoma que se manifiesta. En conclusión, si el médico decide intervenir, debe operar el condrosarcoma . Recordamos también que la cirugía, realizada mediante cualquier técnica, no eliminará la necesidad de observación y seguimiento¨.
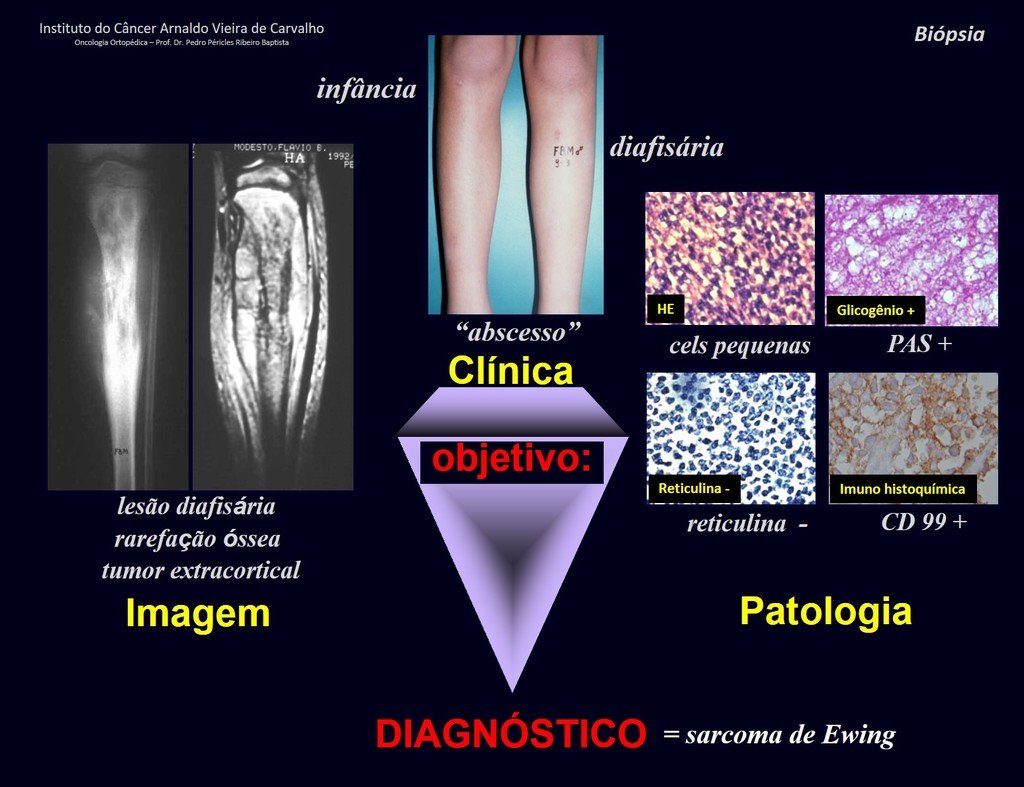
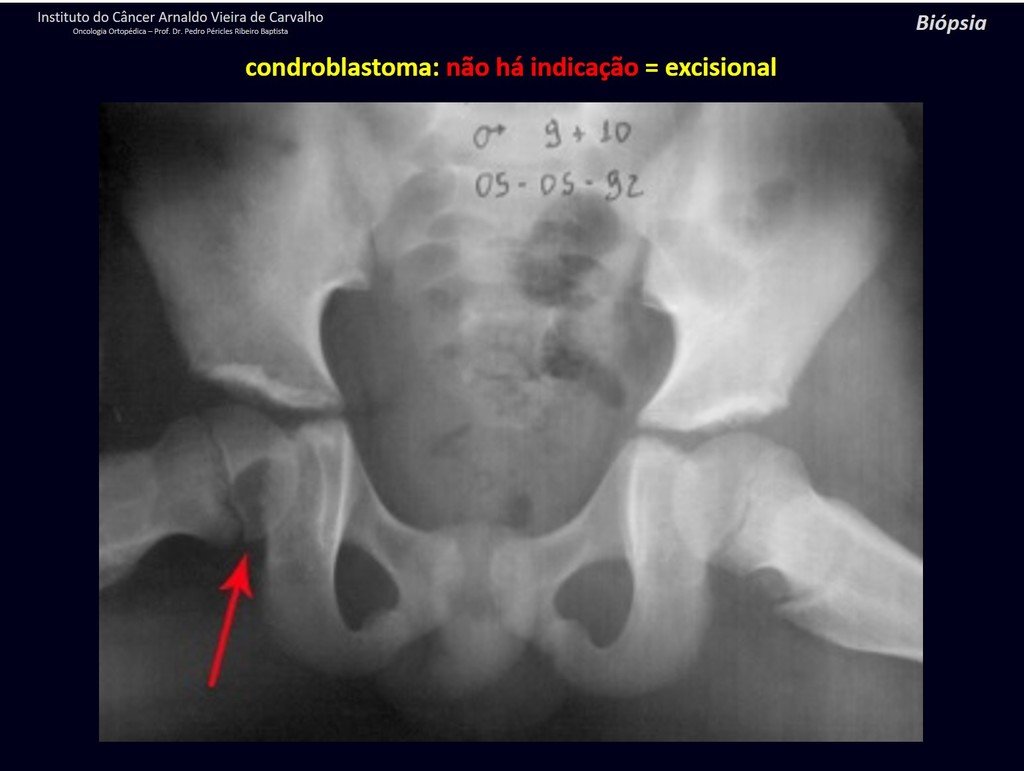
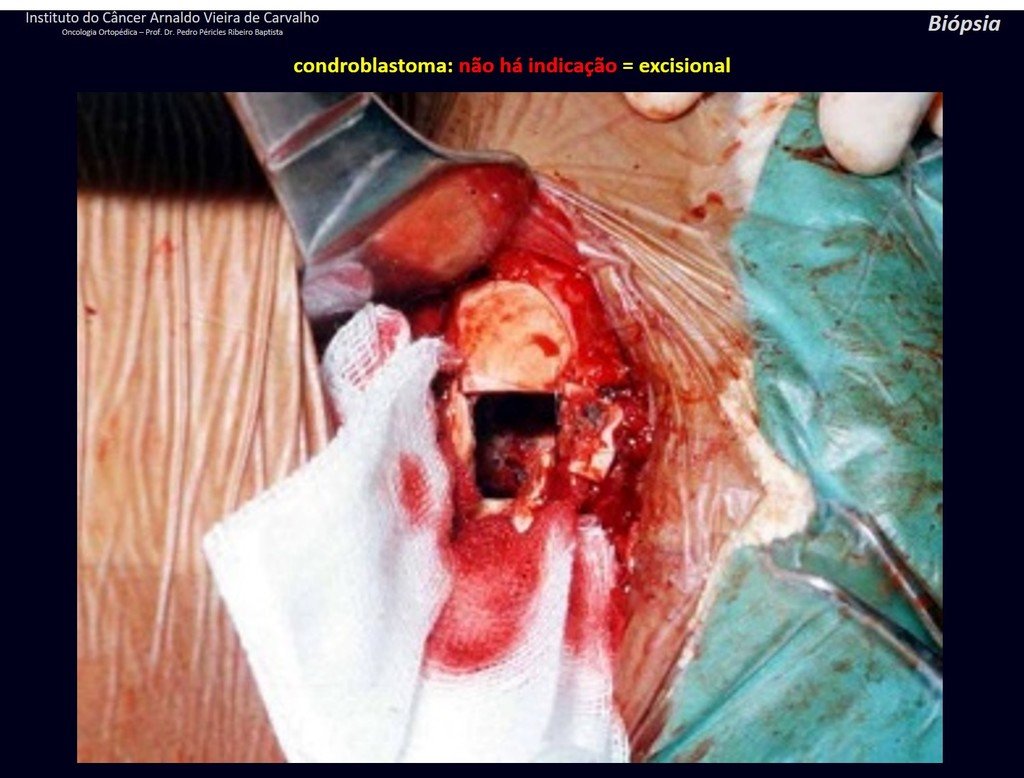
1 y . CONDROBLASTOMA, figuras 51 a 54.
IDENTIDAD: Lesión neoplásica epifisaria benigna del esqueleto en crecimiento (1.ª y 2.ª décadas ), caracterizada por rarefacción ósea, erosión del cartílago articular con inflación, células cartilaginosas (condroblastos), células gigantes y focos de calcificación.
El legrado adyuvante y la cirugía electrotérmica de esta neoplasia, en estas localizaciones y en lesiones de pequeño tamaño, no es más que una biopsia incisional, en la que el aspecto macroscópico del cartílago permite un legrado completo del tumor. La presencia del patólogo en la consulta es útil para corroborar y asistir al cirujano. Leer: http://condroblastoma
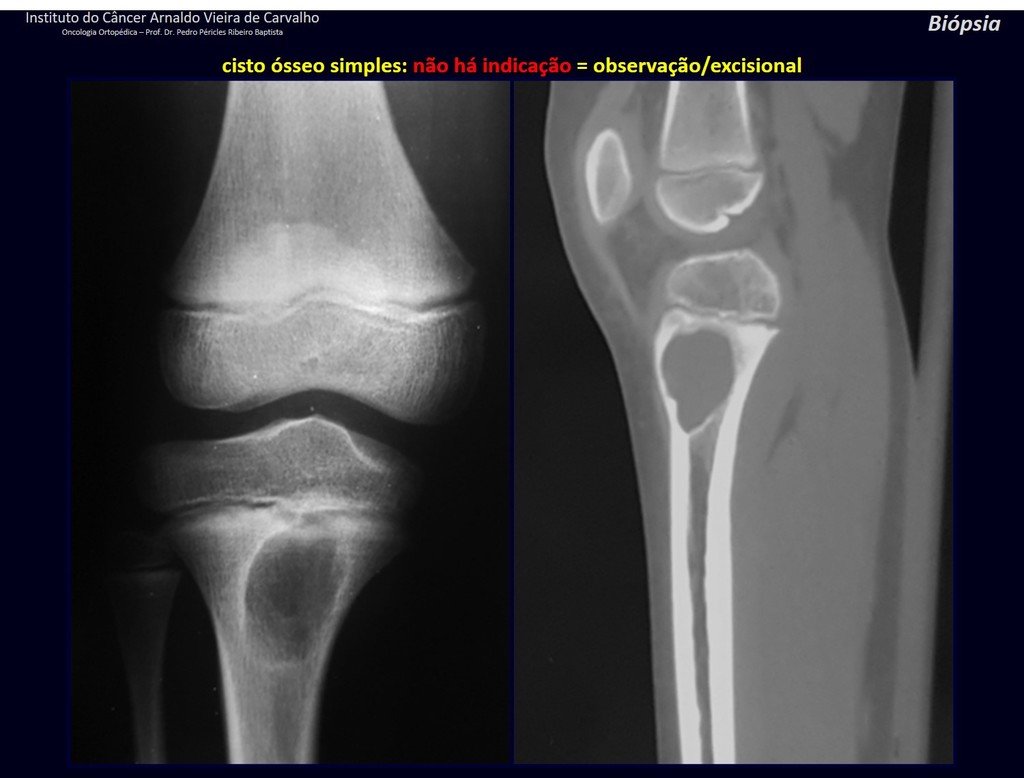
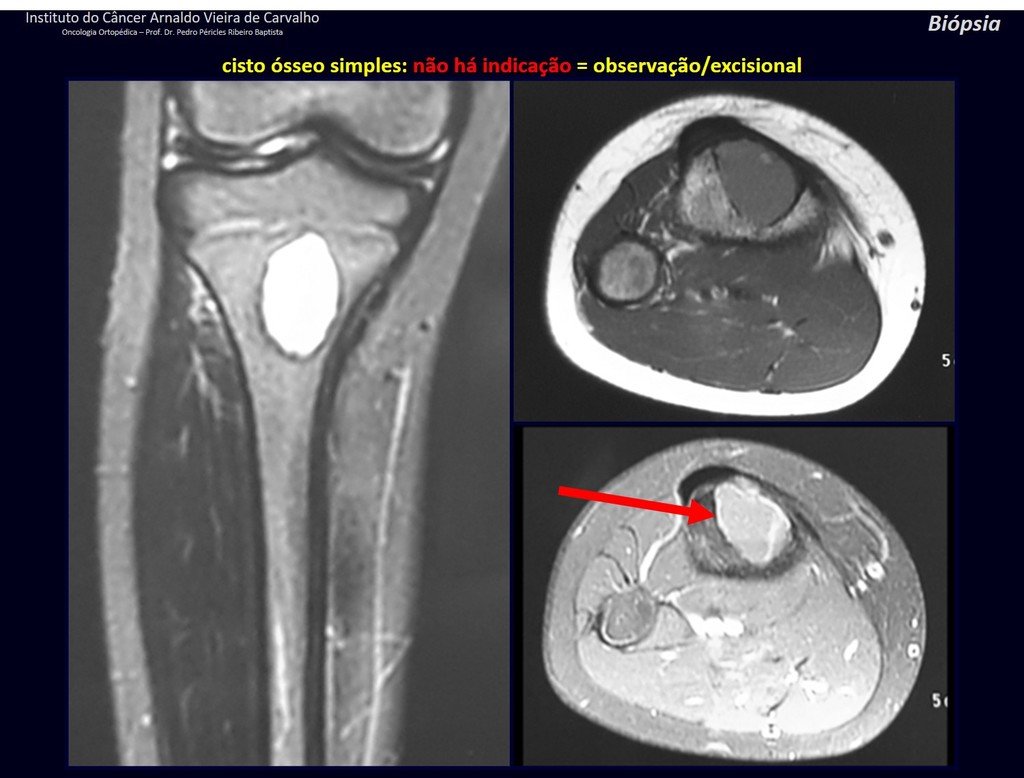
1f . QUISTE ÓSEO SIMPLE – COS, figuras 55 a 58.
IDENTIDAD: Lesión pseudoneoplásica, unicameral, rodeada por una membrana, bien delimitada, llena de líquido seroso, de localización metafisaria central , que no excede su ancho y se presenta en niños y adolescentes.
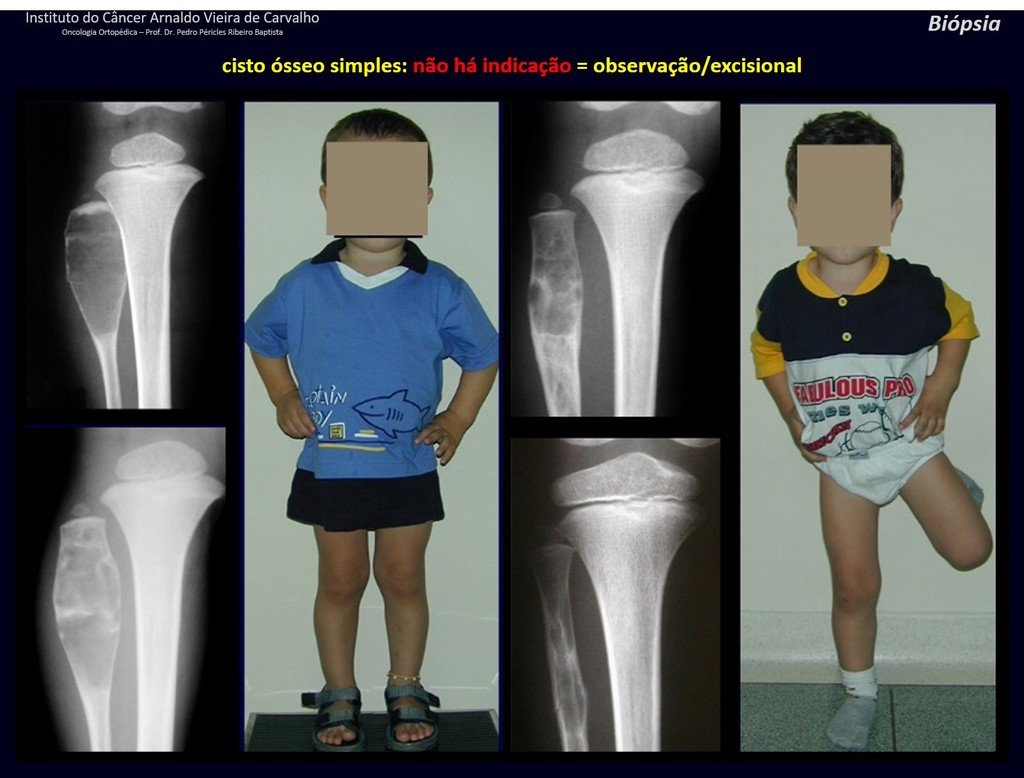
Leer: http://quiste óseo simple
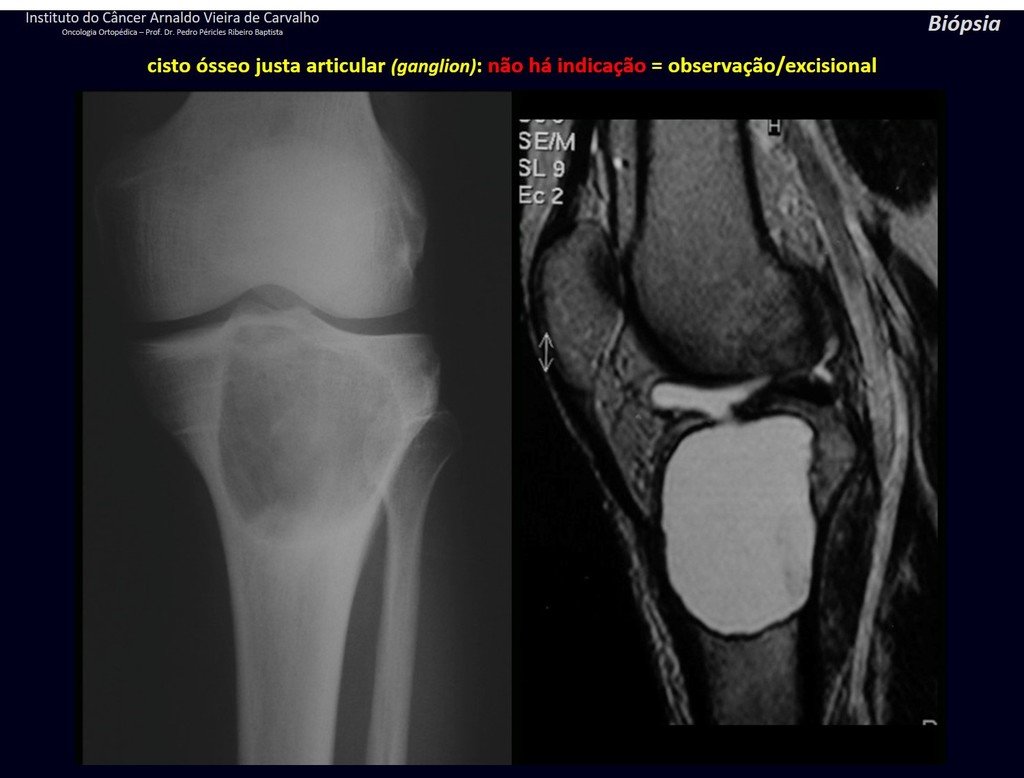
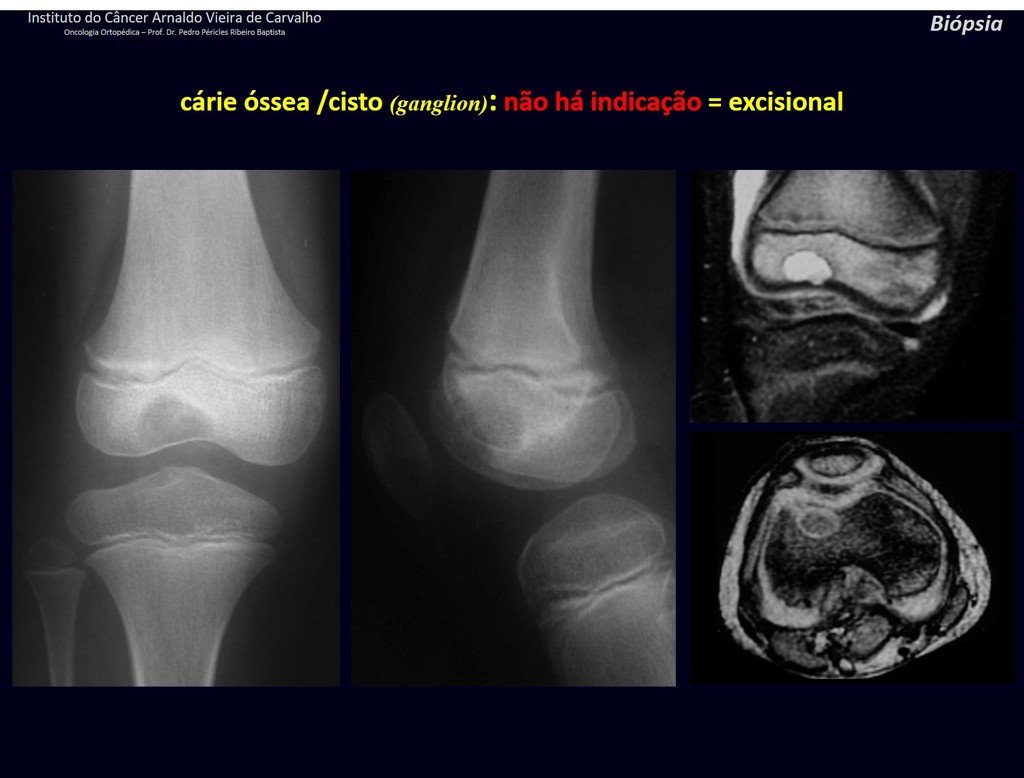
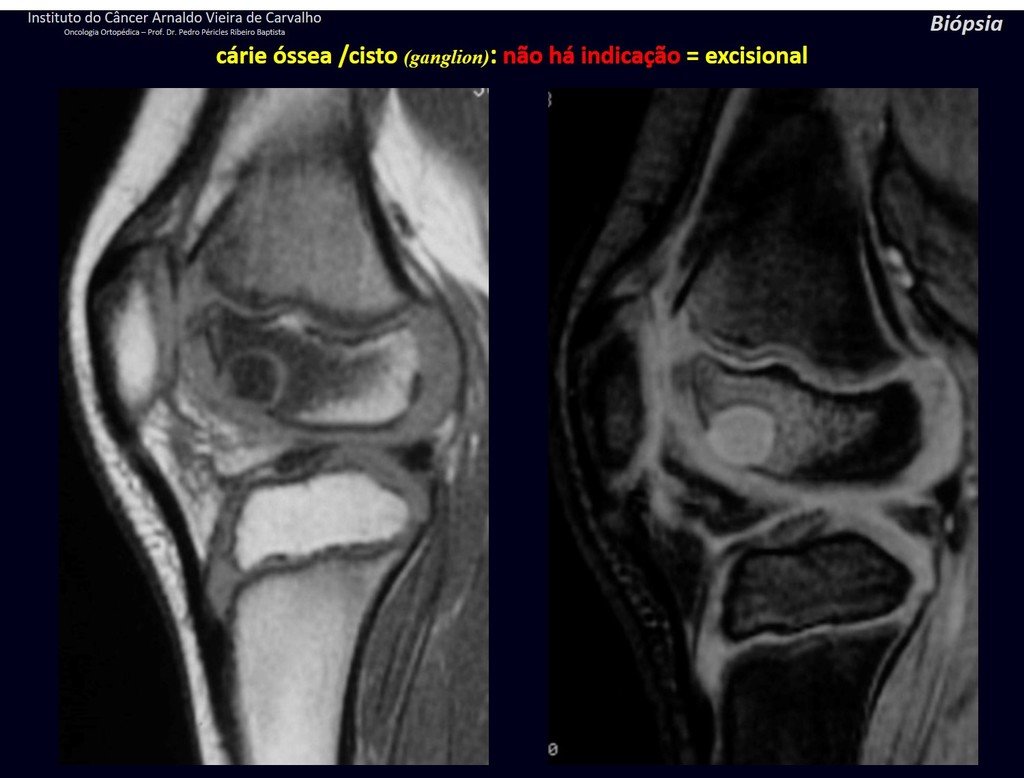
1g . QUISTE ÓSEO JUSTAARTICULAR – GANGLION, figuras 59 a 62.
IDENTIDAD: Lesión pseudoneoplásica, de localización epifisaria , unicameral, rodeada por membrana sinovial, bien definida y llena de líquido seroso, que comunica con la articulación adyacente.
Estas lesiones no requieren una biopsia para su tratamiento.
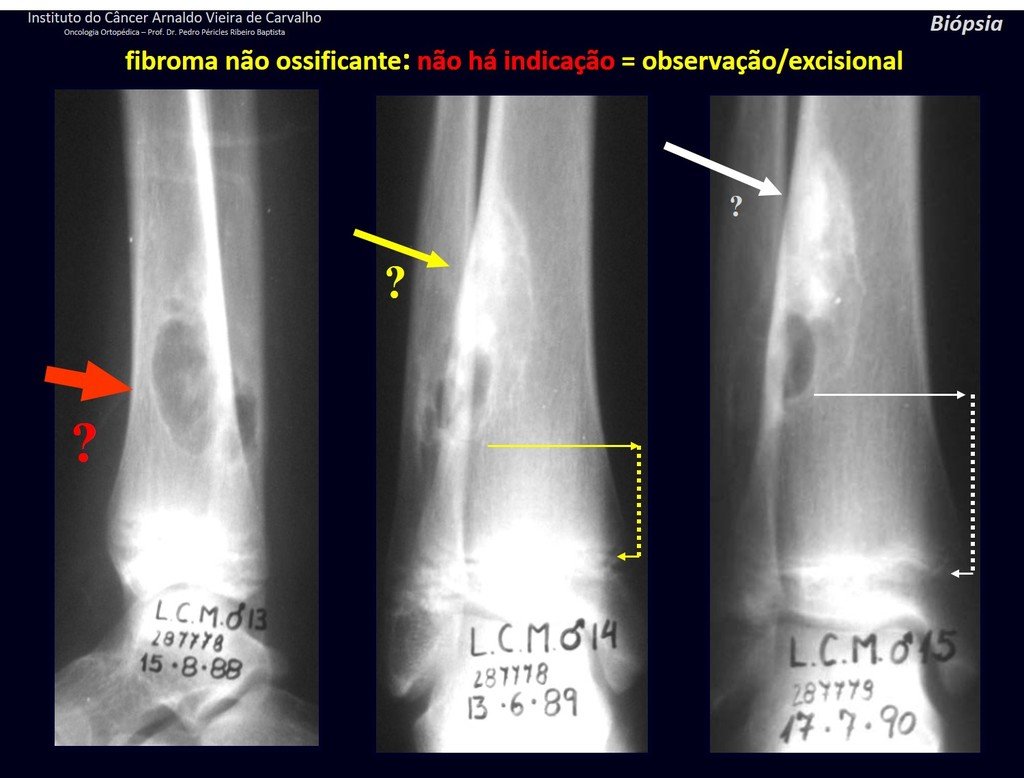
1h . DEFECTO FIBROSO CORTICAL / FIBROMA NO OSIFICANTE, figuras 63 y 64.
IDENTIDAD: Lesión pseudoneoplásica en hueso cortical de límites precisos, asintomática. Hallazgo ocasional.
Estas lesiones ocurren en el hueso cortical y no requieren una biopsia para su tratamiento/monitoreo.
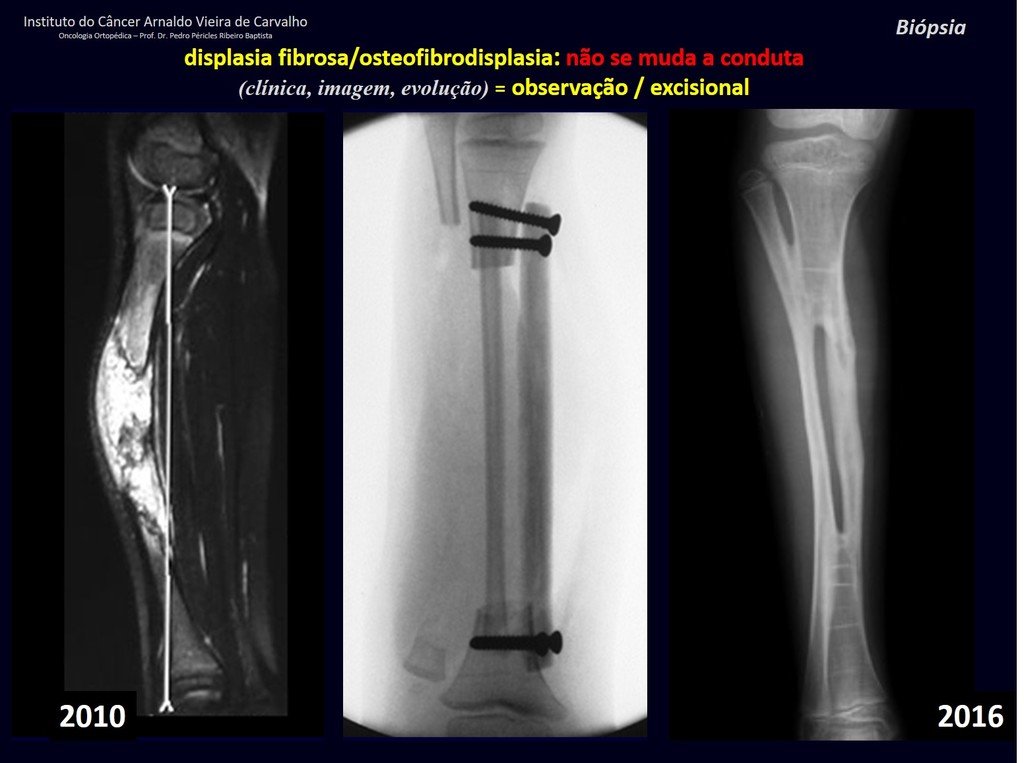
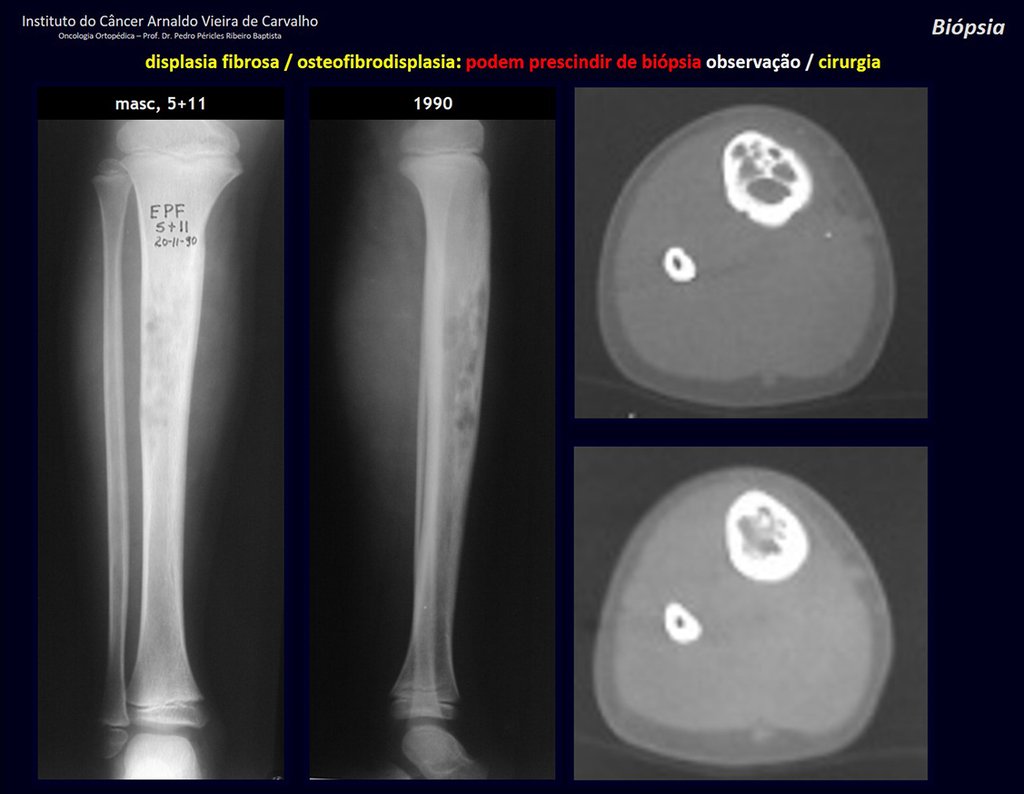
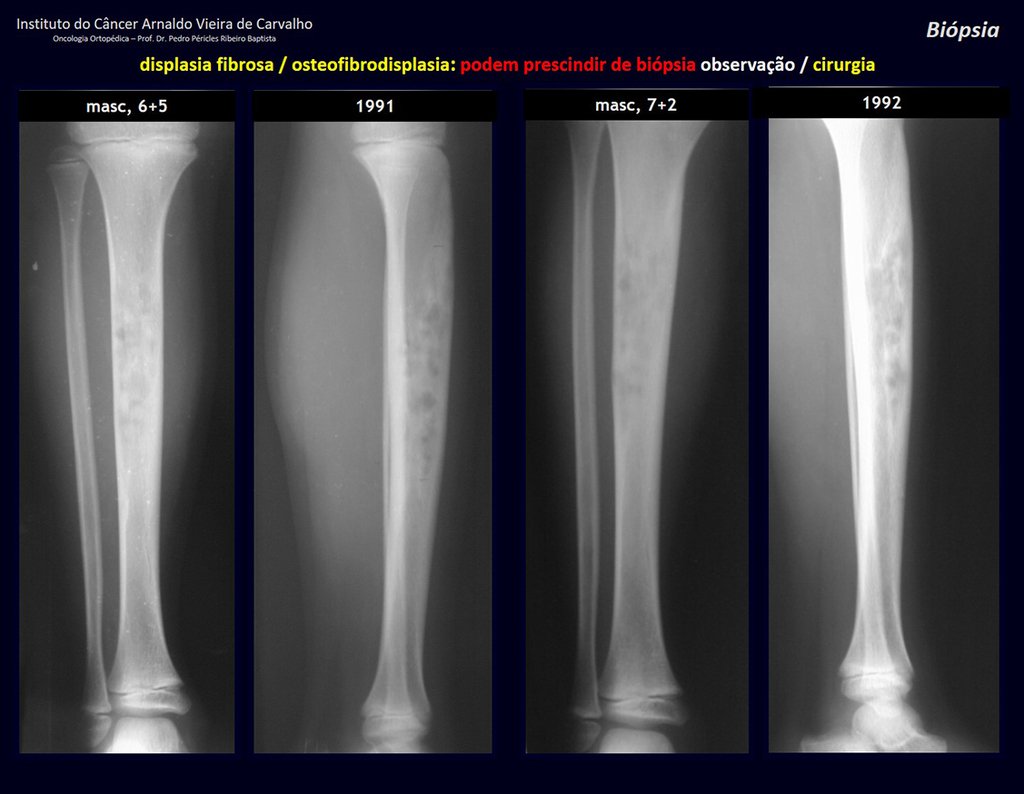
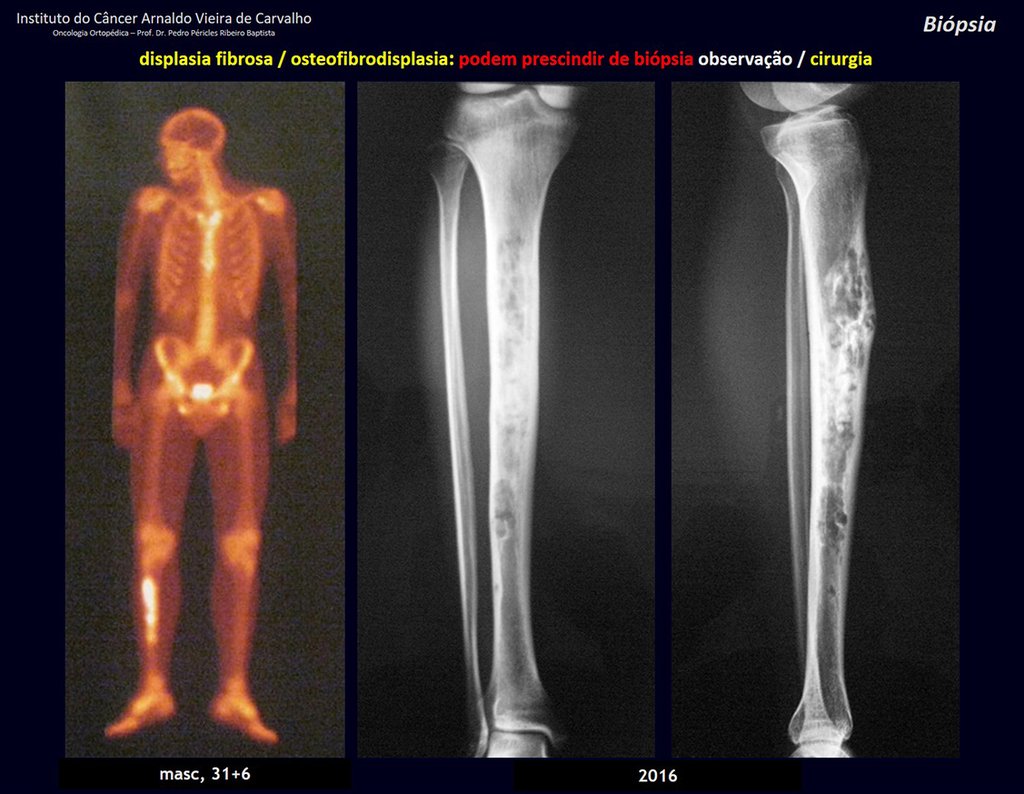
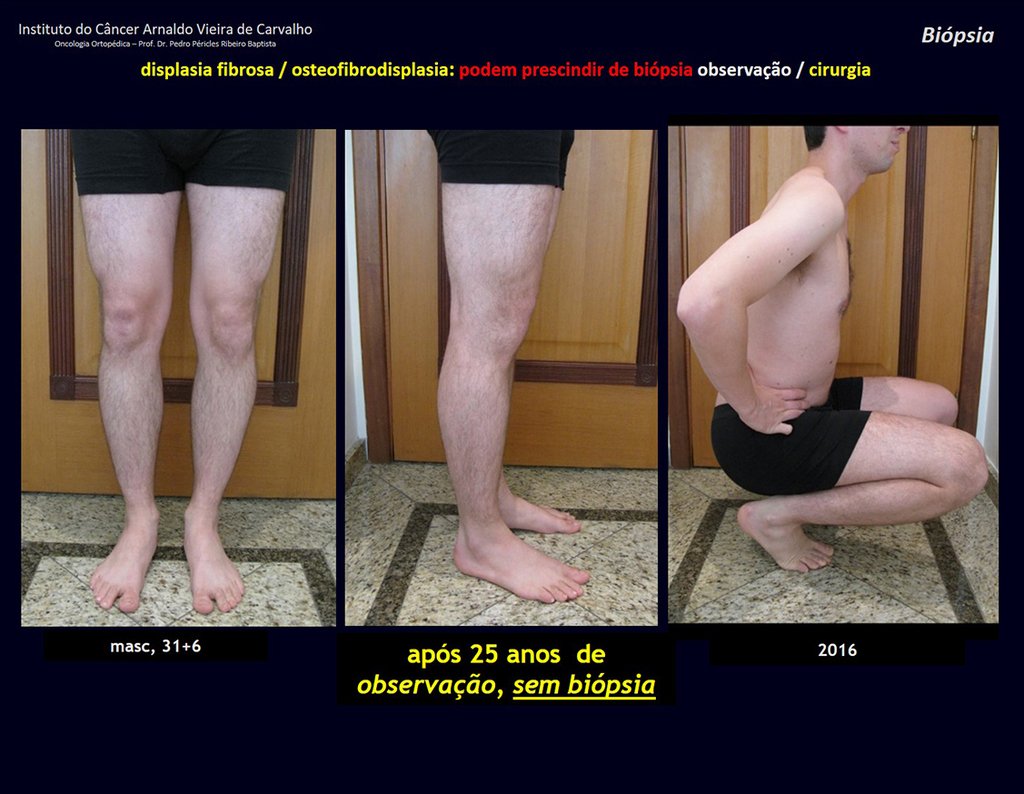
1i . DISPLASIA FIBROSA DE LA TIBIA / OSTEOFIBRODISPLASIA, figuras 65 a 70.
IDENTIDAD: Lesión pseudoneoplásica en diáfisis tibial con rarefacción ósea de densidad intermedia, como si el hueso hubiera sido “borrado” , con apariencia de vidrio esmerilado. Puede ocurrir en más de un lugar. Su evolución es variable y puede provocar deformidad, desdiferenciación o crecimiento armonioso, estabilizándose en la madurez esquelética.
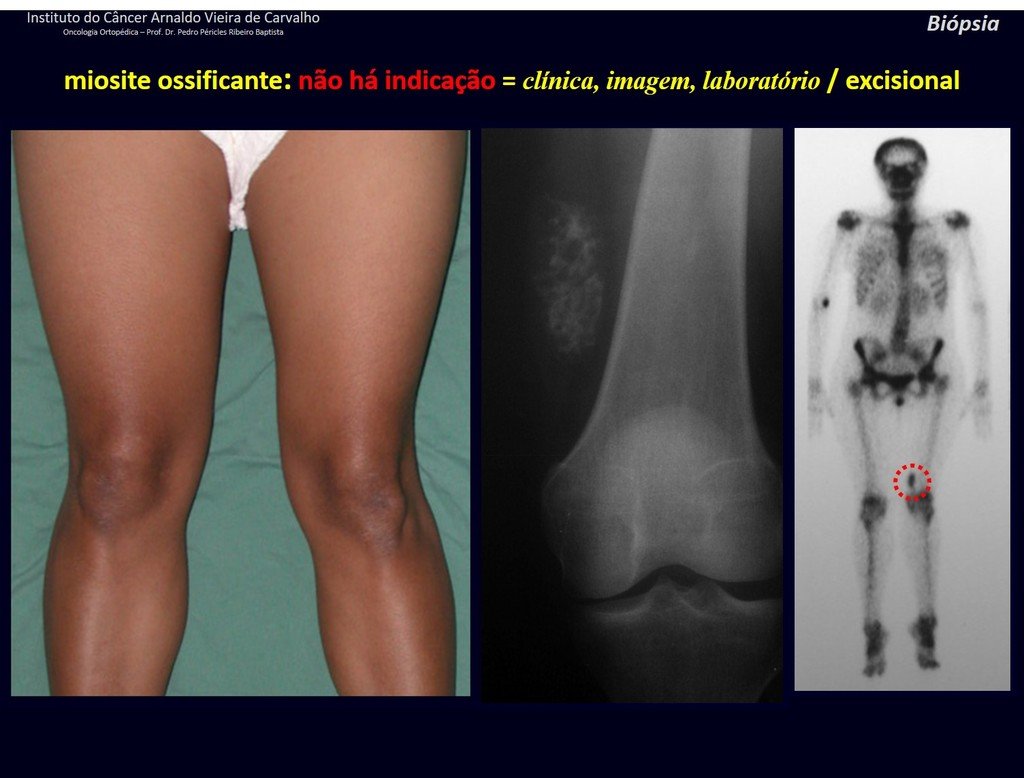
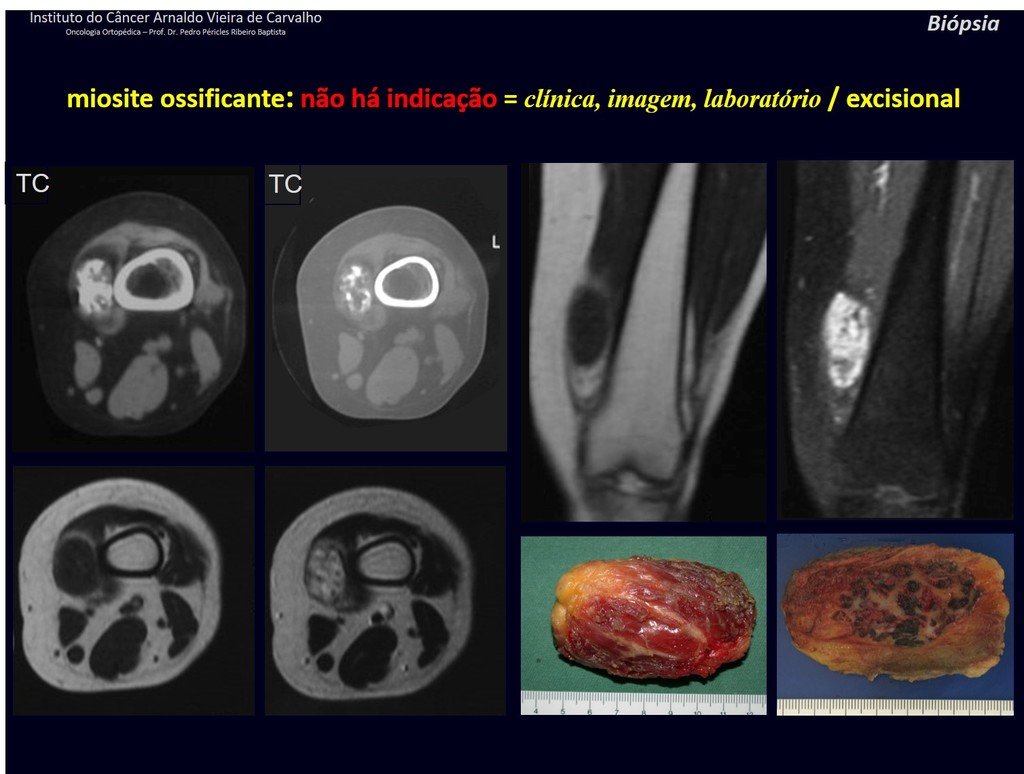
1J . MIOSITIS OSIFICANTE, figuras 71 y 72.
IDENTIDAD: Lesión localizada próxima a un hueso y en tejidos blandos, relacionada con un traumatismo previo, cuya osificación se inicia en la periferia.
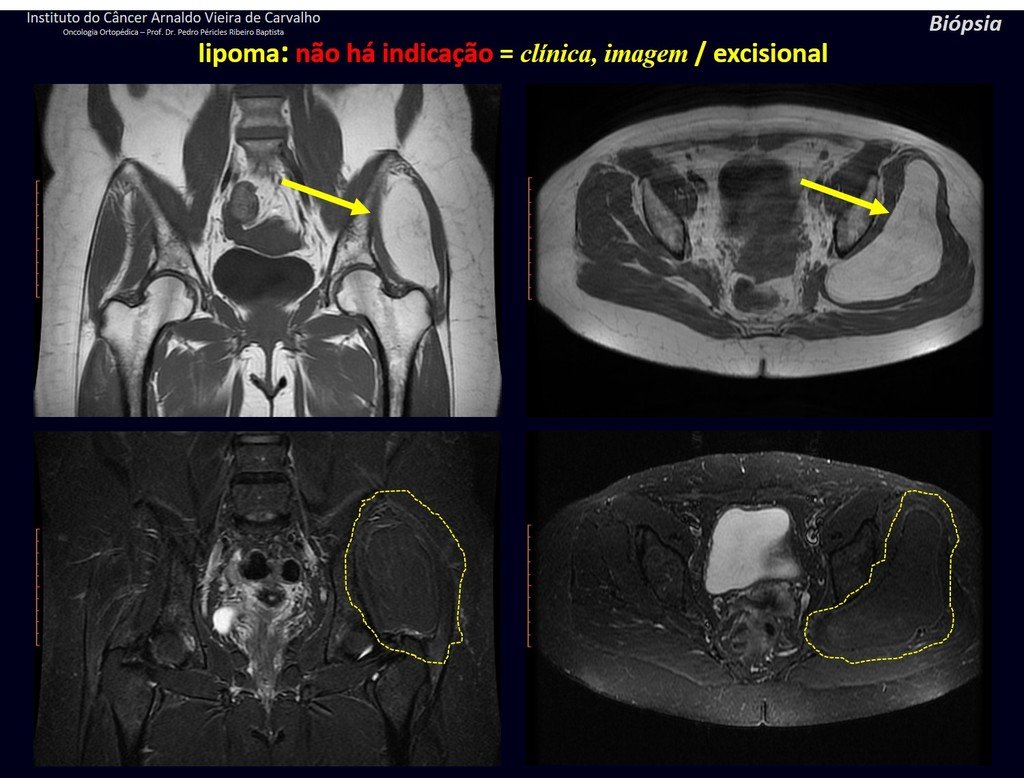
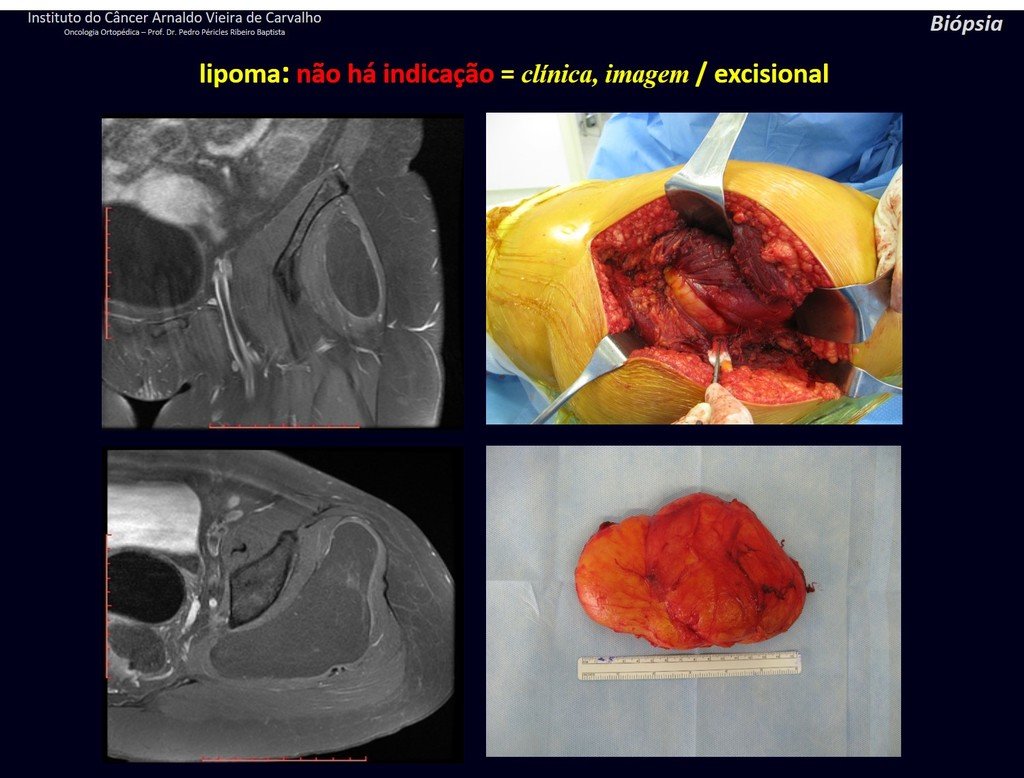
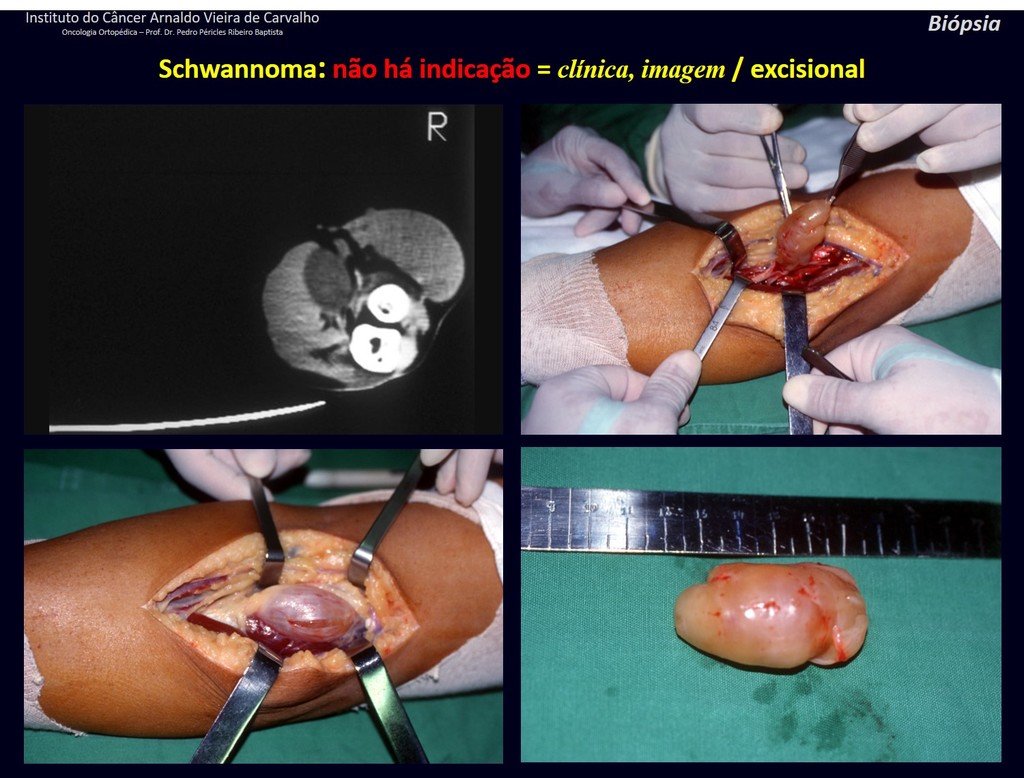
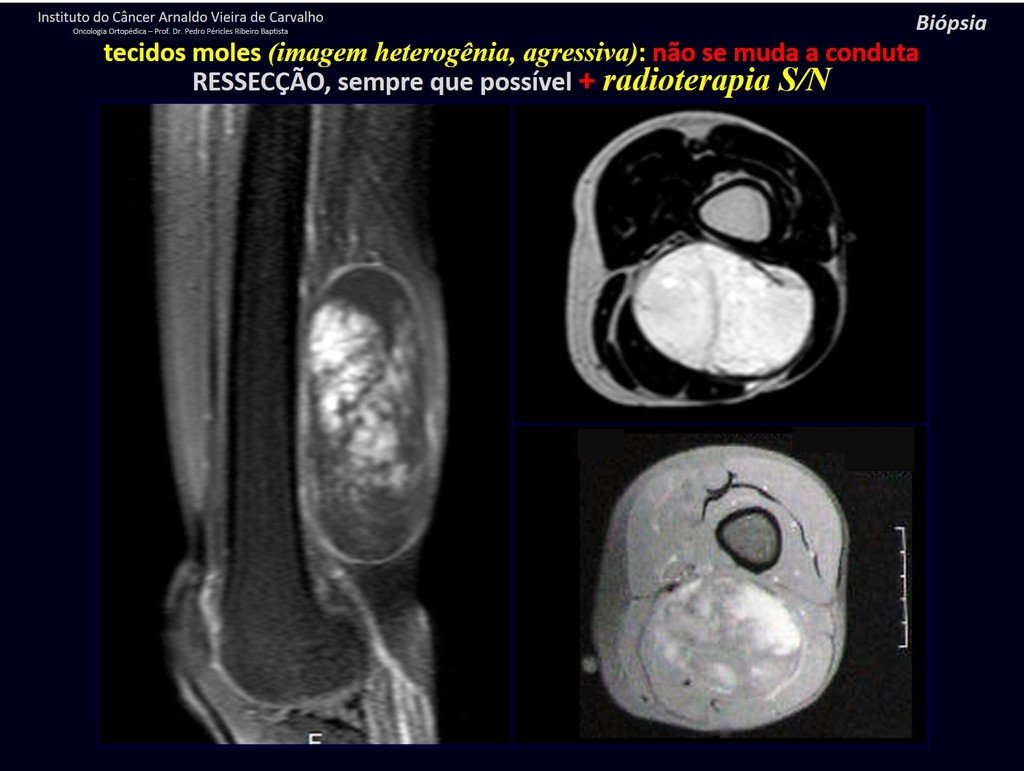
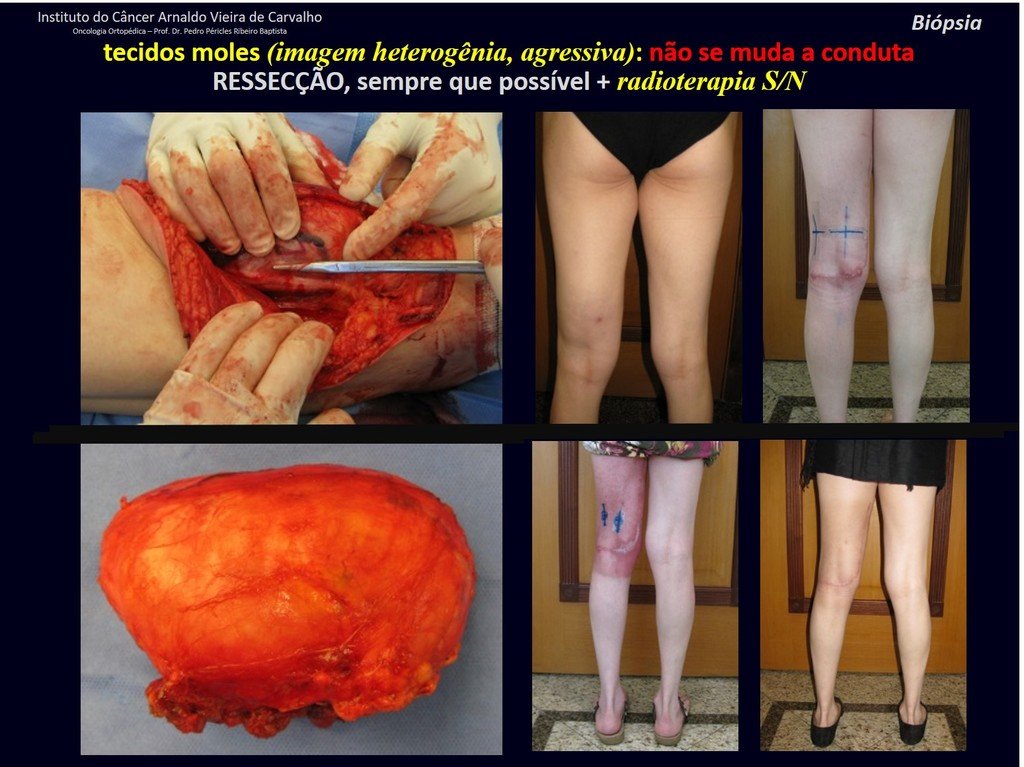
1k . TUMOR DE TEJIDO BLANDO – ALGUNOS , figuras 73 a 78.
IDENTIDAD: Las lesiones delimitadas, homogéneas, con imágenes típicas, sin captación de contraste o con captación sólo en la periferia, pueden ser intervenidas sin biopsia previa, cuando el abordaje quirúrgico no sería diferente, incluso tratándose de una neoplasia maligna.
Los tumores malignos de tejidos blandos tendrían el mismo procedimiento de resección quirúrgica, con los márgenes estrechos que presenta el caso anterior y se complementarían con radioterapia local. Los sarcomas de tejidos blandos, hasta la fecha, no responden a la quimioterapia ni muestran una mejora en la tasa de supervivencia del paciente.
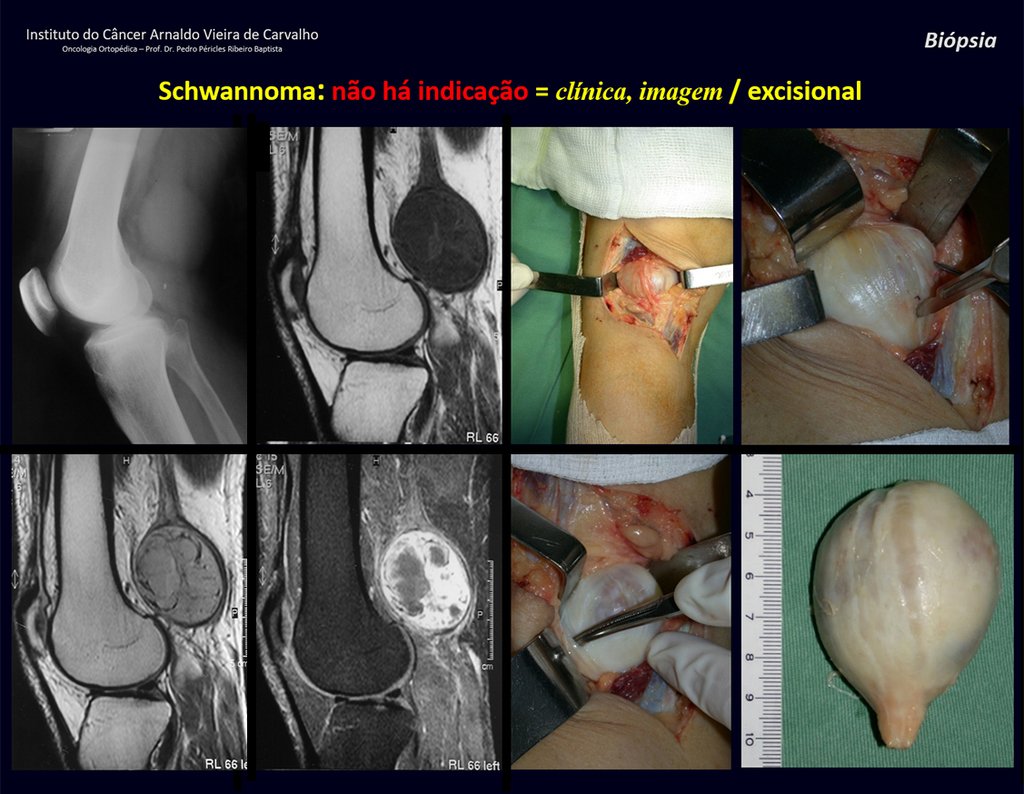
Una posible biopsia podría causar daño a los nervios y no cambiaría el manejo.
La biopsia se puede realizar, es académica, complementa los estudios de caso, pero debe prevalecer la resección quirúrgica, incluso en el caso de neoplasia maligna. Los sarcomas de tejidos blandos, hasta la fecha, no se benefician del tratamiento neoadyuvante y la cirugía ablativa no altera la supervivencia.
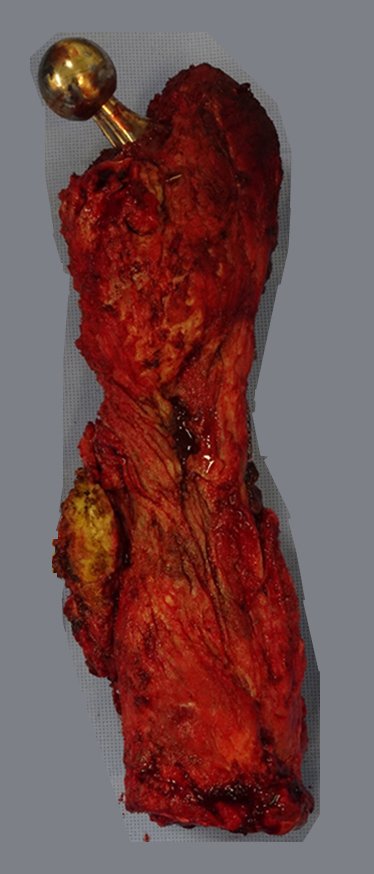
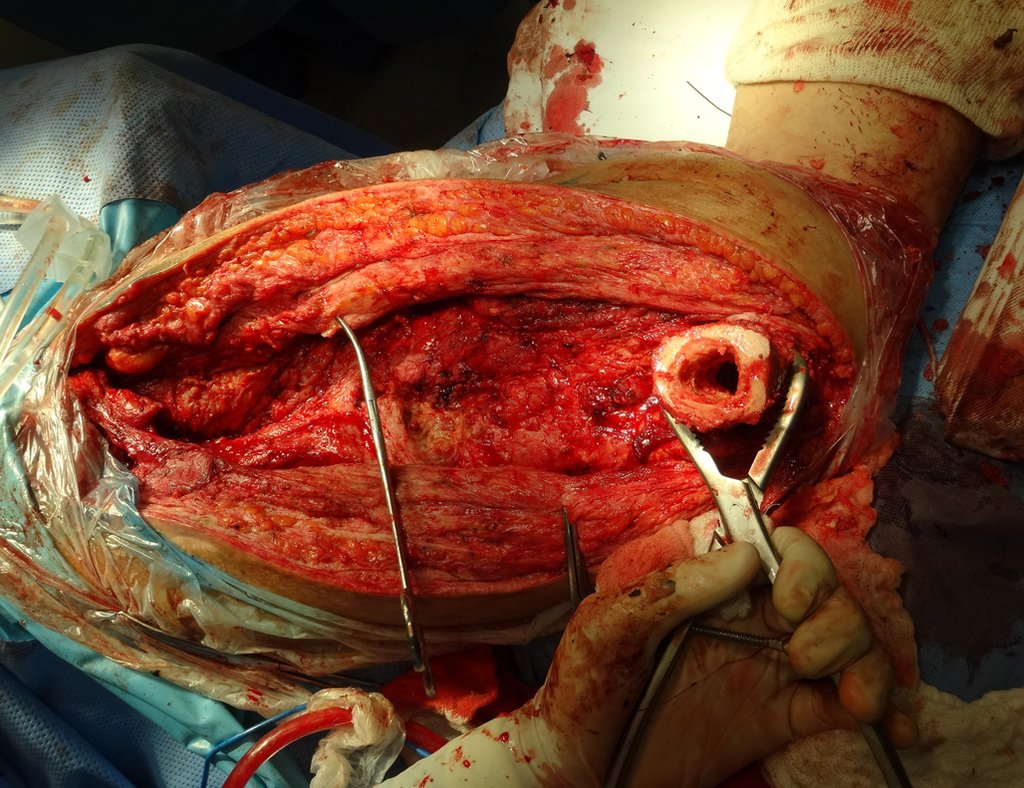
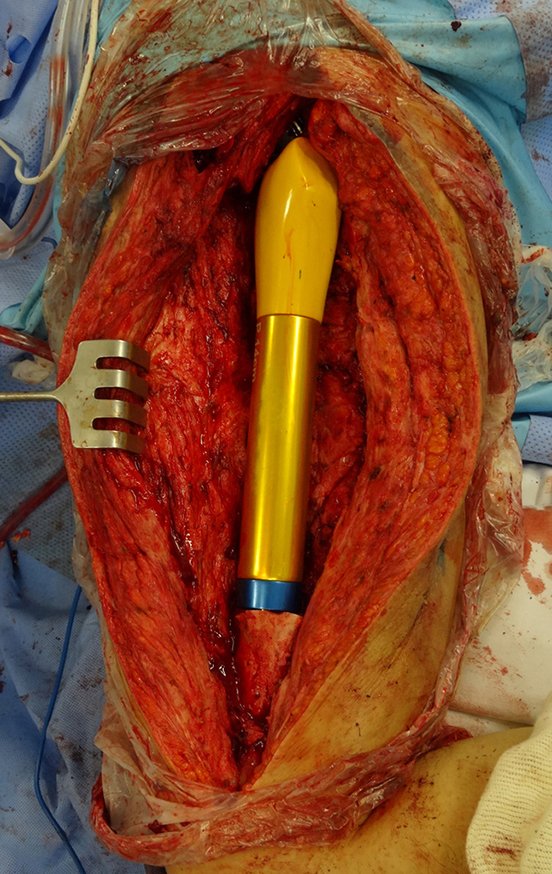
GRUPOS 3 : La biopsia es necesaria para el tratamiento (cirugía; con/sin neoadyuvancia)
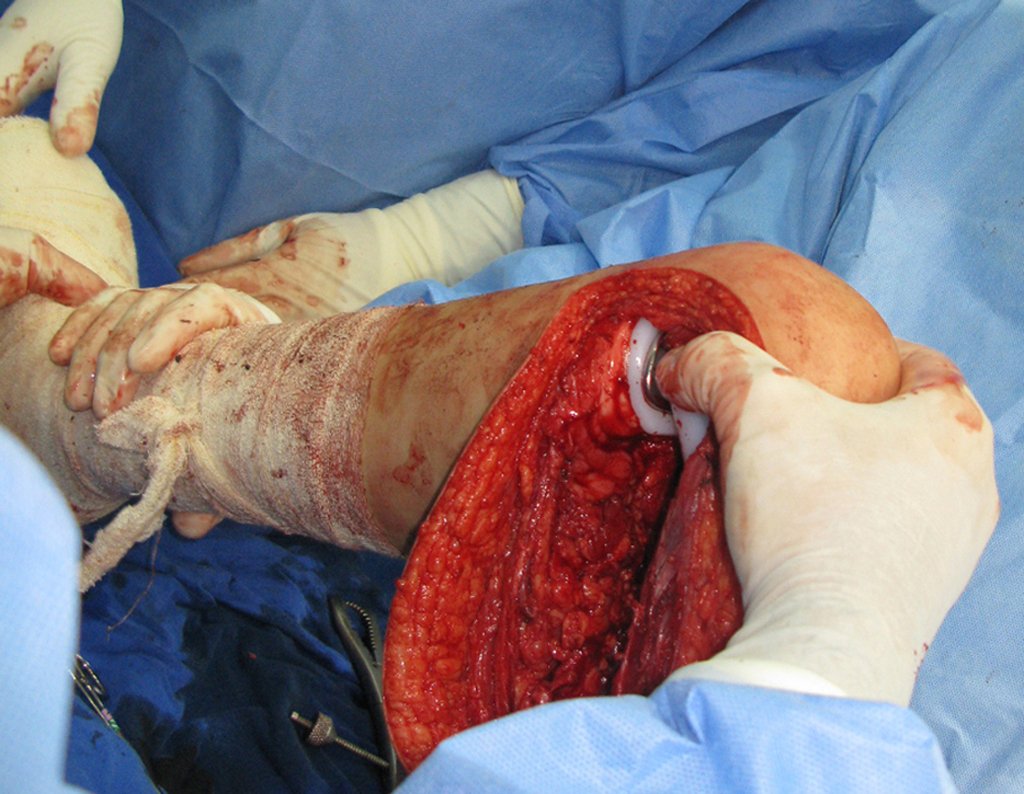
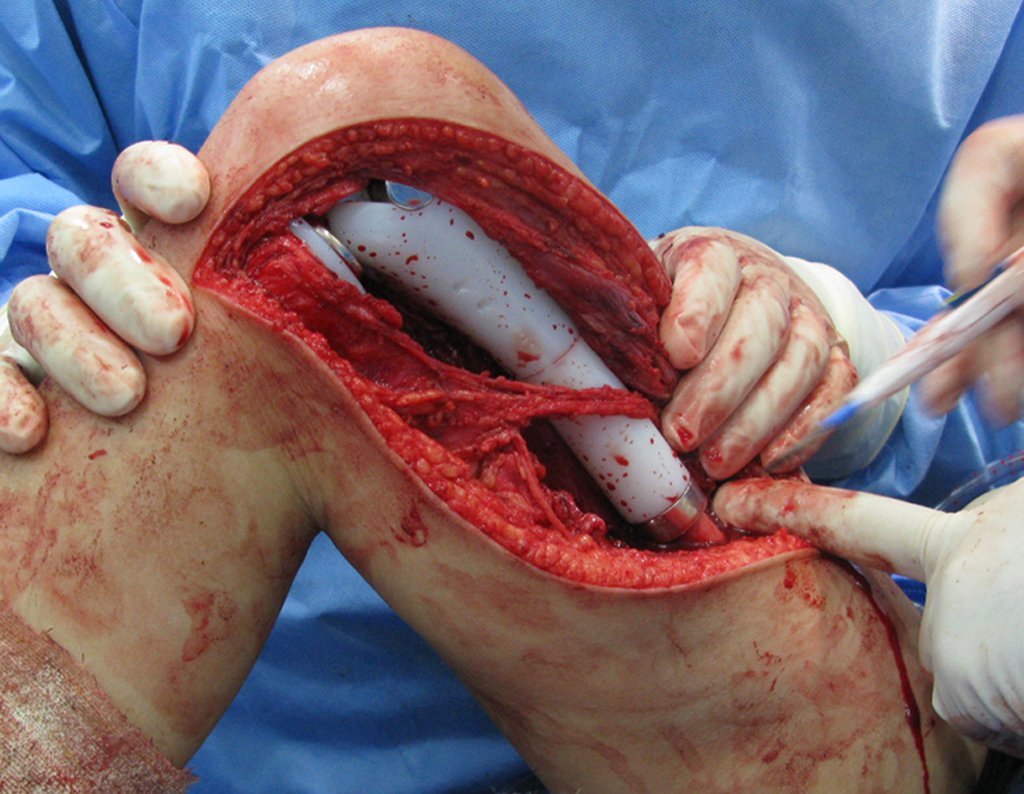
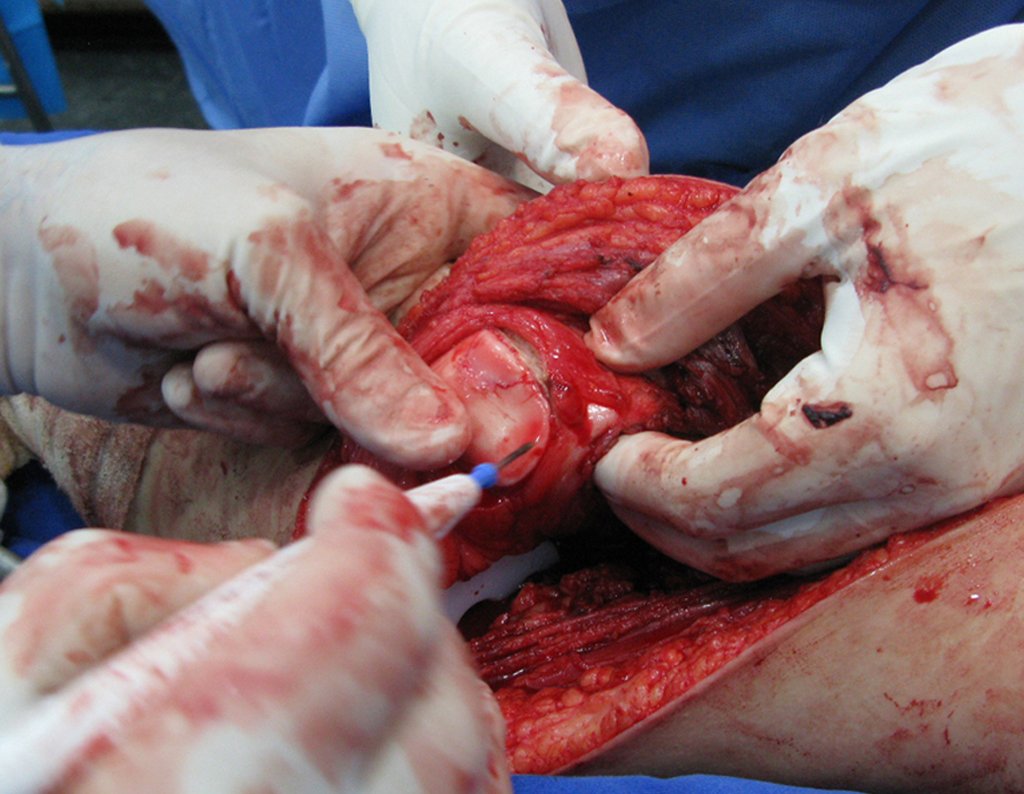
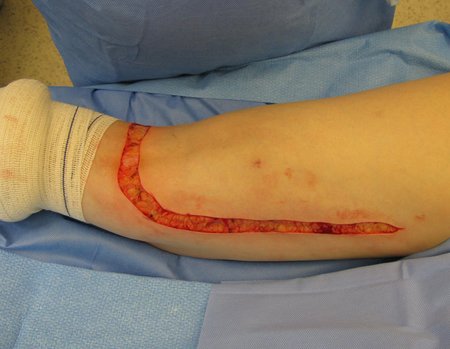
Necesitamos enfatizar que la biopsia debe ser realizada/ monitoreada por el cirujano que realizará la cirugía. Su presencia es imprescindible para que esta se realice de acuerdo con la planificación quirúrgica.
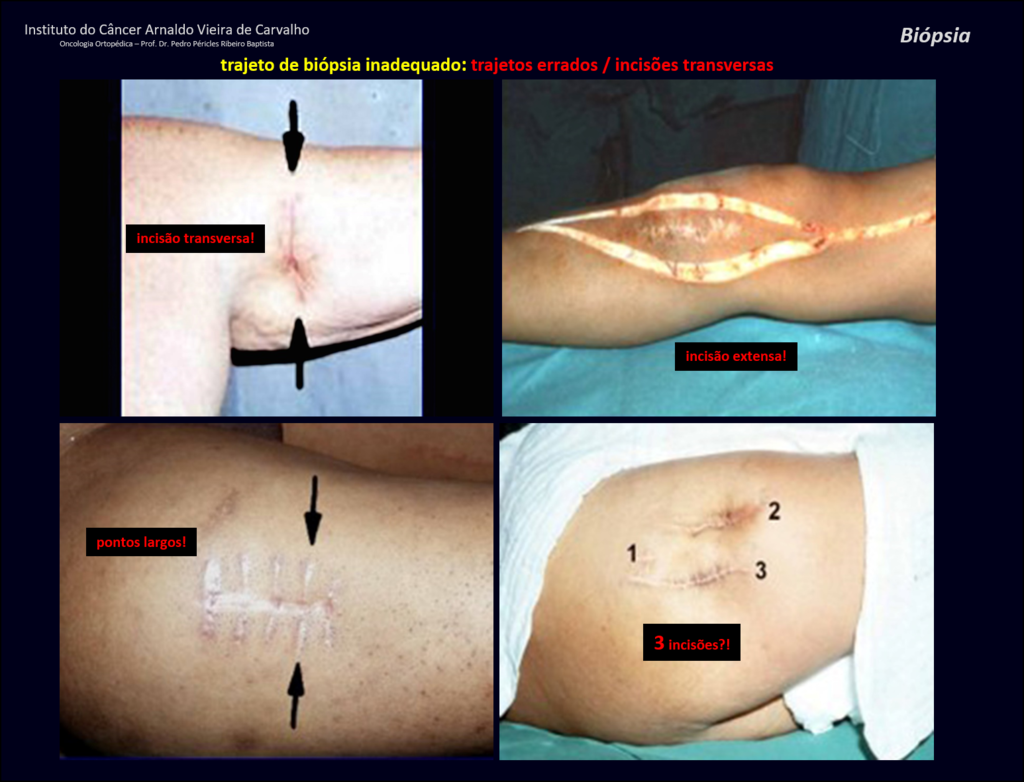
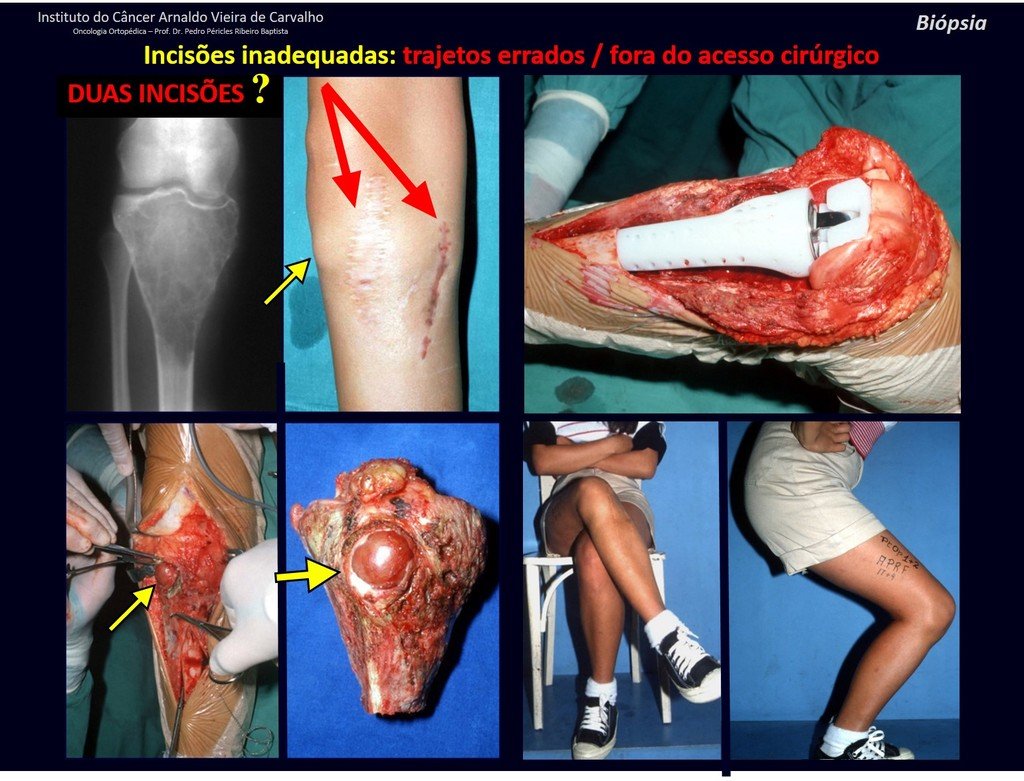
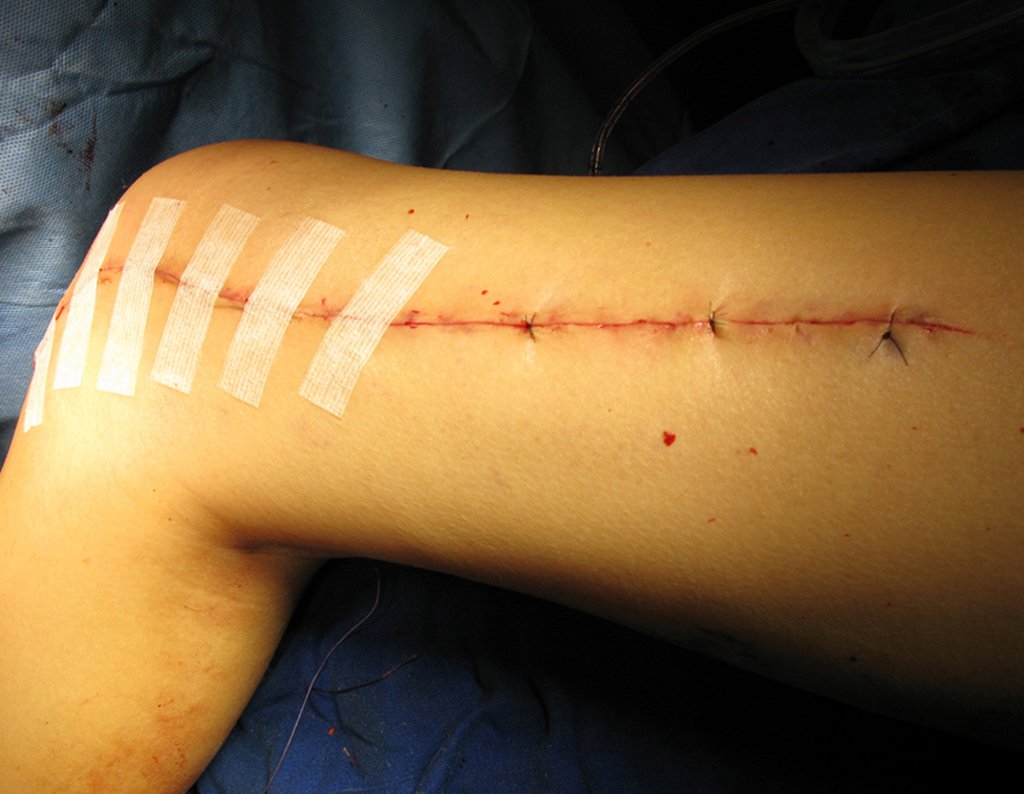
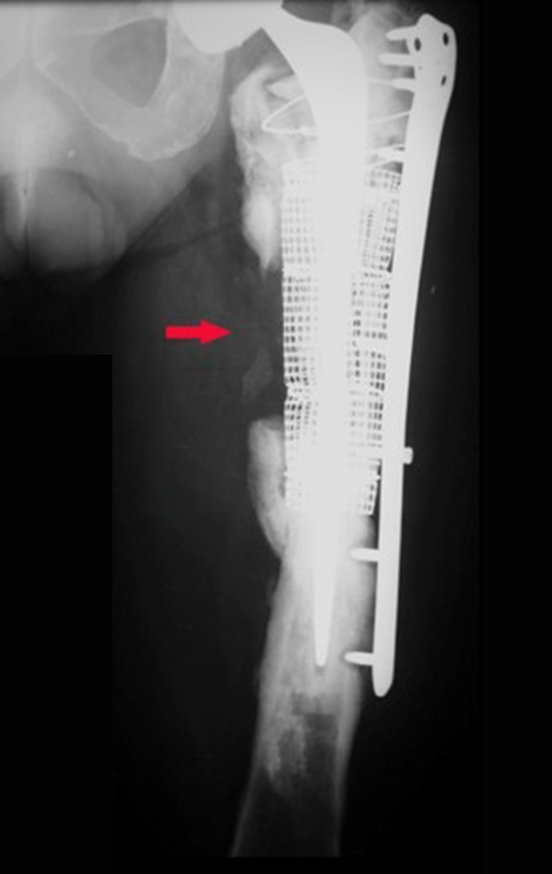
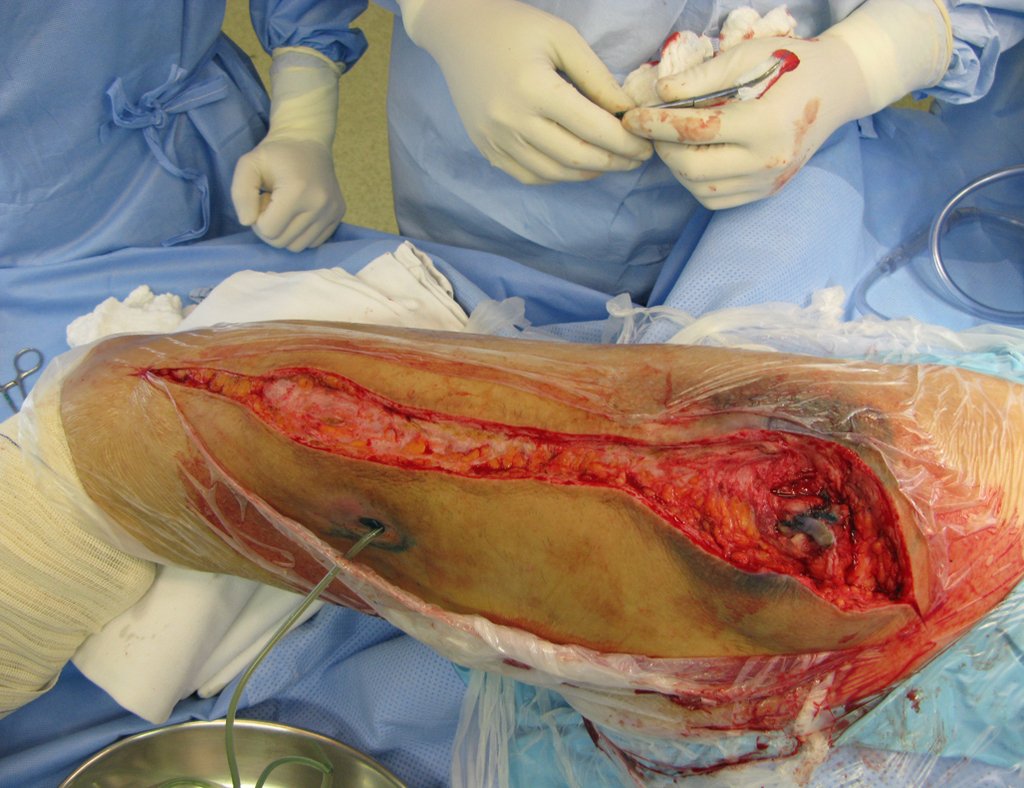
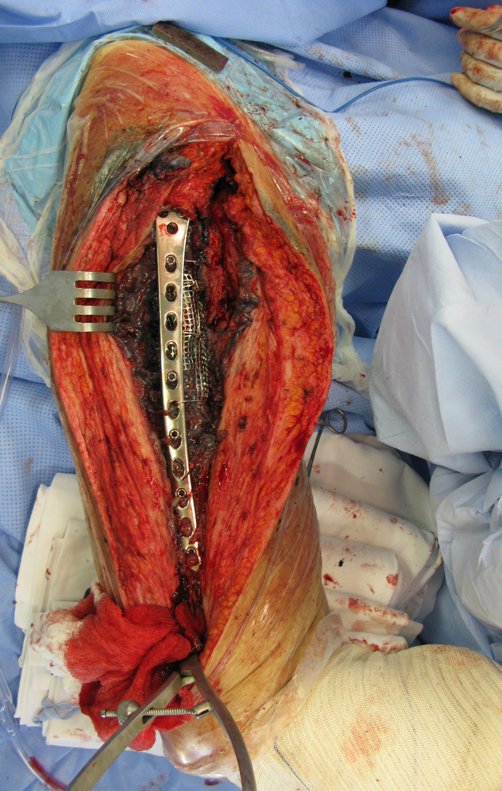
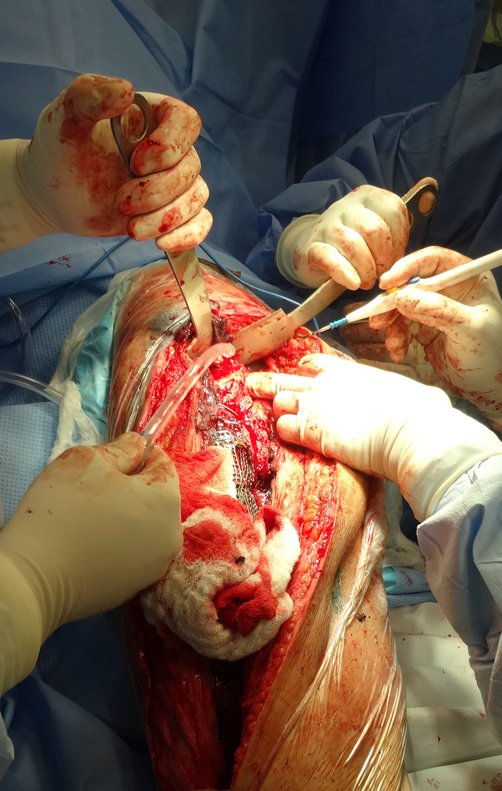
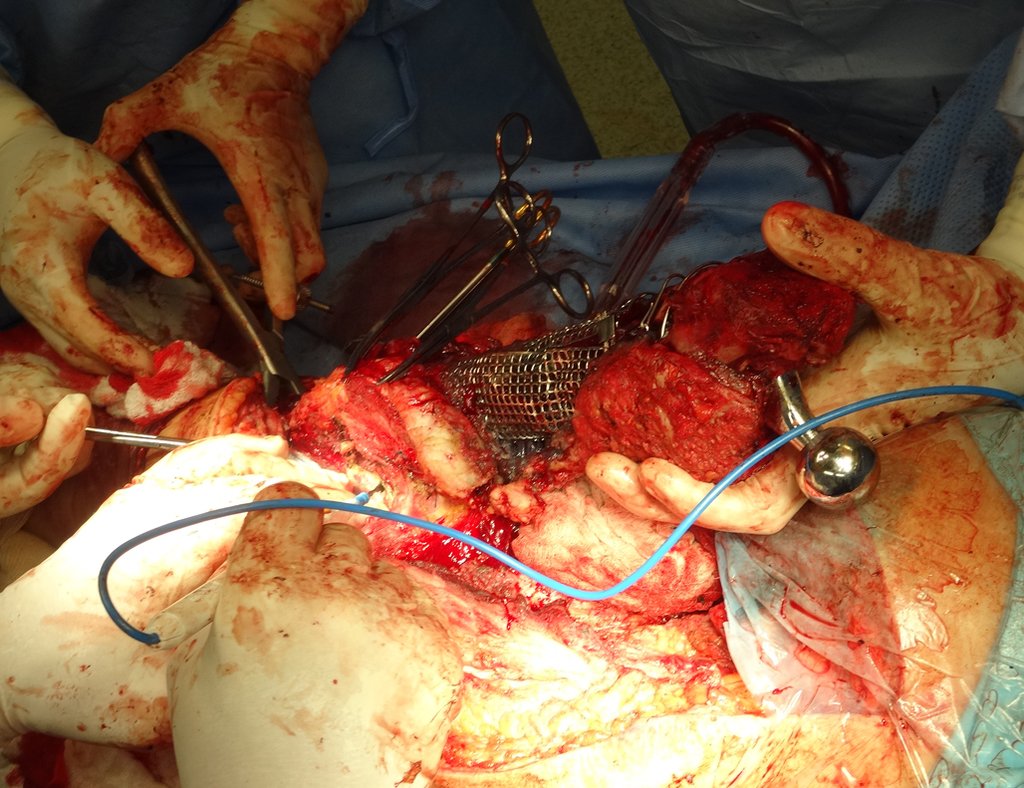
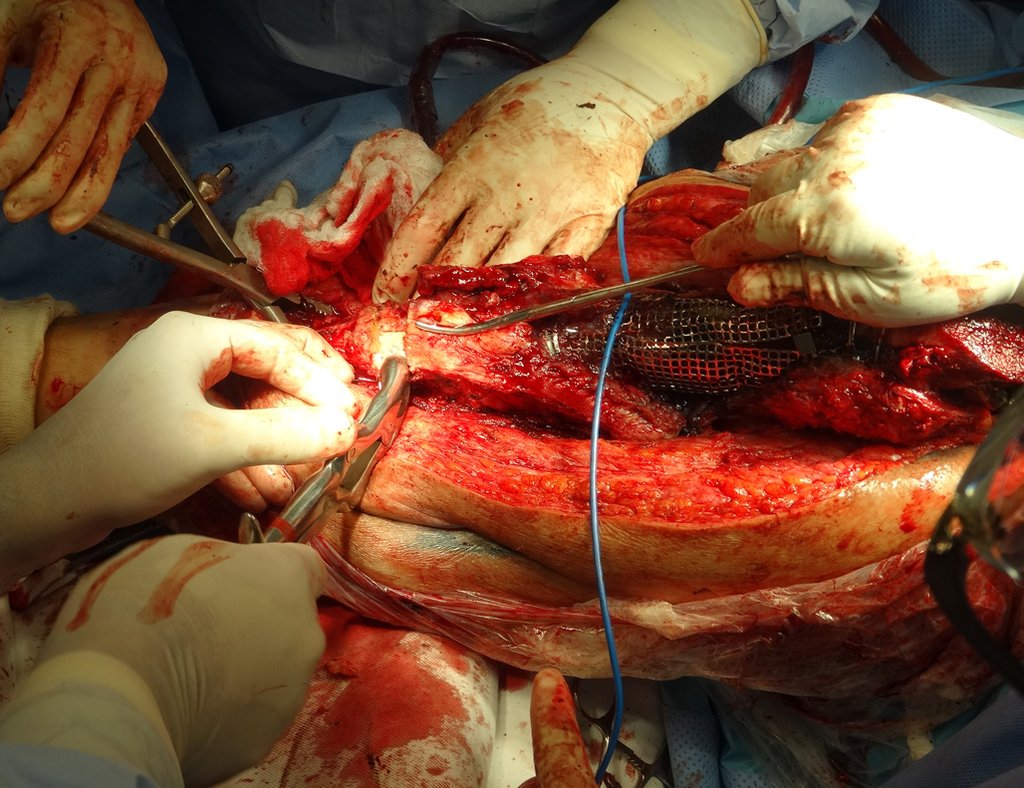
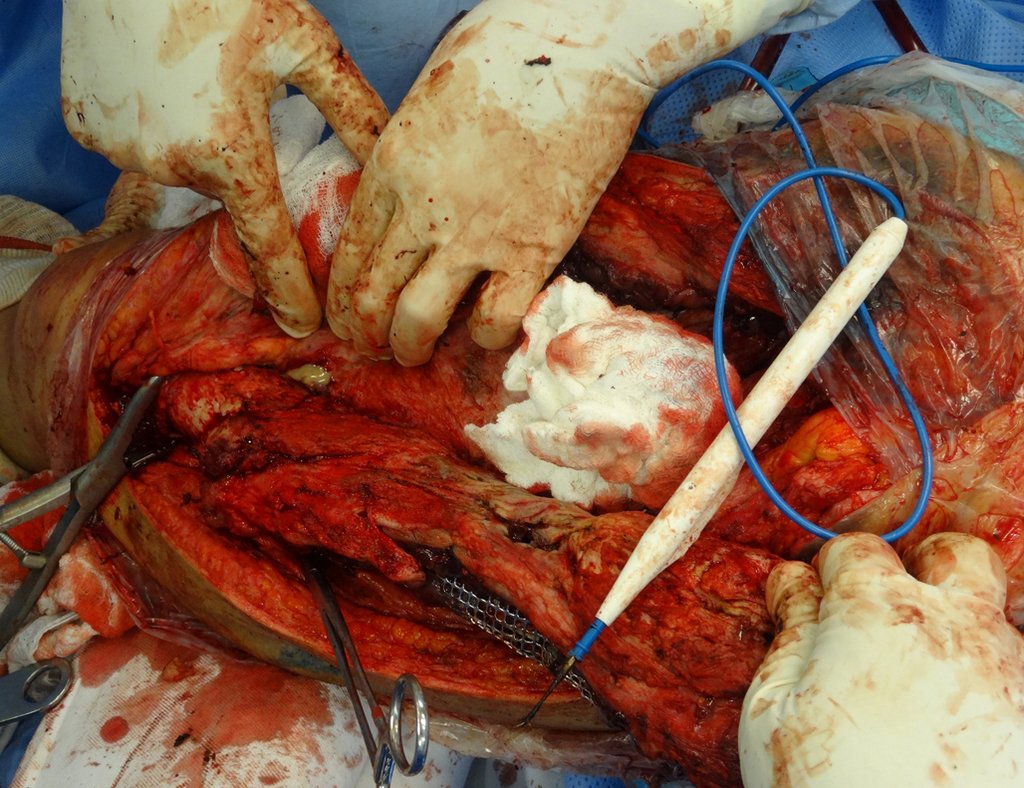
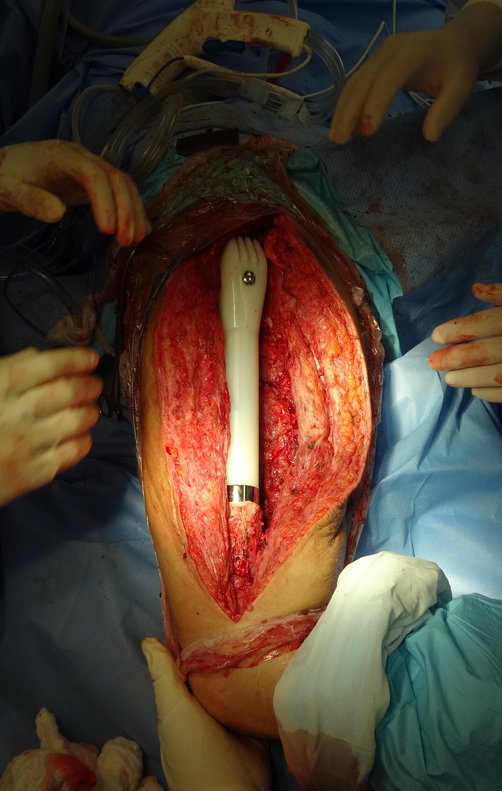
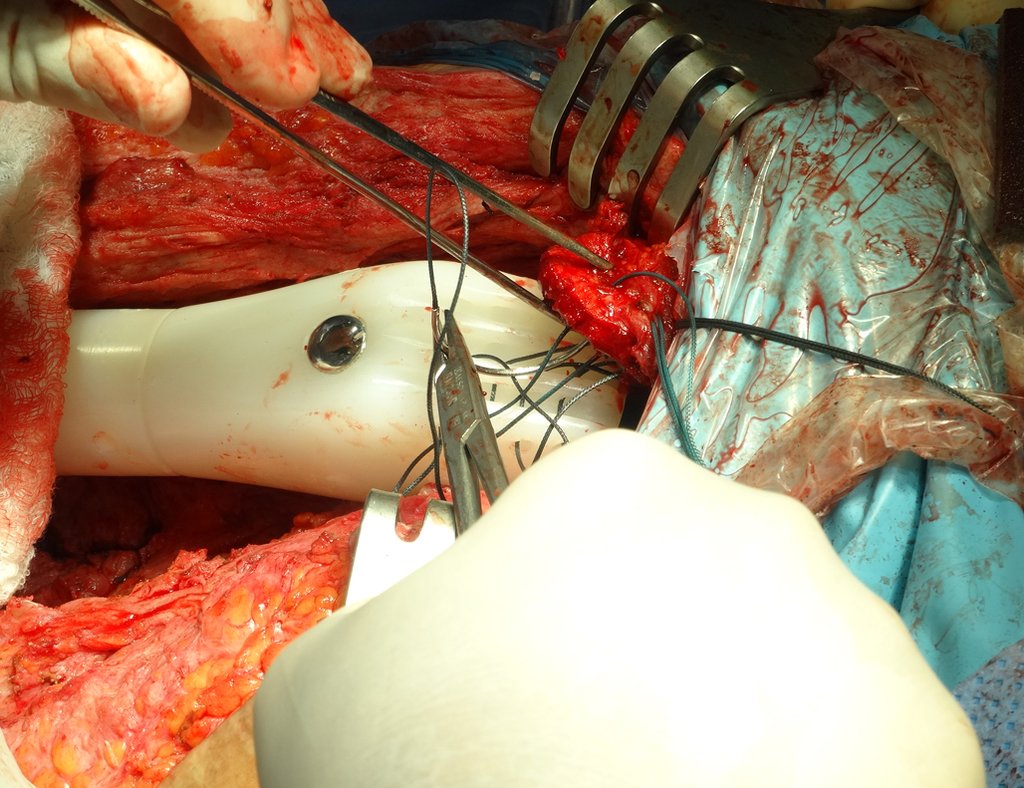
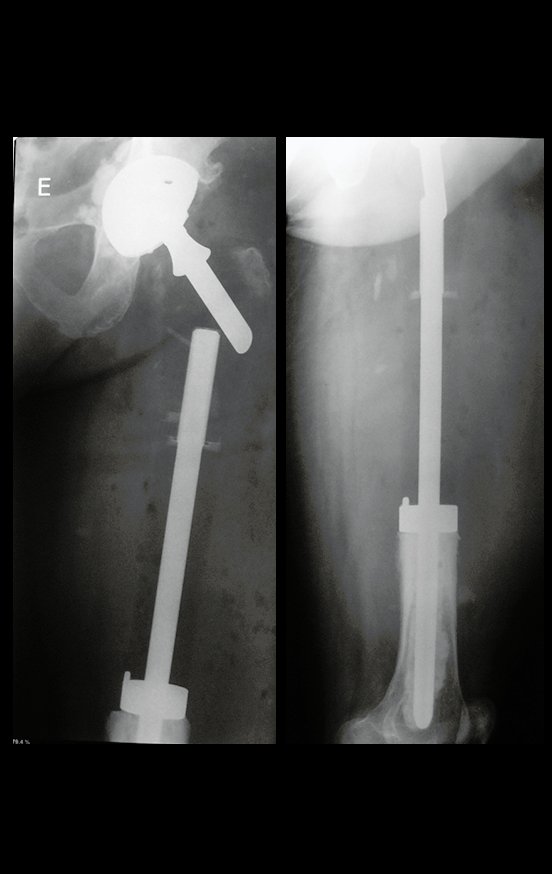
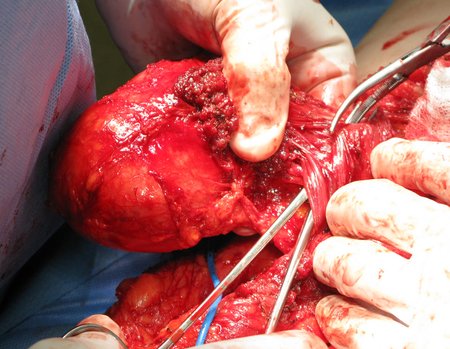
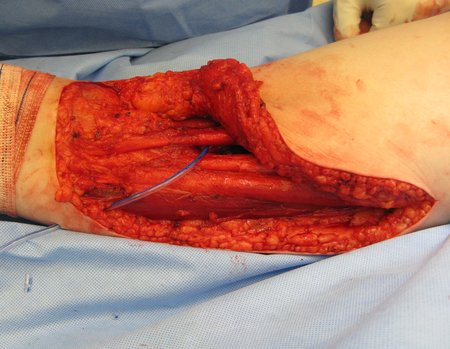
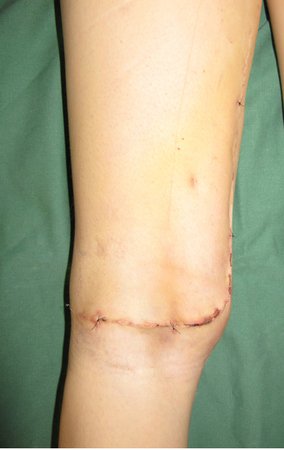
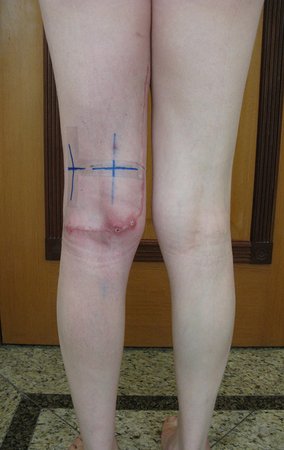
No se deben realizar incisiones transversales, ni incisiones extensas donde no haya musculatura para su posterior cobertura, como en la pierna, por ejemplo. La sutura no debe tener puntos alejados de la incisión, ya que esto requerirá una mayor resección de tejido y mucho menos más de una incisión, figuras 79 (tablas A, B, C y D) y 80.
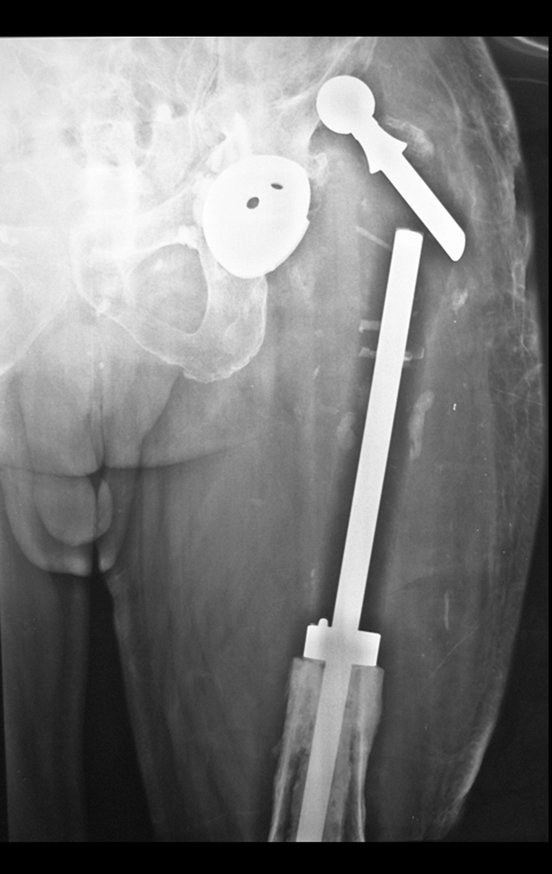
Ver el caso completo de la figura 80 en: http://tgc-prótese intraepifisária
Ver el caso completo en la figura 82 en: http://pelvectomía interna
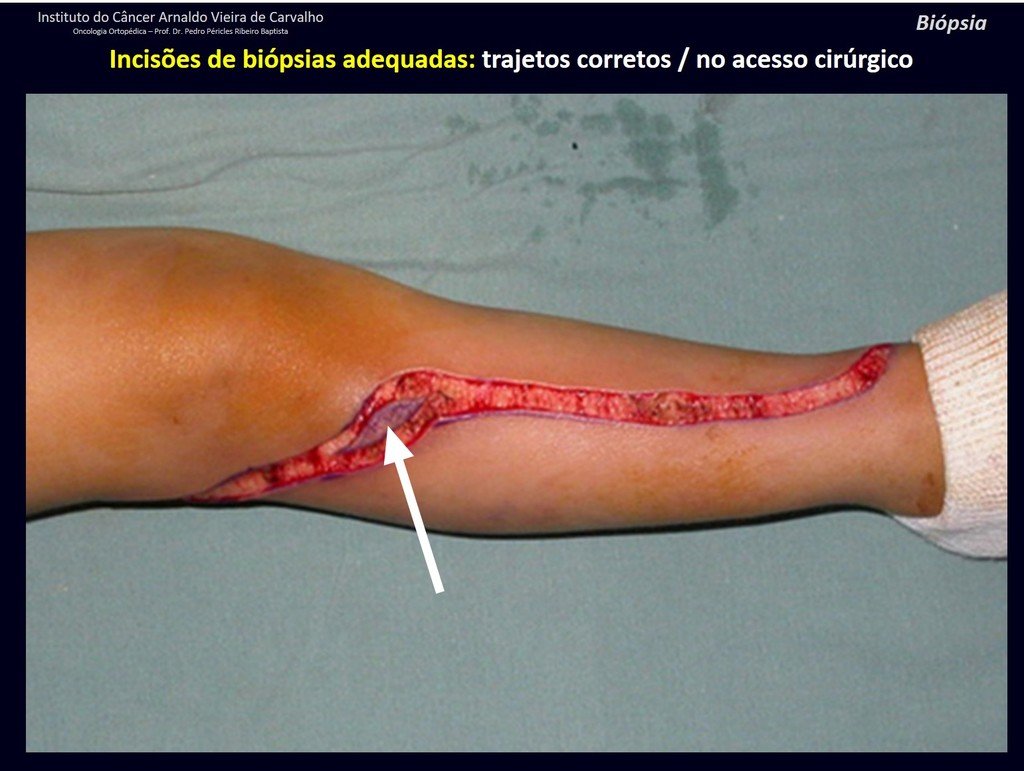
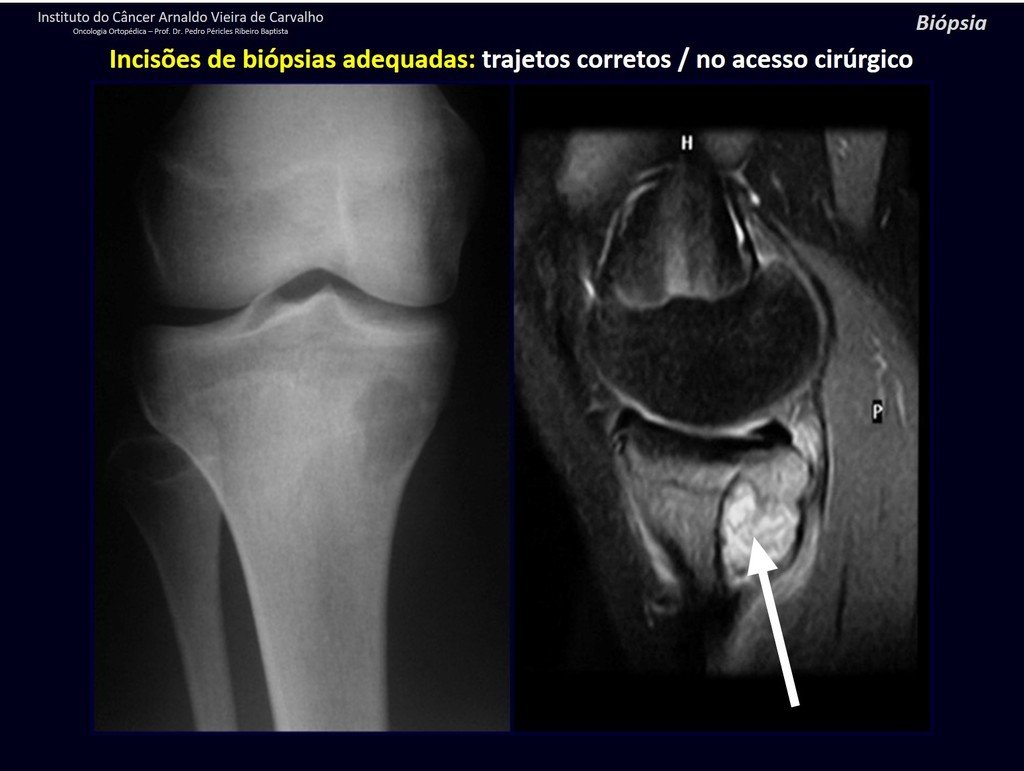
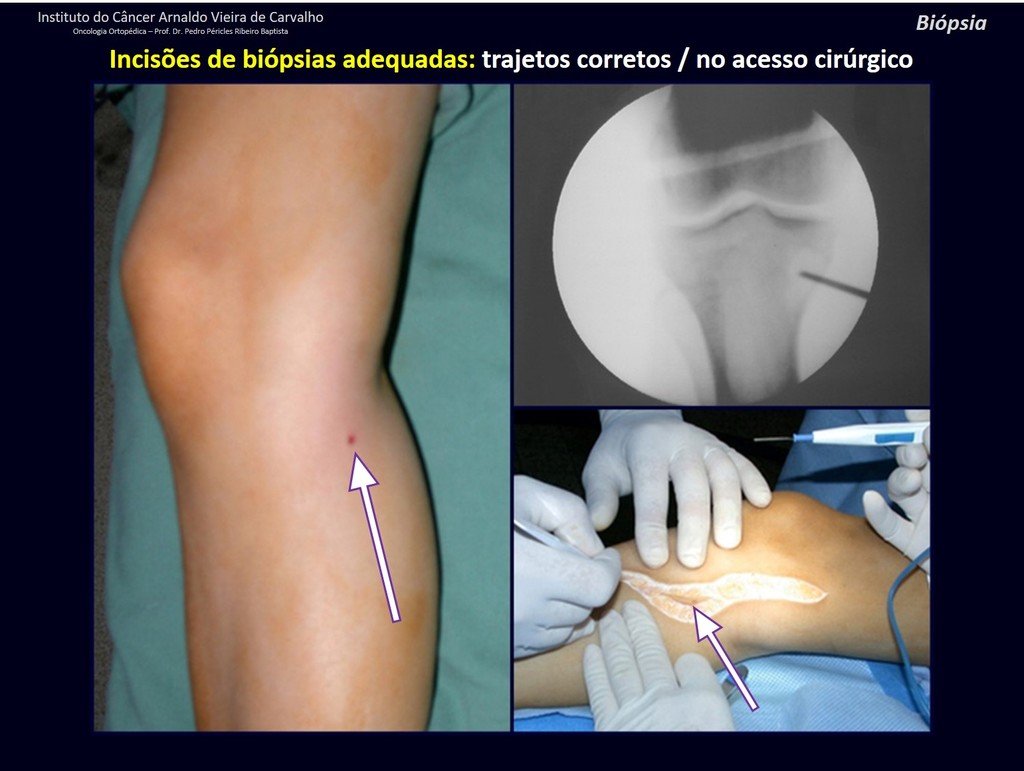
A continuación ejemplificamos dos casos de biopsias realizadas correctamente, figuras 83 a 86.
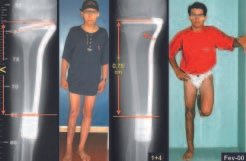
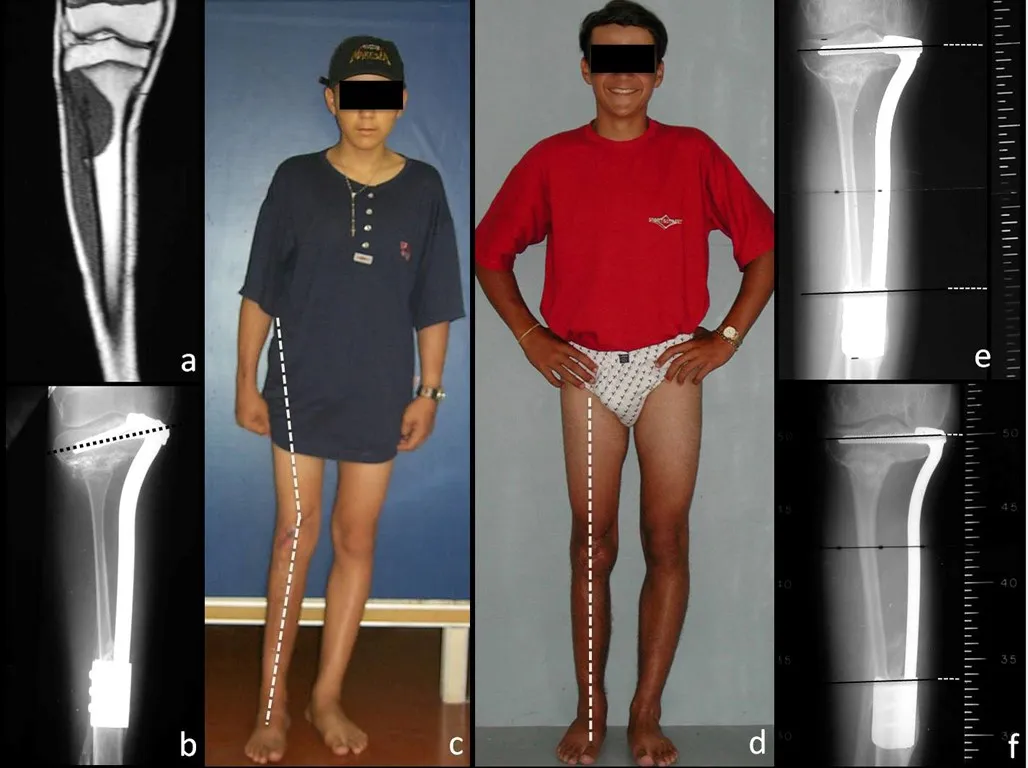
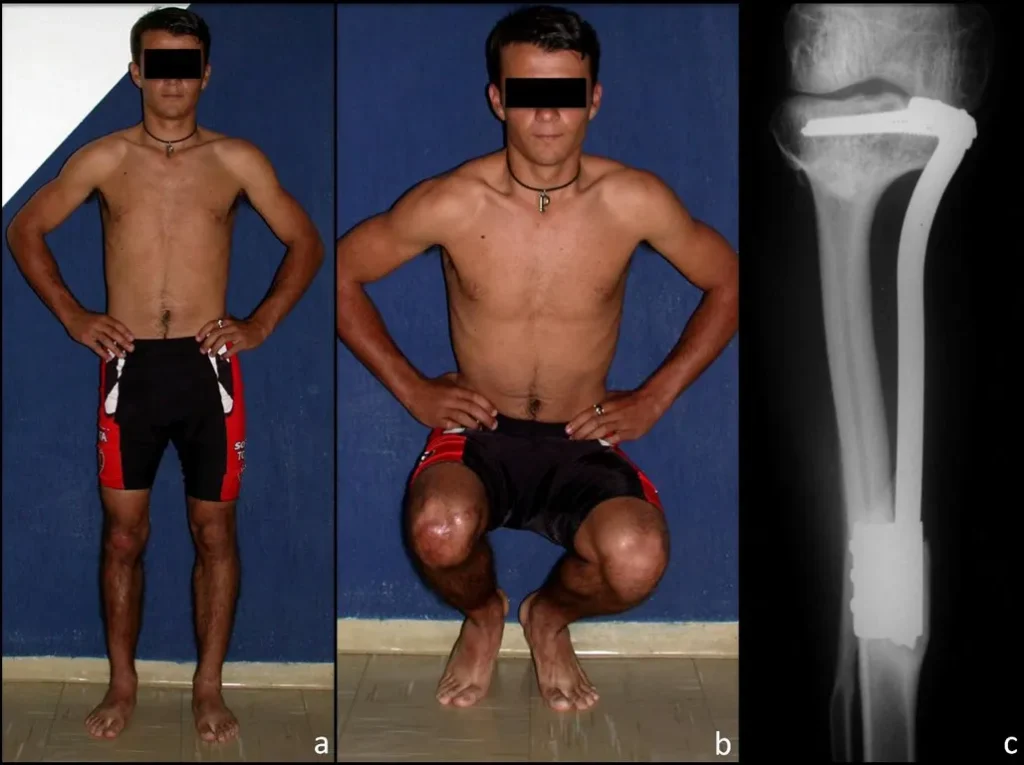
*Ver el caso completo de las figuras 83 y 84 en: http://trasplante de cartílago de crecimiento
*Ver el caso completo de las figuras 85 y 86 en: http://prótesis rotacional parcial
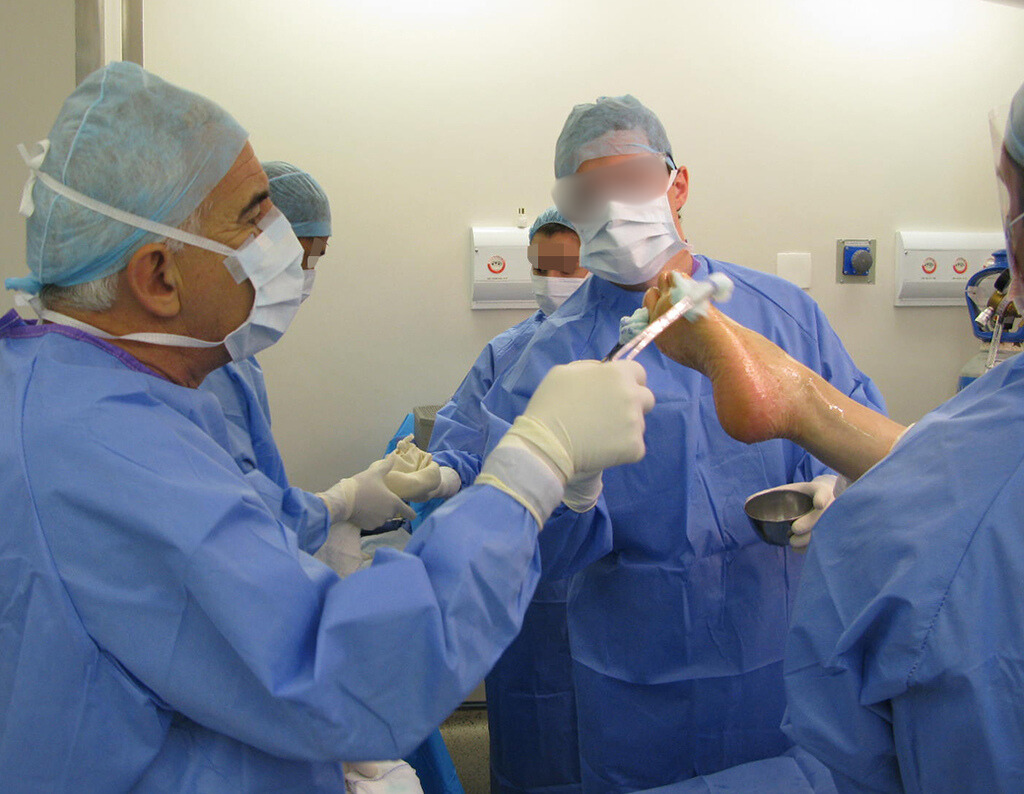
PLANIFICACIÓN Y EJECUCIÓN DE BIOPSIAS : CONSIDERACIONES – CÓMO REALIZAR
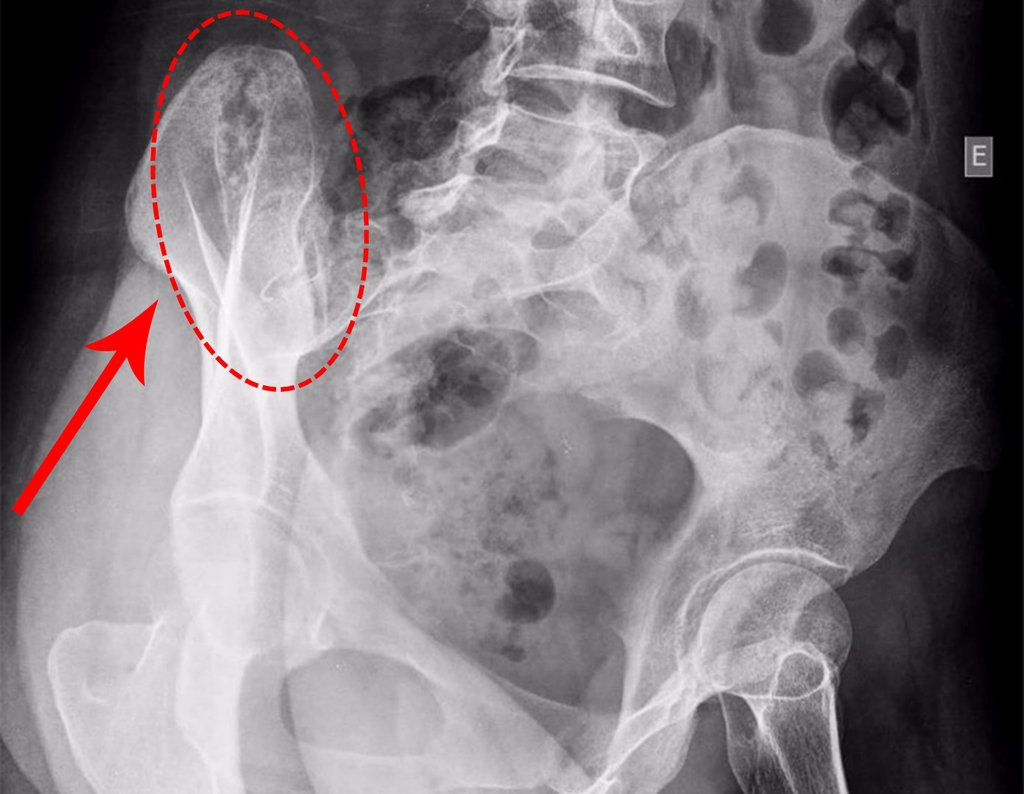
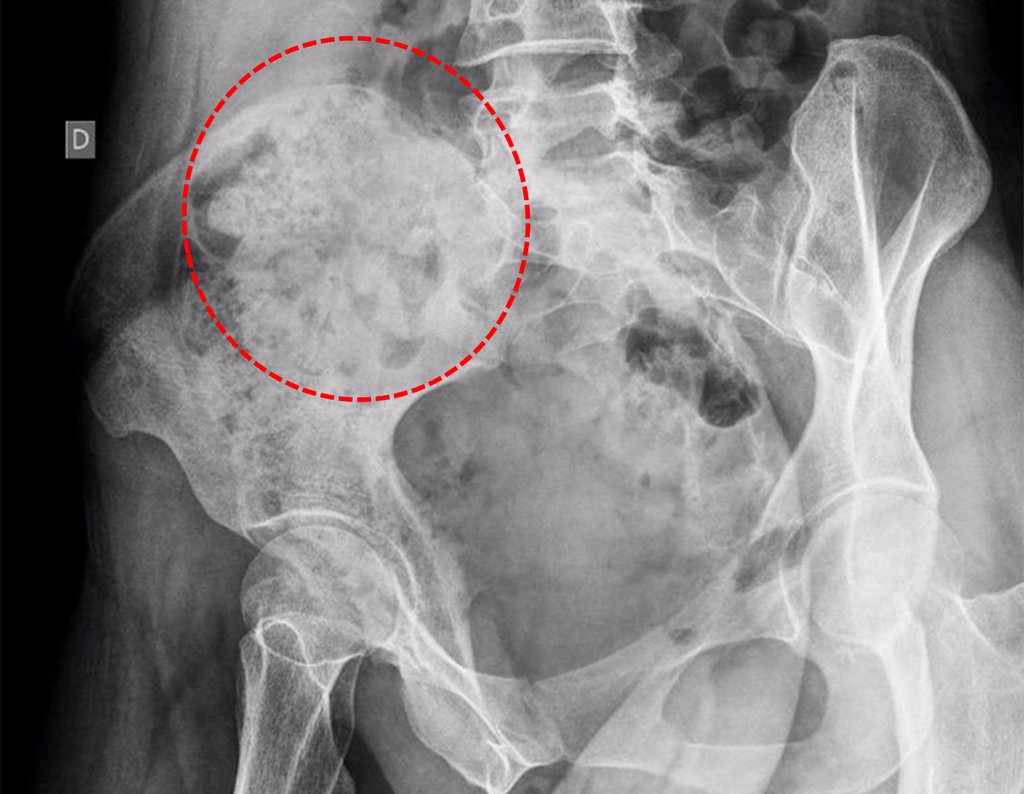
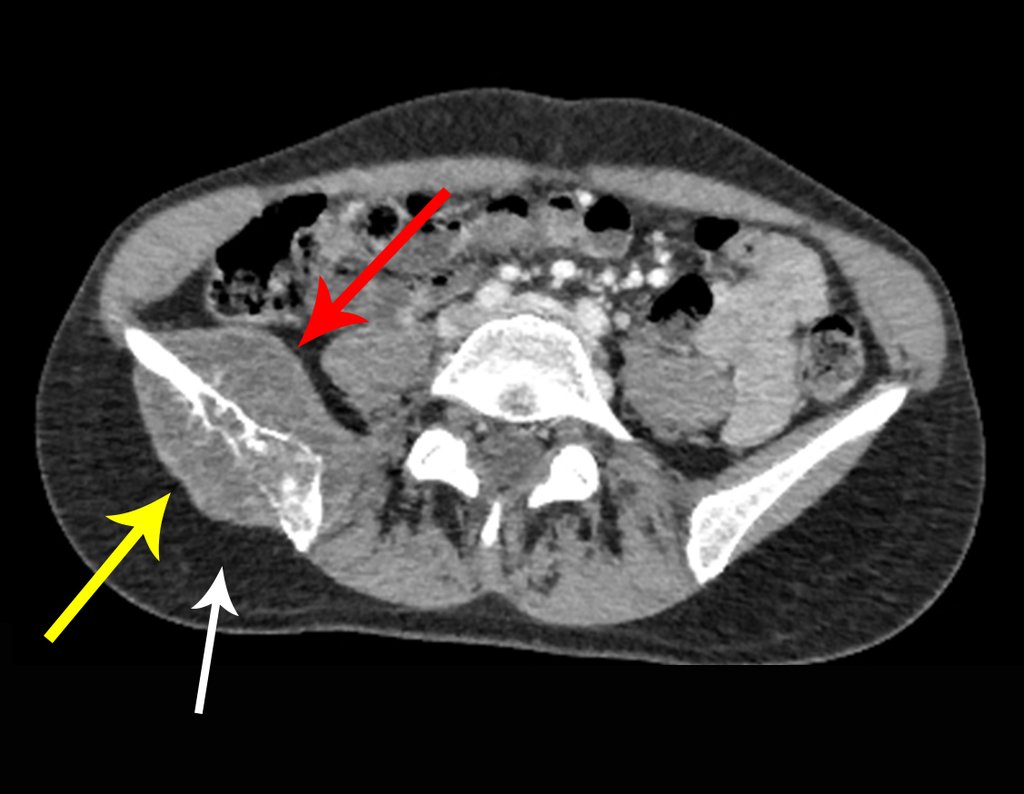
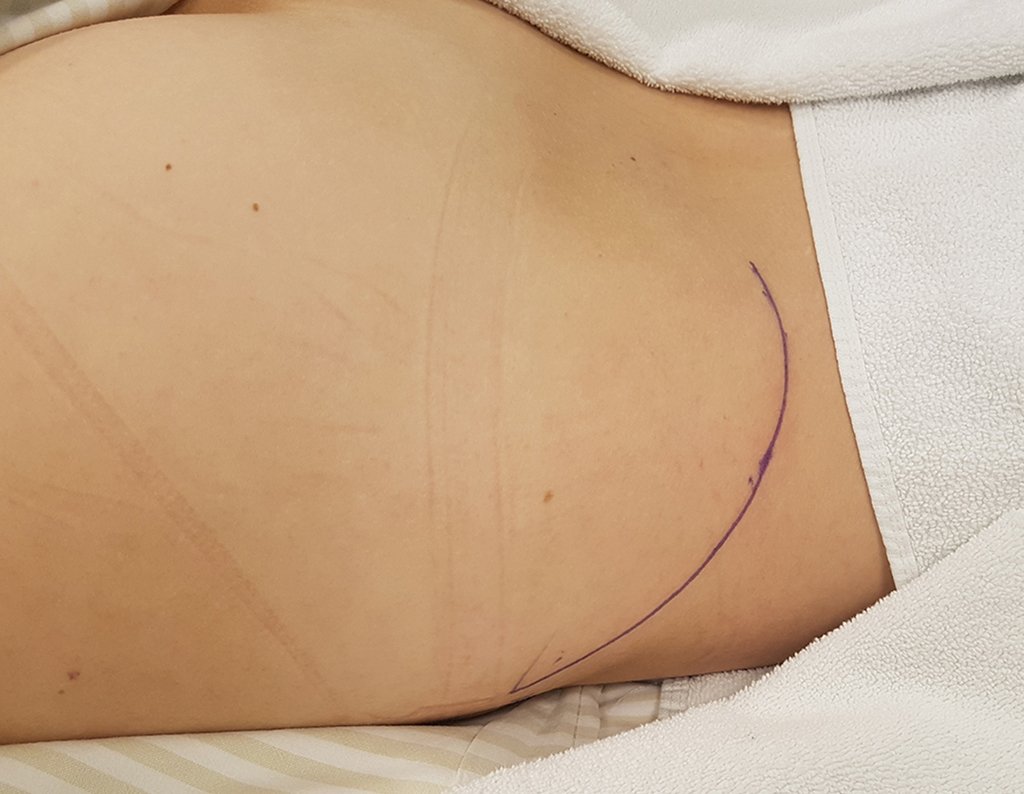
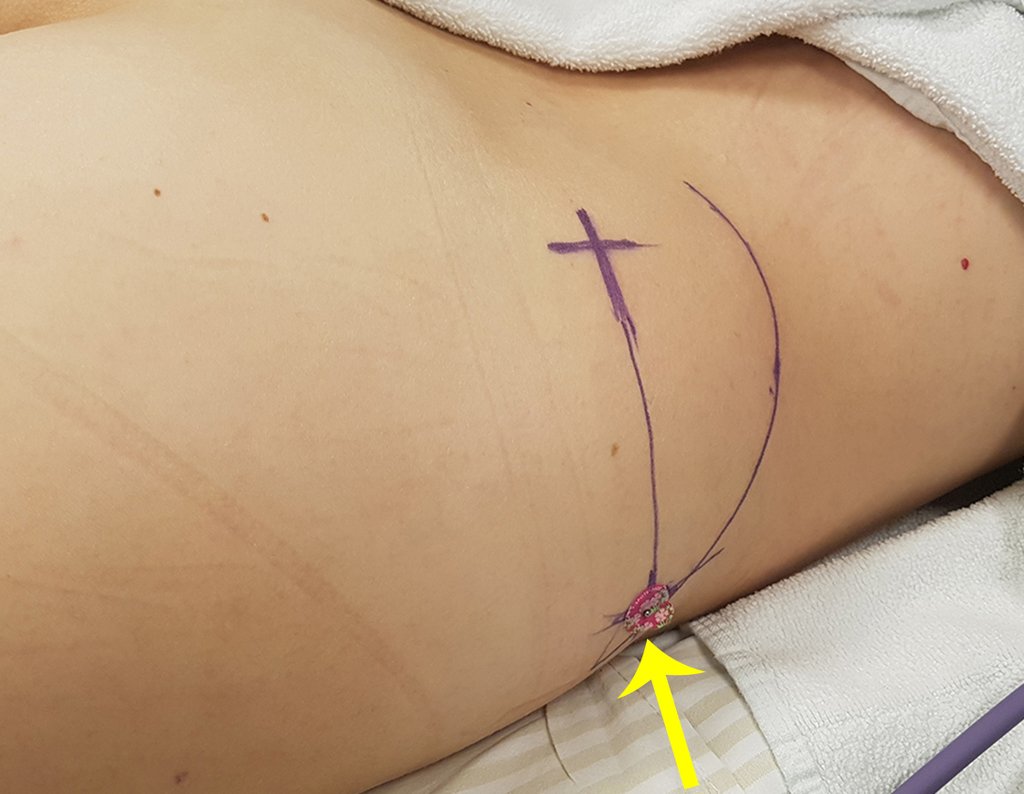
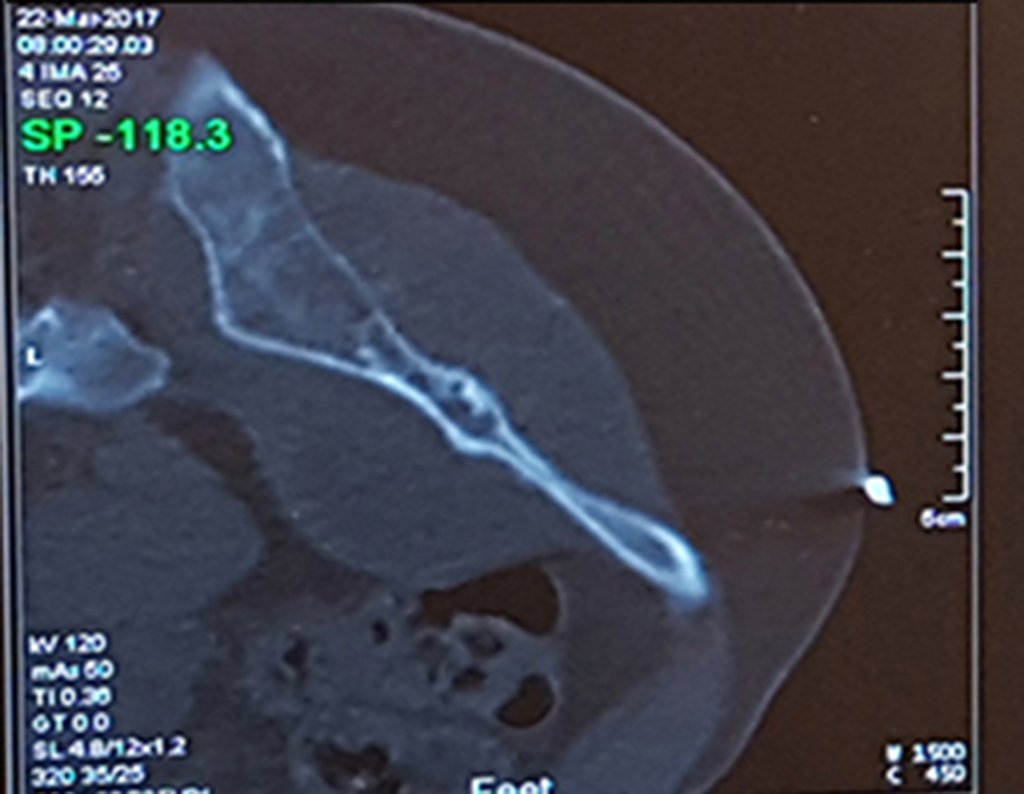
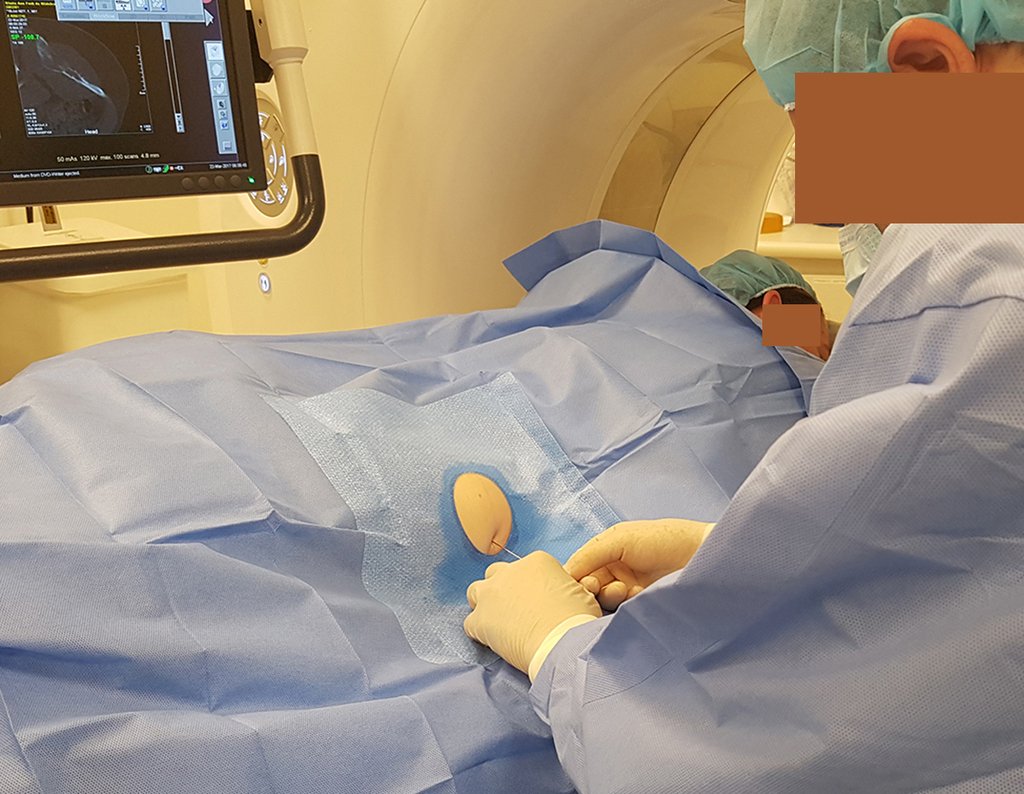
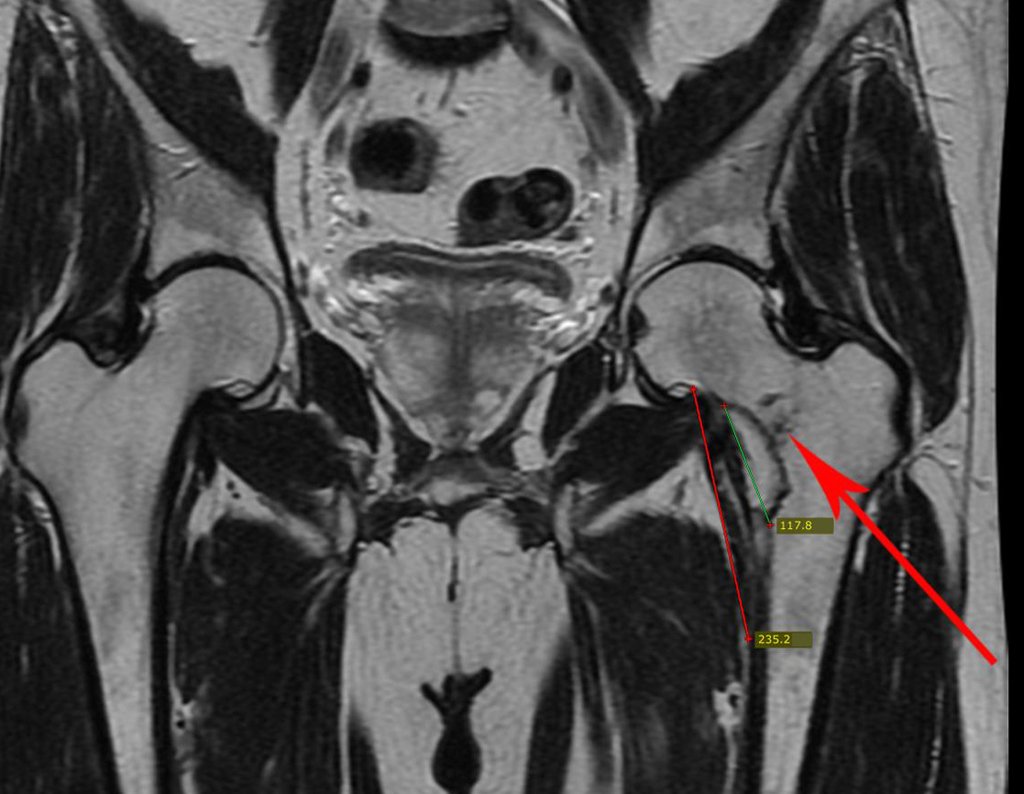
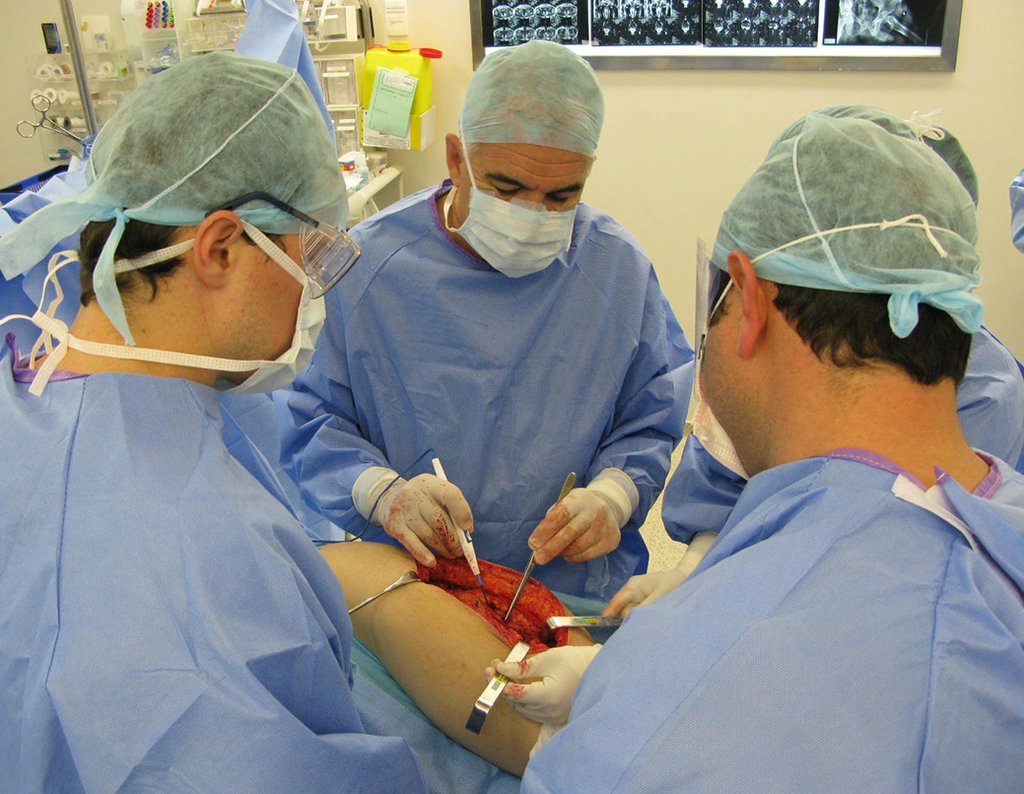
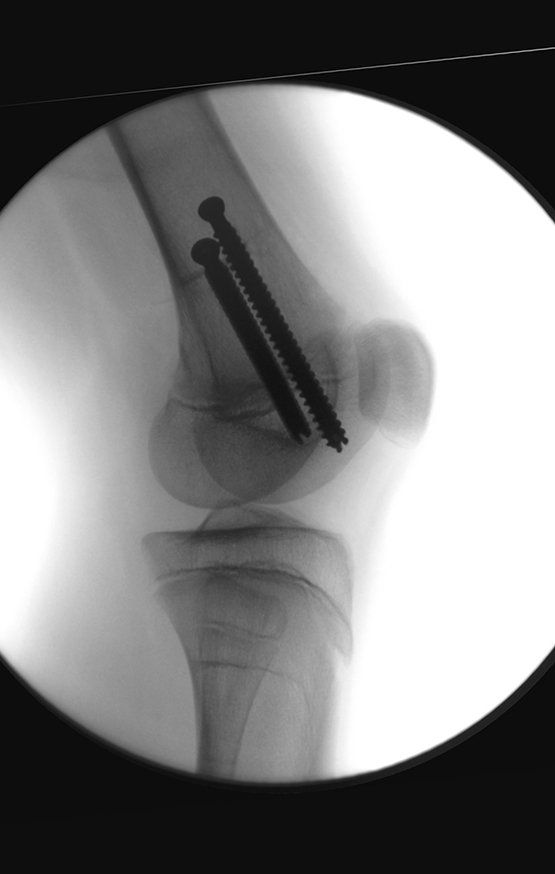
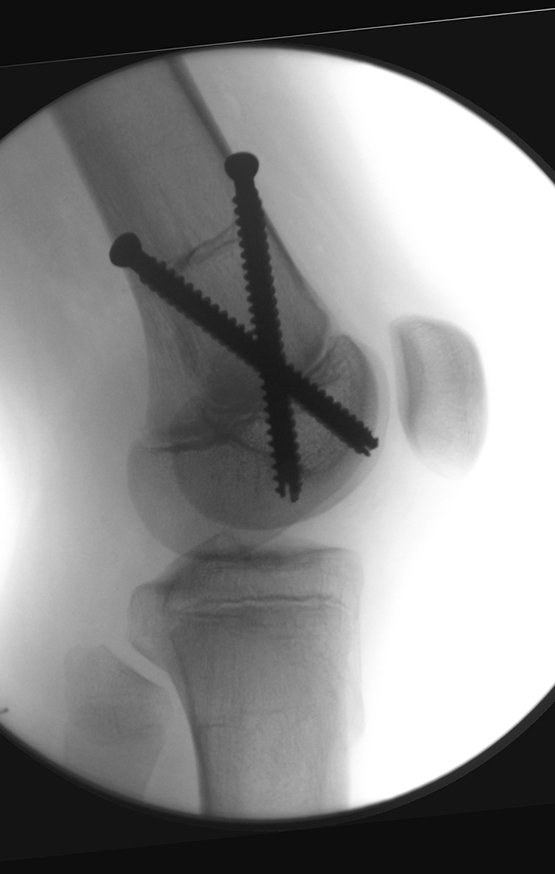
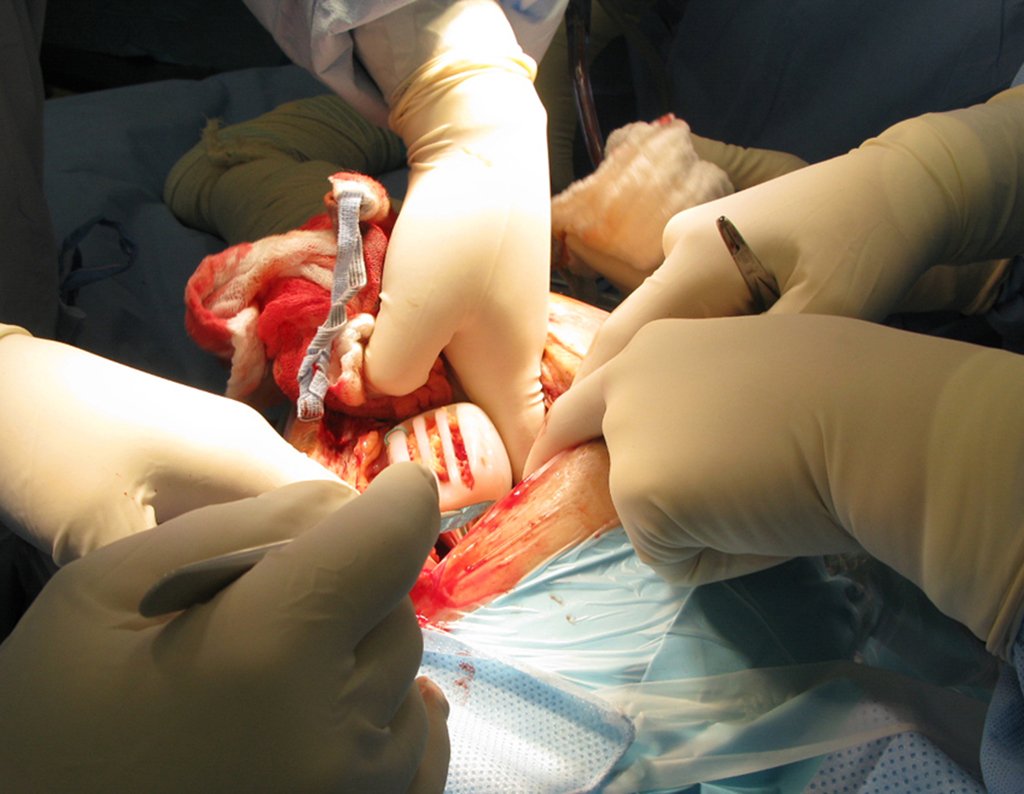
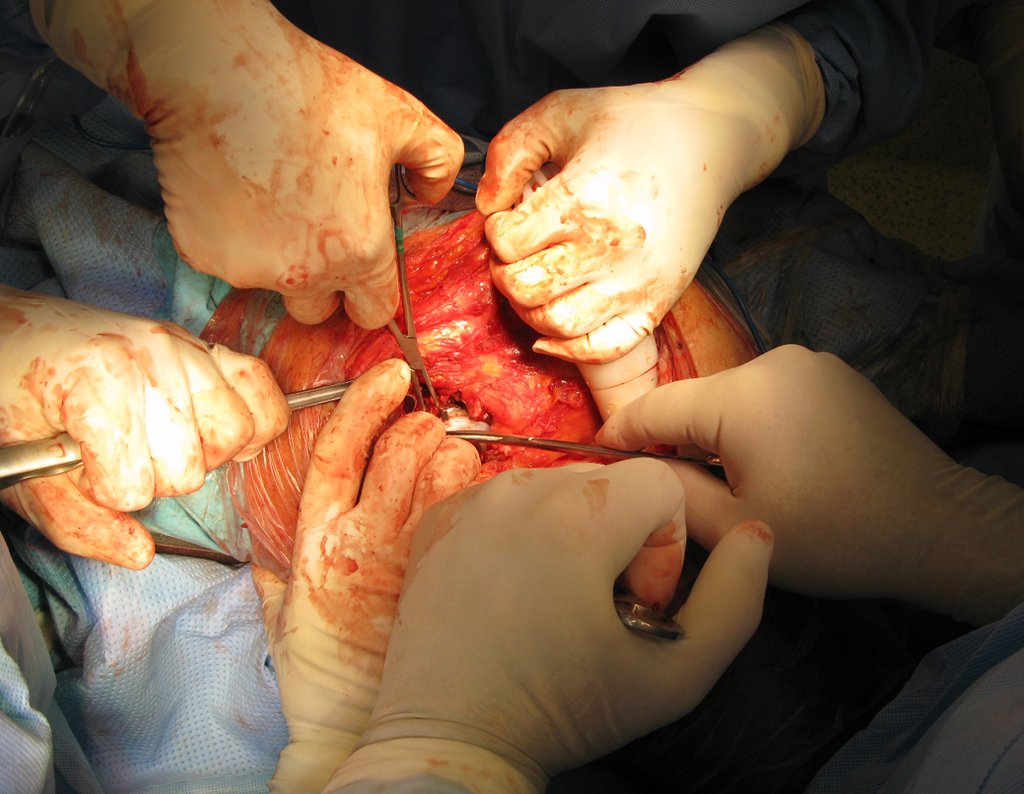
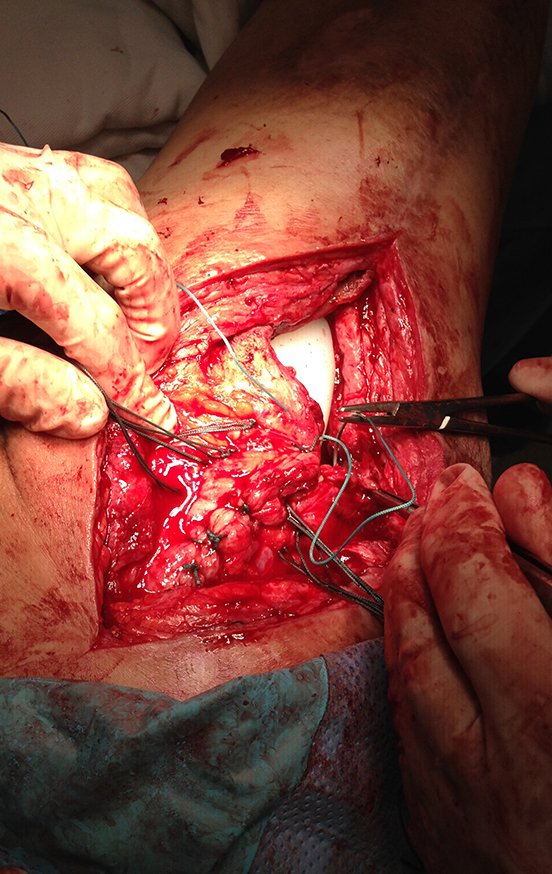
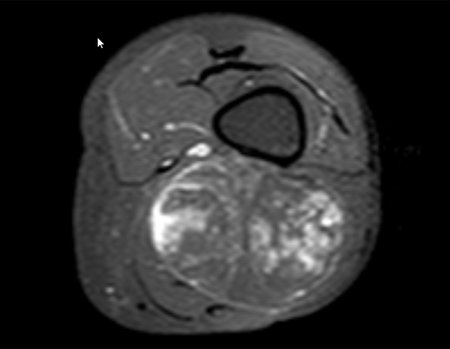
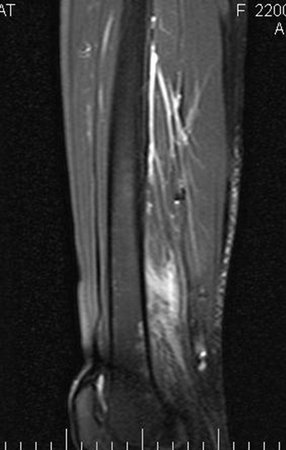
Caso 1 Consideraciones : Describiremos cómo procedimos en esta paciente femenina de 40 años de edad, con dolor en cresta ilíaca posterosuperior derecha de seis meses de evolución, figuras 87 a 116.
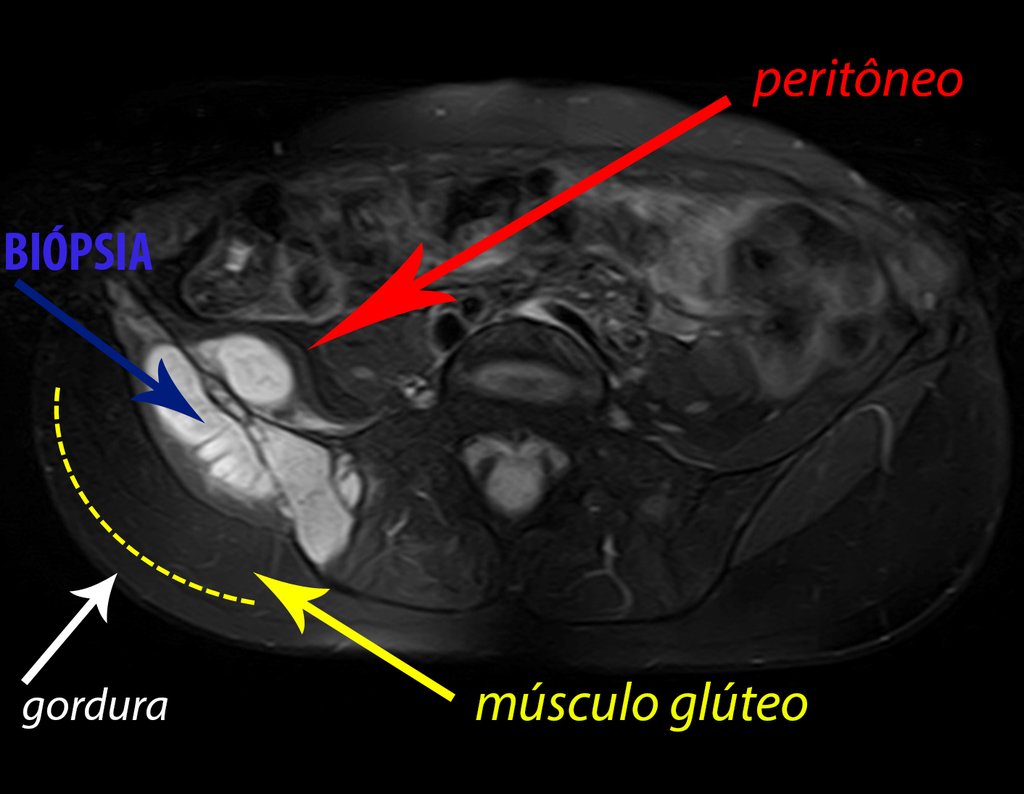
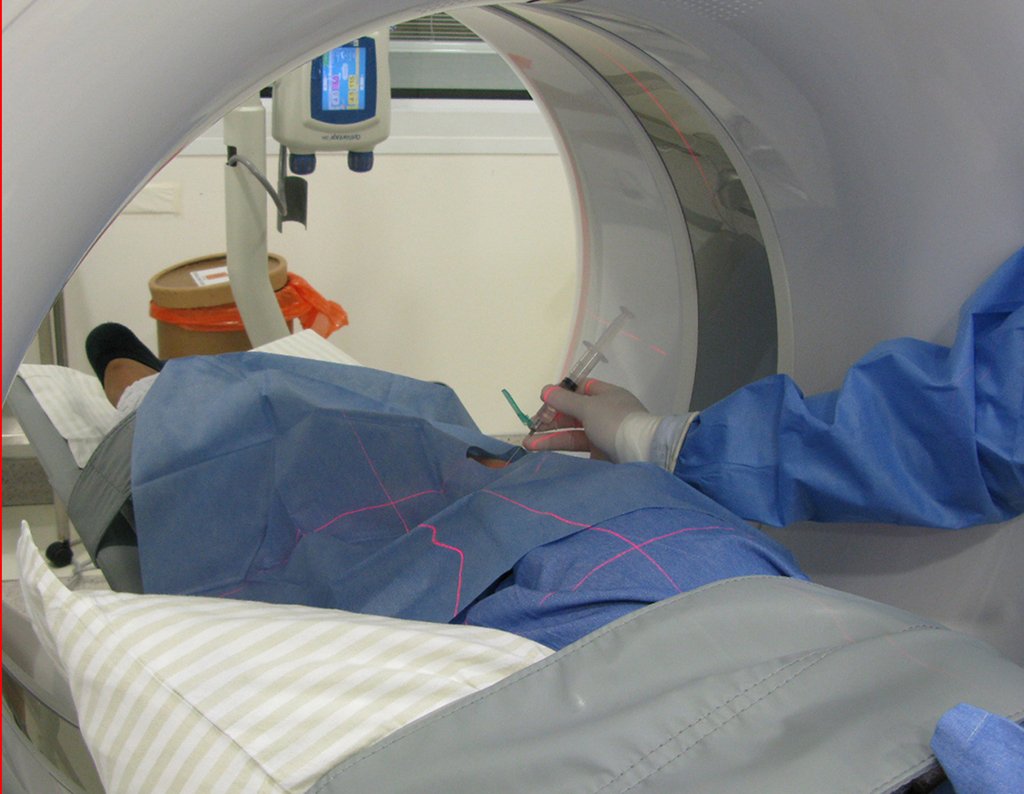
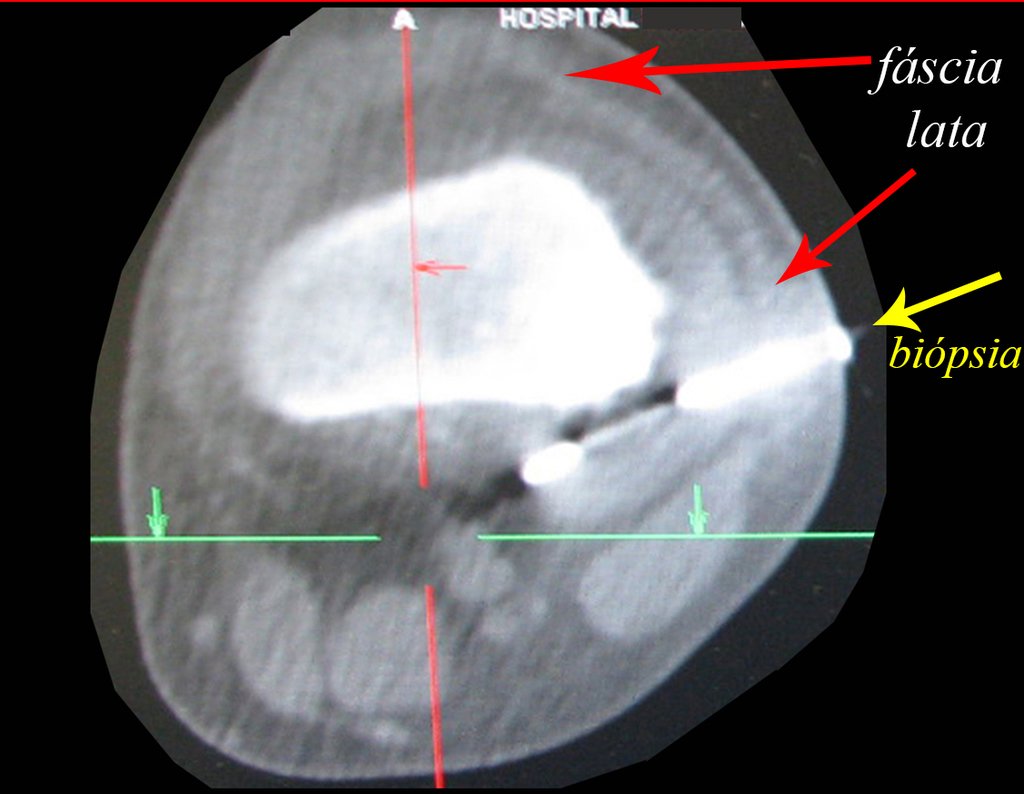
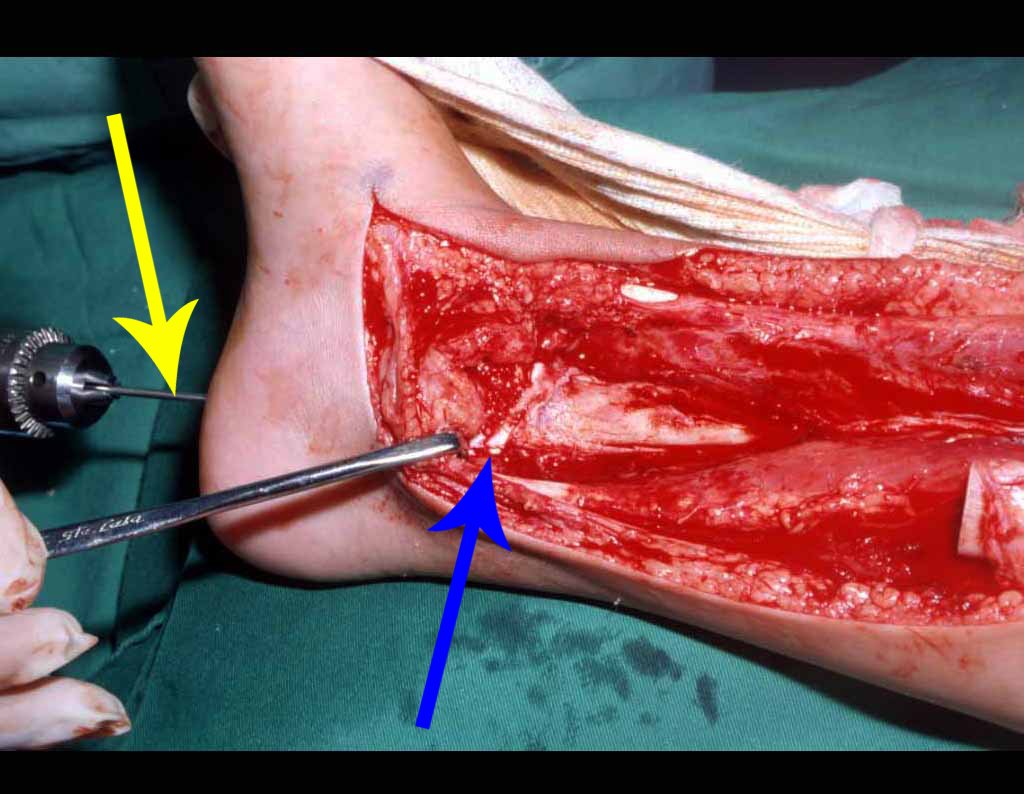
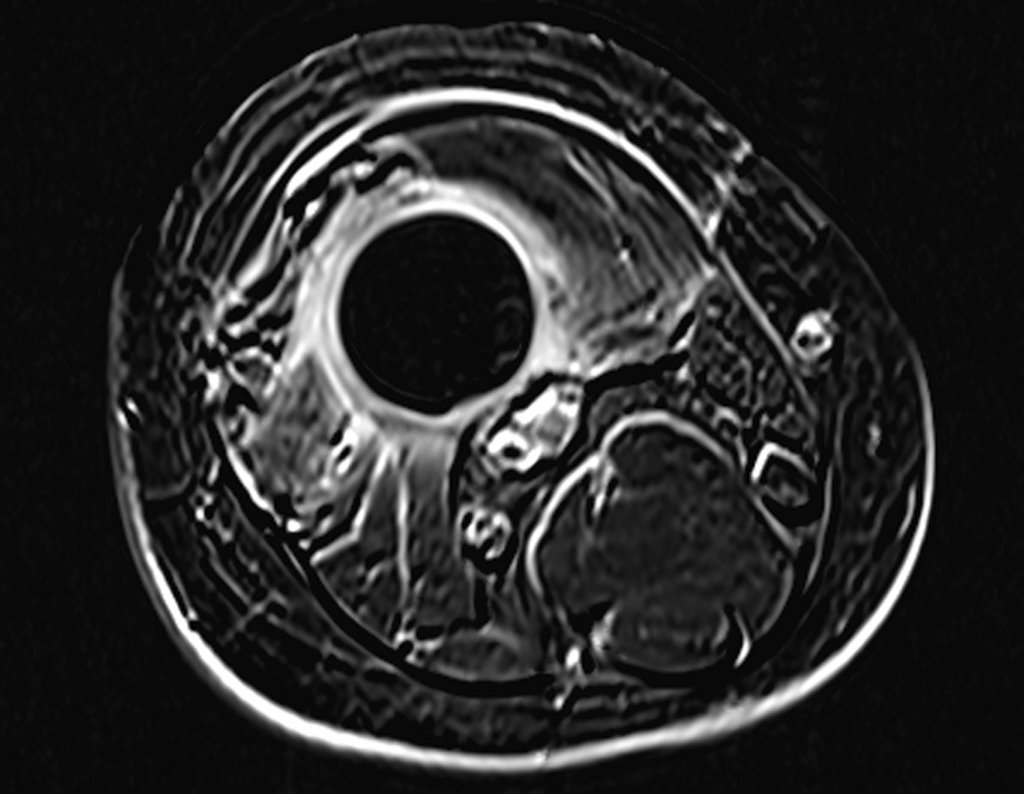
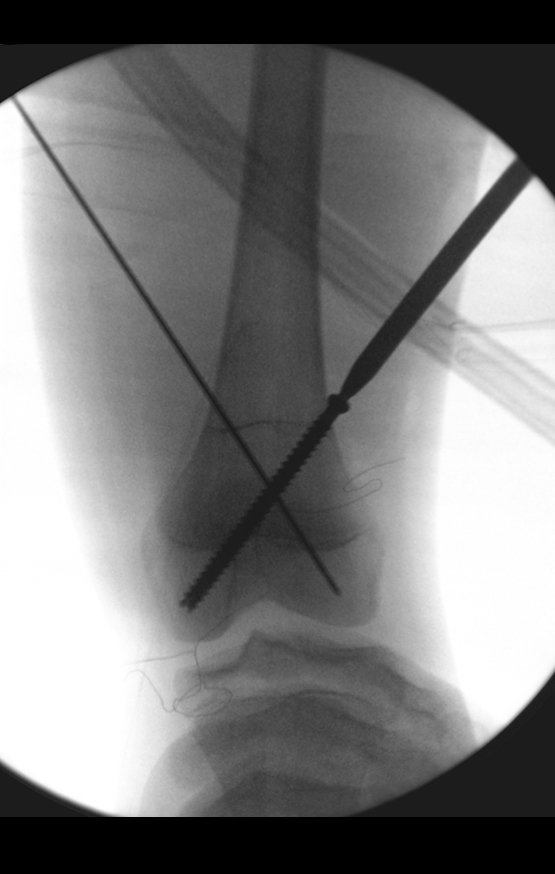
Le expliqué que no debíamos cambiar la dirección de la incisión quirúrgica planificada, ya que esto dificultaría el acceso interno a la pelvis. Se aconseja puncionar en el punto lateral de la cresta, a pesar de la dificultad para angular la aguja, debido a la posición prona. Este procedimiento se describe como ¨biopsia por congelación¨ , figuras 97 a 102.
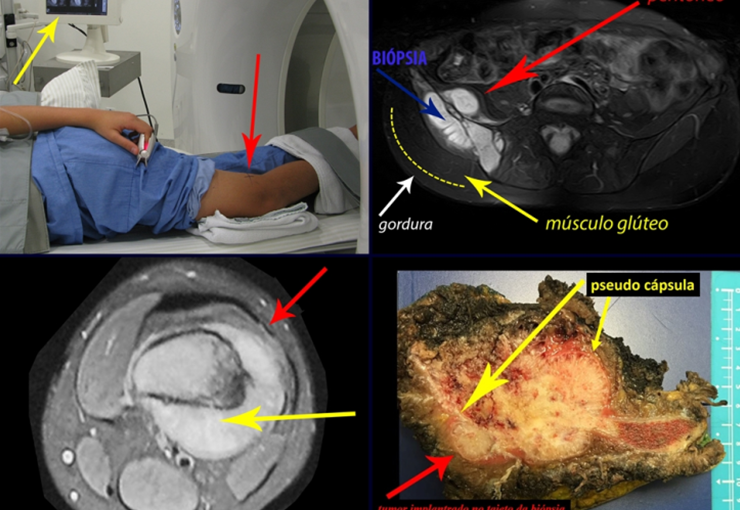
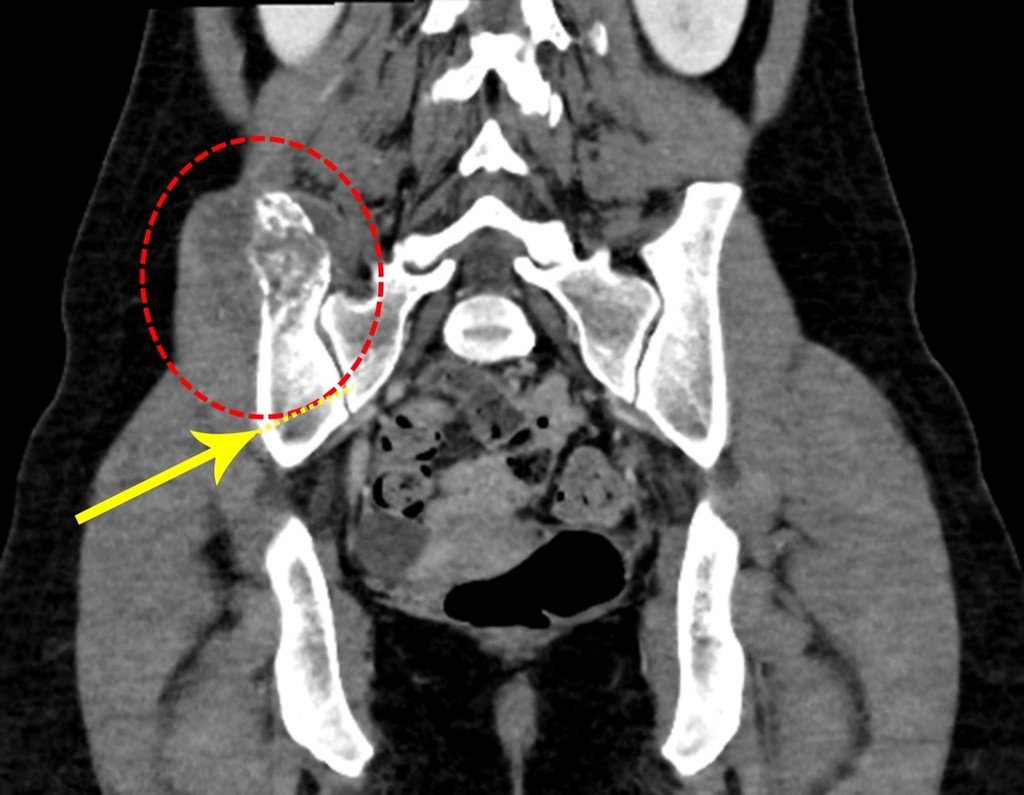
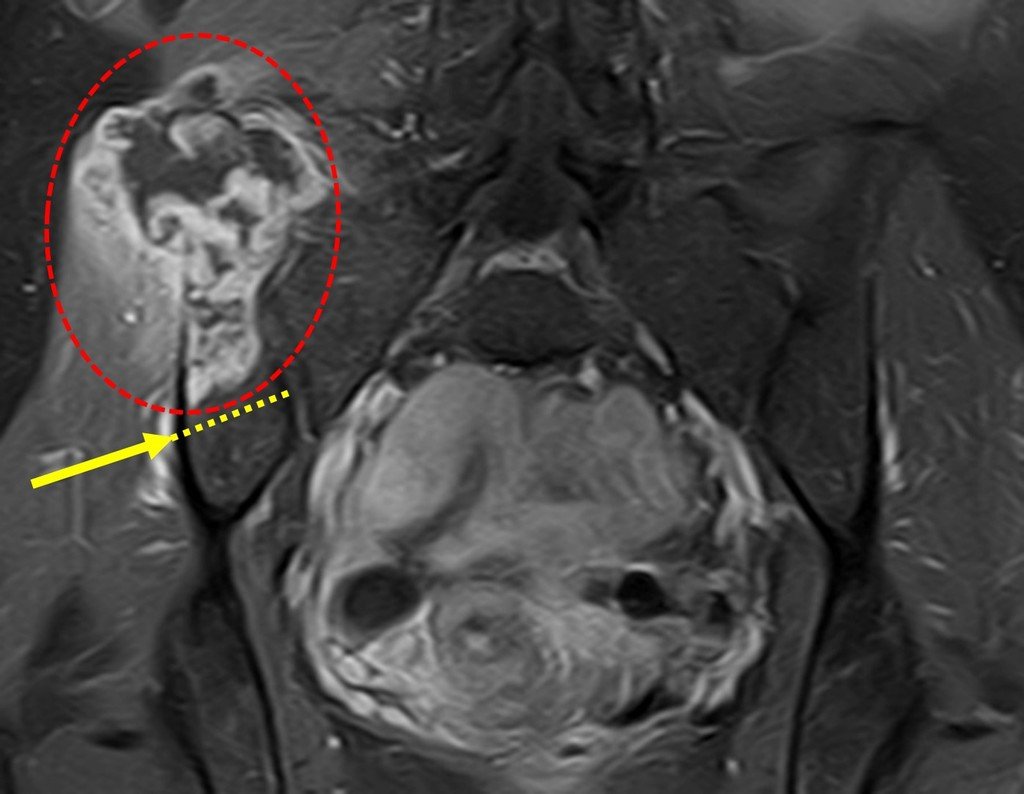
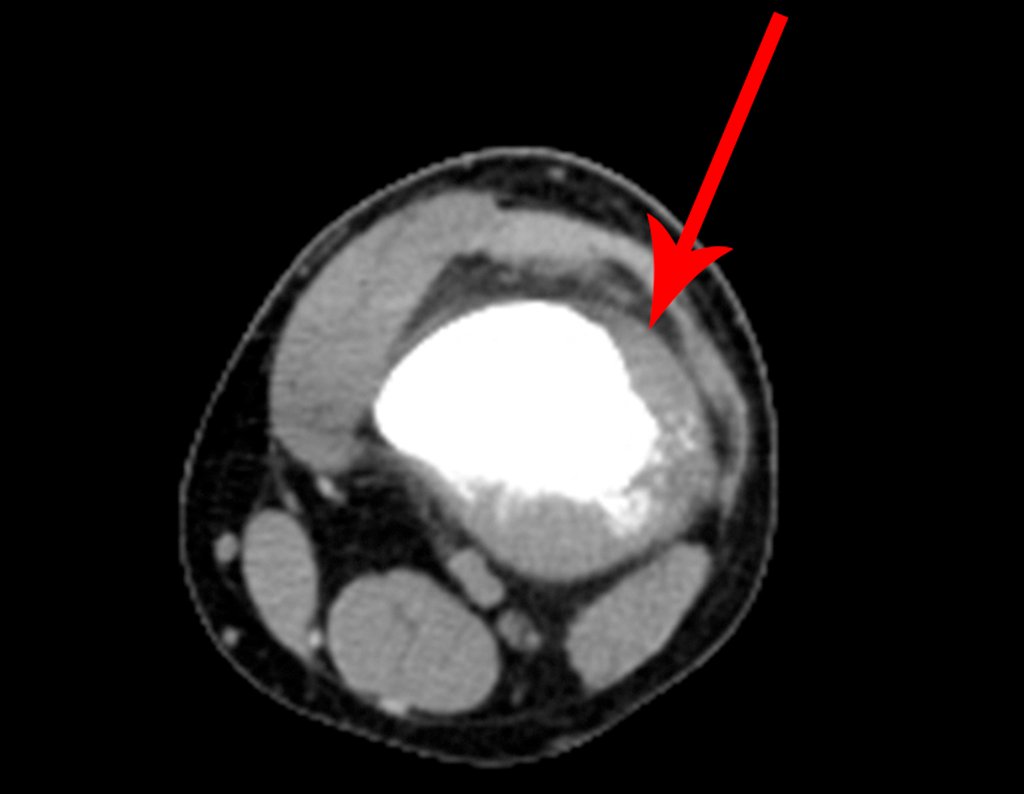
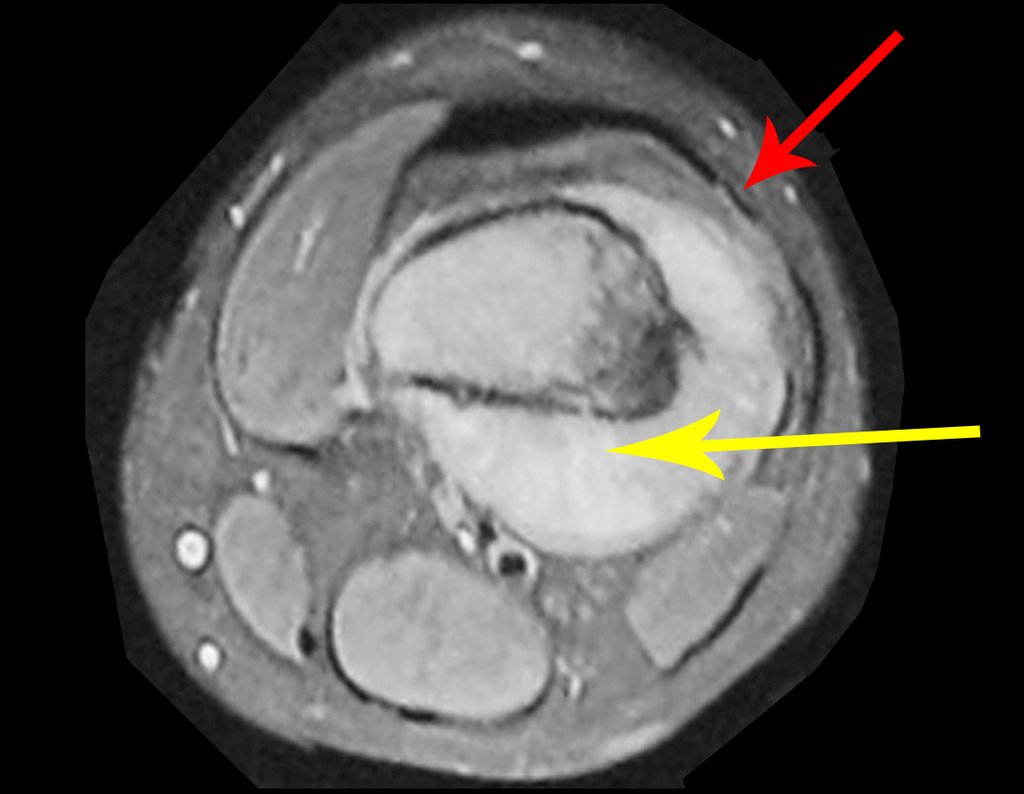
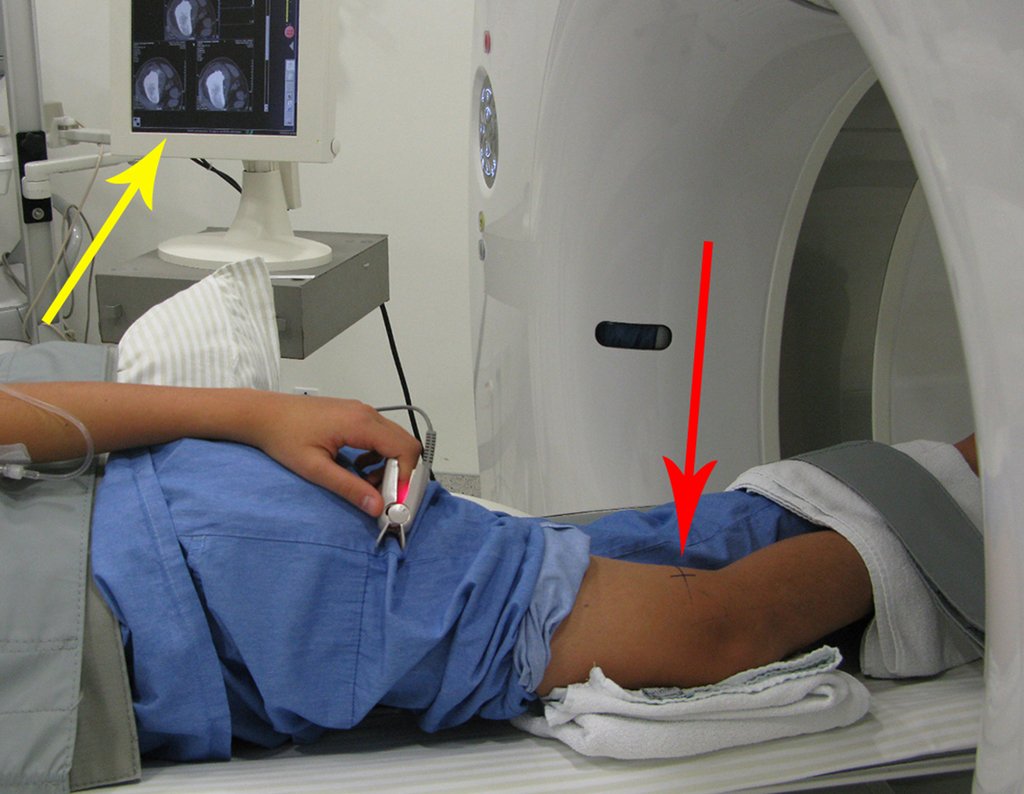
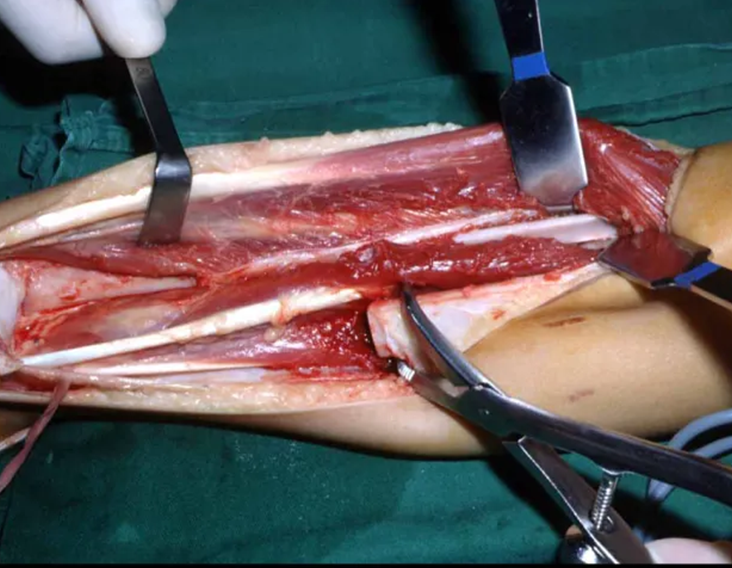
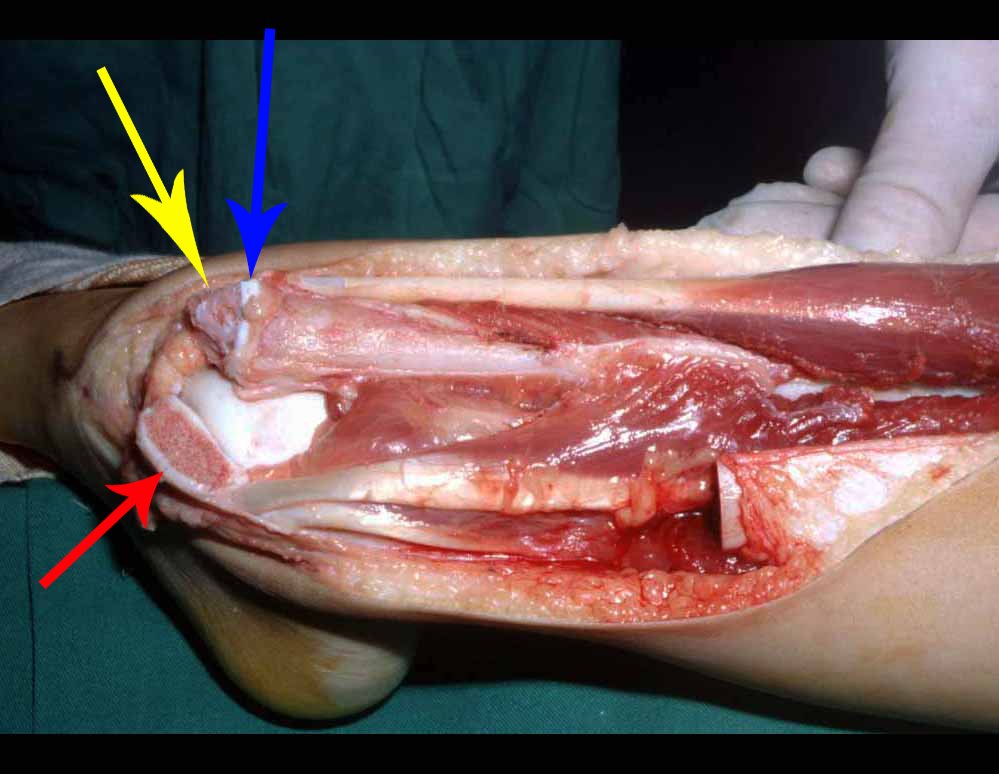
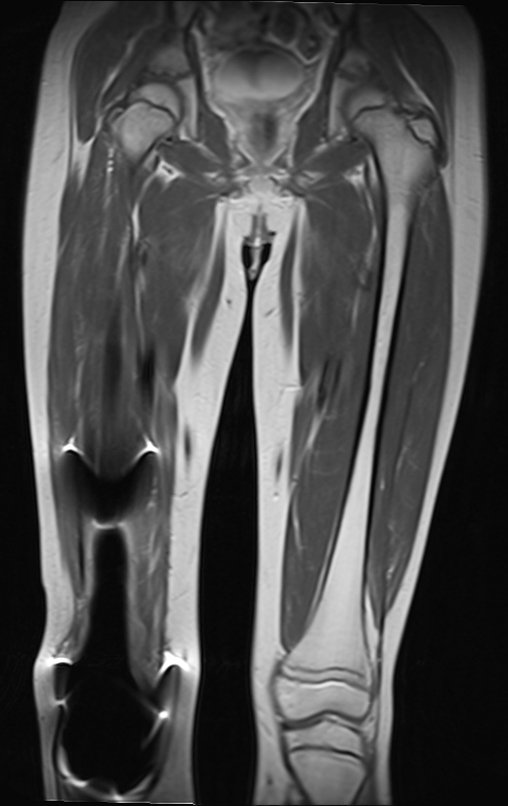
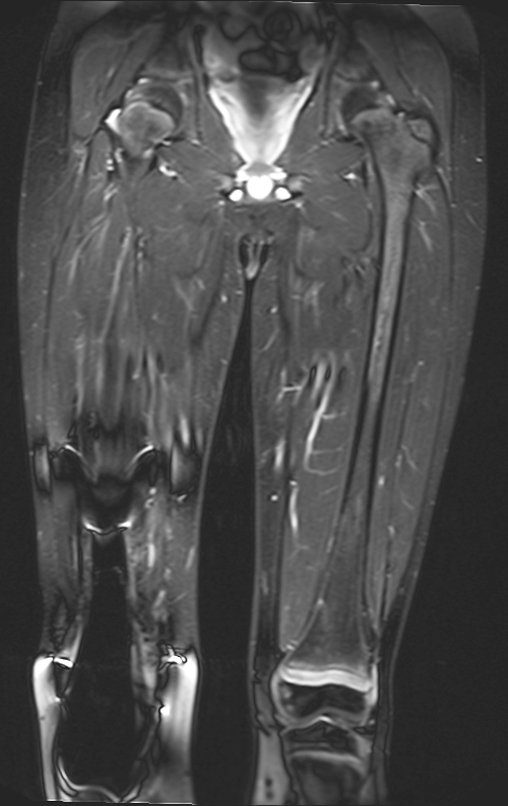
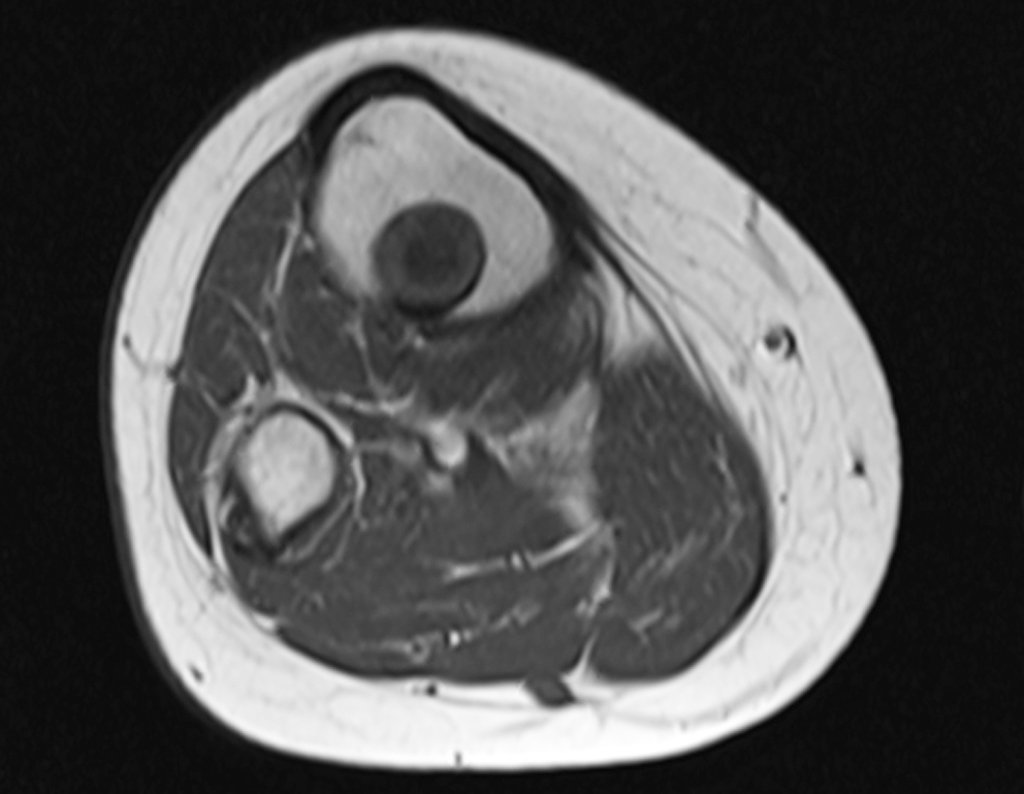
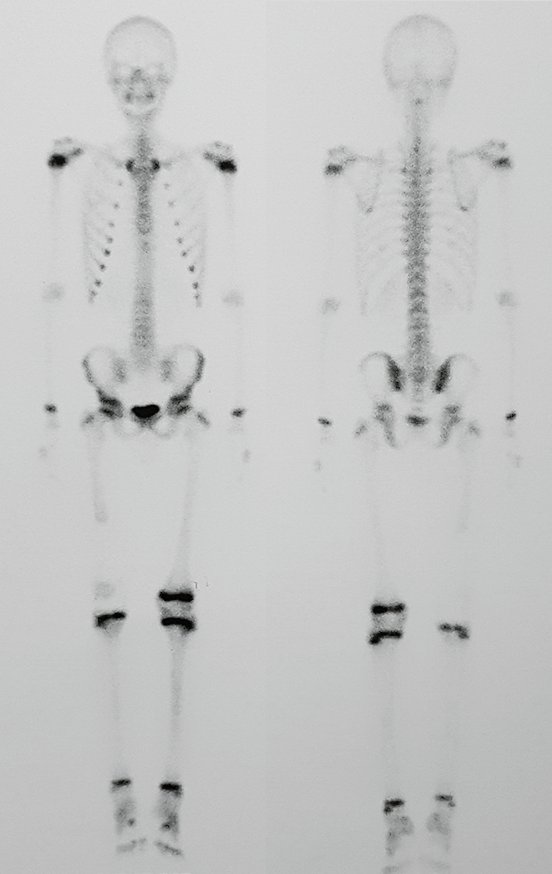
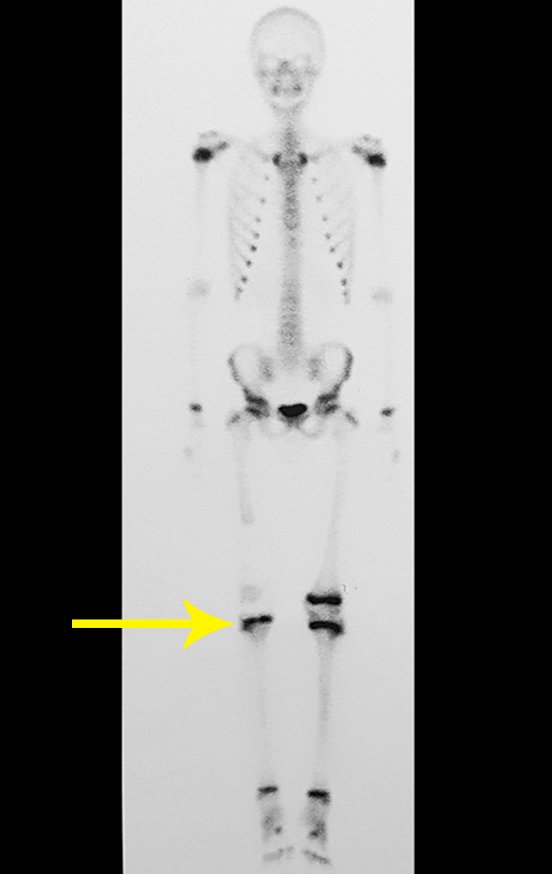
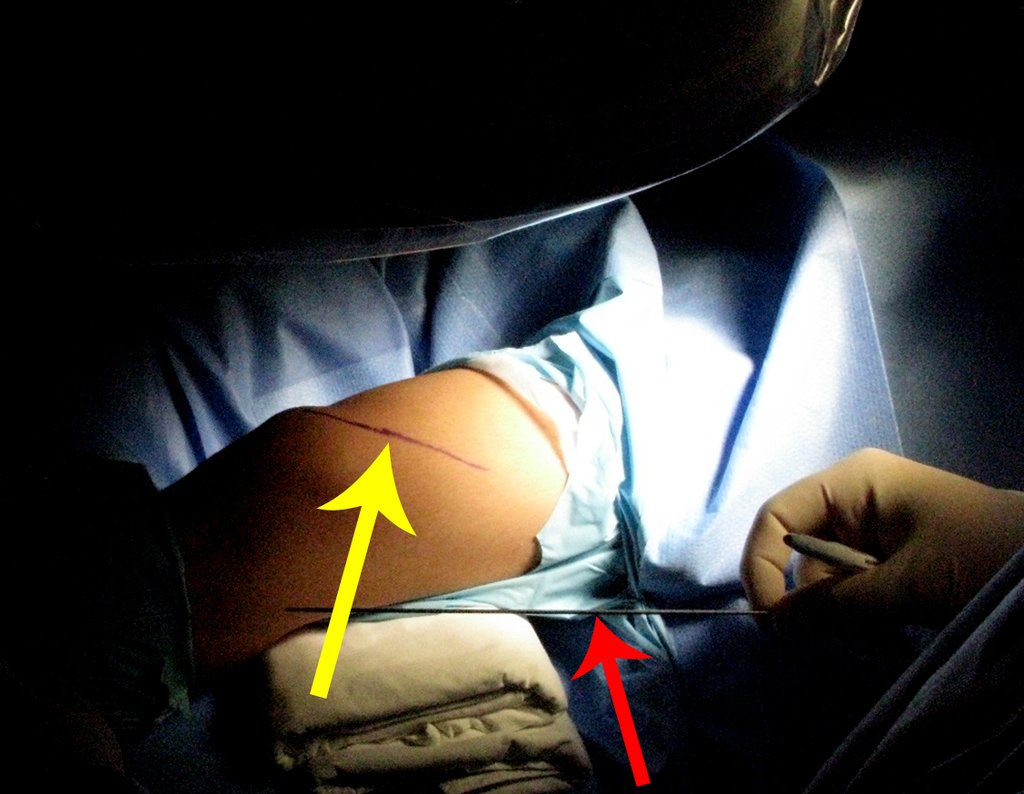
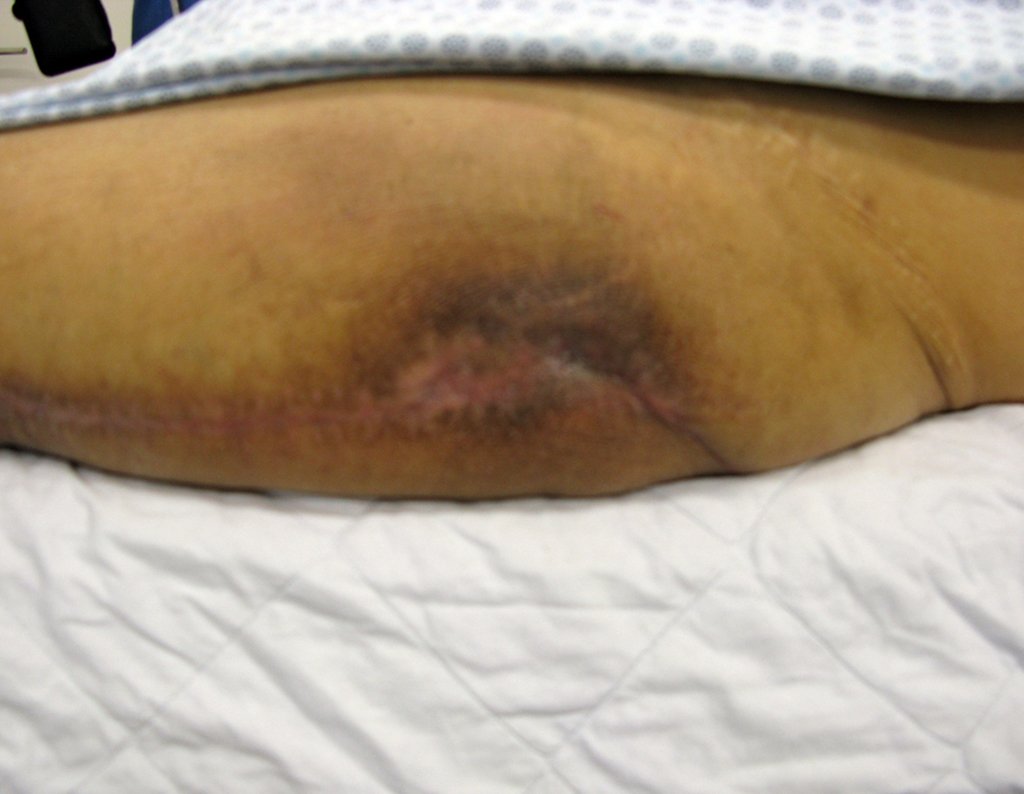
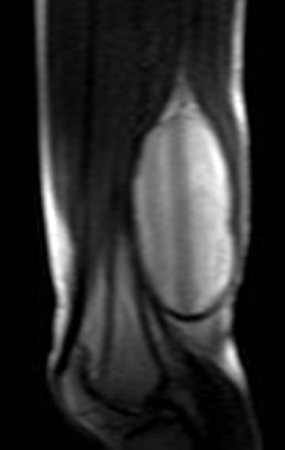
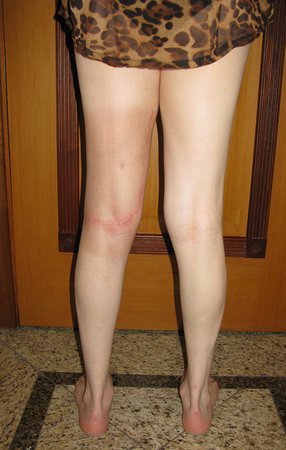
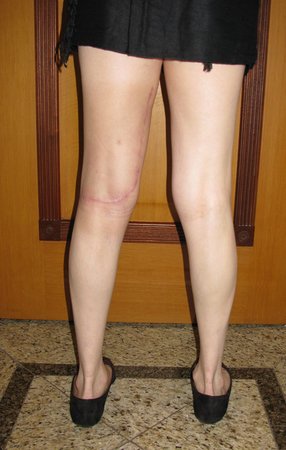
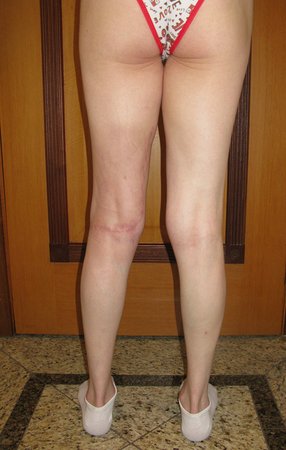
Vemos con mucha frecuencia pacientes con cicatrices de biopsias realizadas en la región anterolateral de la metáfisis distal del fémur. La flecha roja apunta a la fascia lata, que con mayor frecuencia se ve interrumpida por el recorrido de la biopsia, realizada por profesionales que no operarán al paciente, lo que dificulta cubrir futuras cirugías y la función de este miembro que será necesario reconstruir. .
La flecha amarilla indica el trayecto posterolateral, más adecuado para biopsia y reconstrucción, proporcionando la mejor cobertura y función.
Para realizar la biopsia por esta vía, se debe colocar al paciente en decúbito prono, figuras 119 a 122.
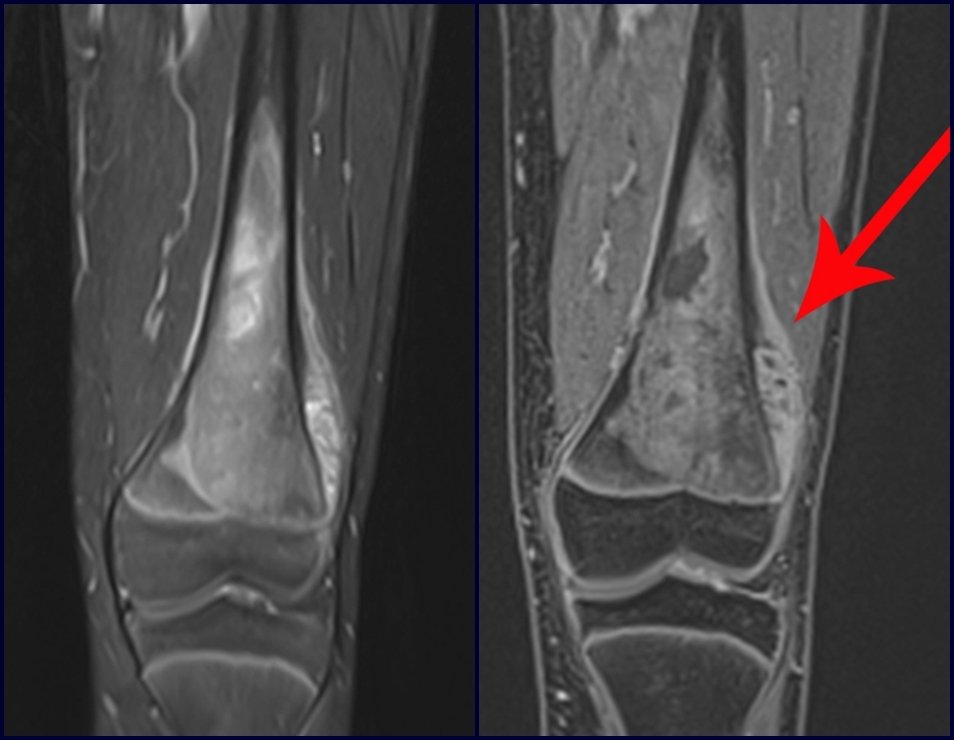
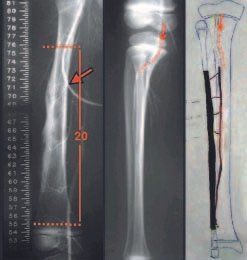
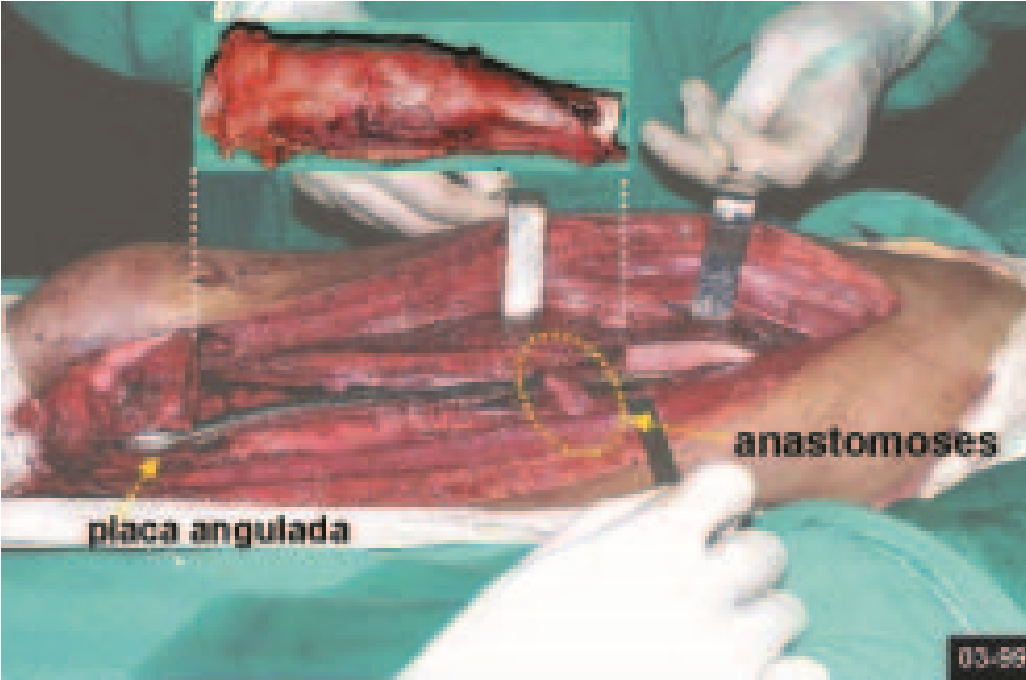
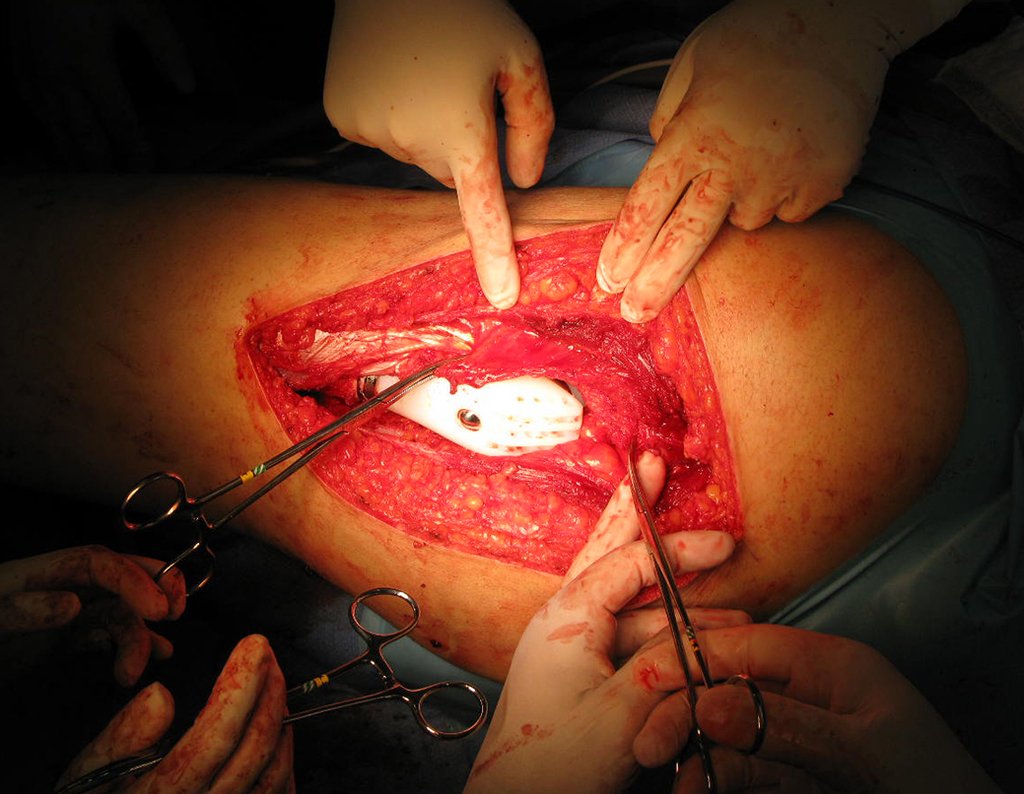
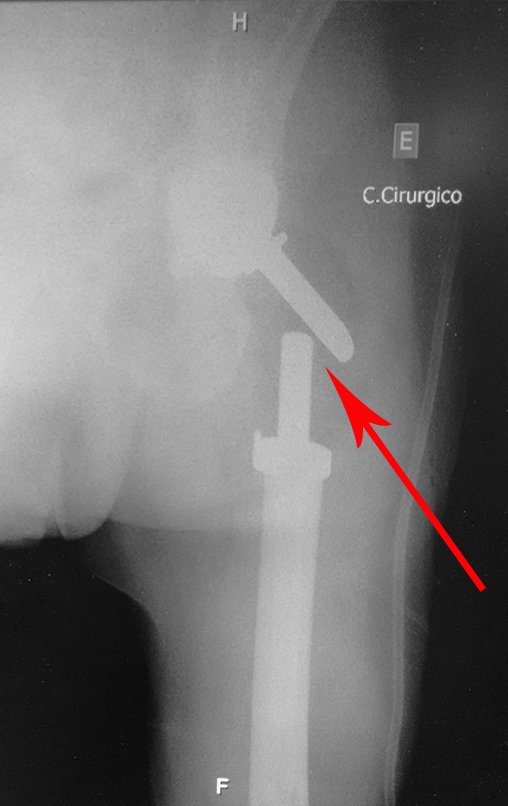
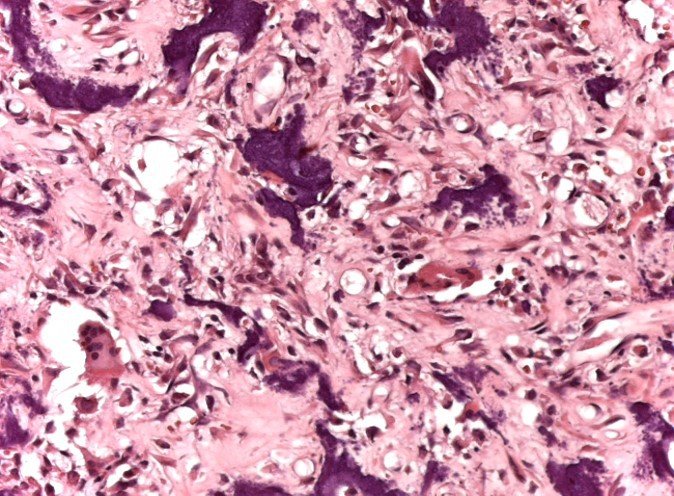
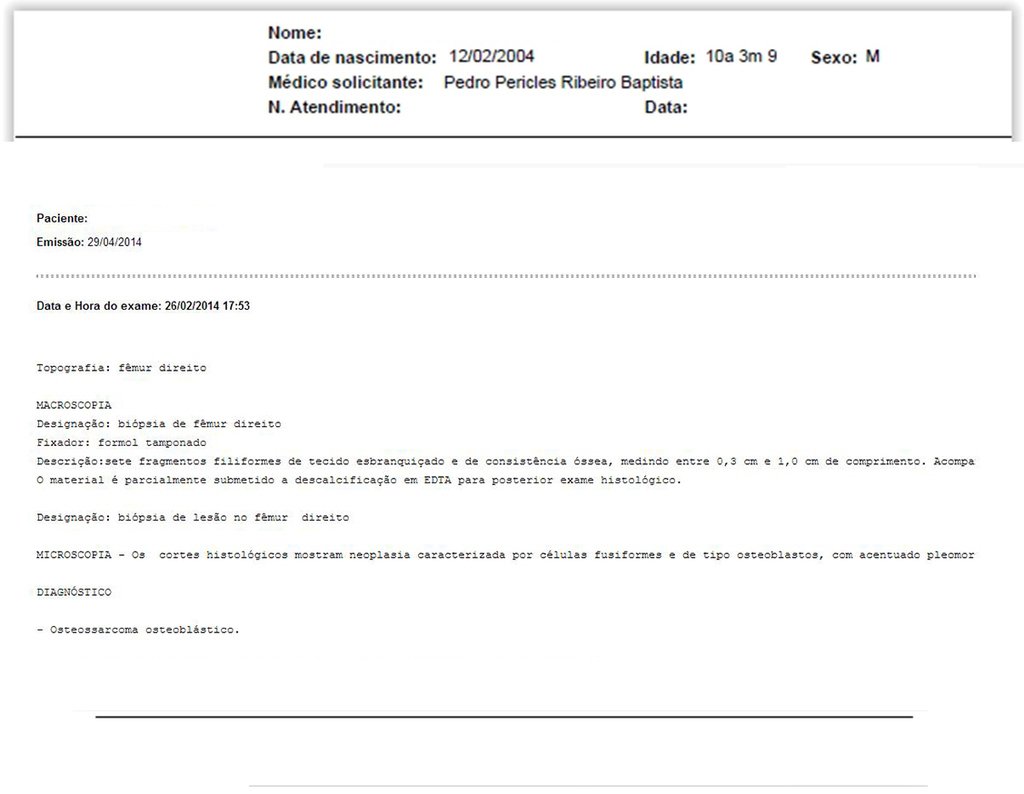
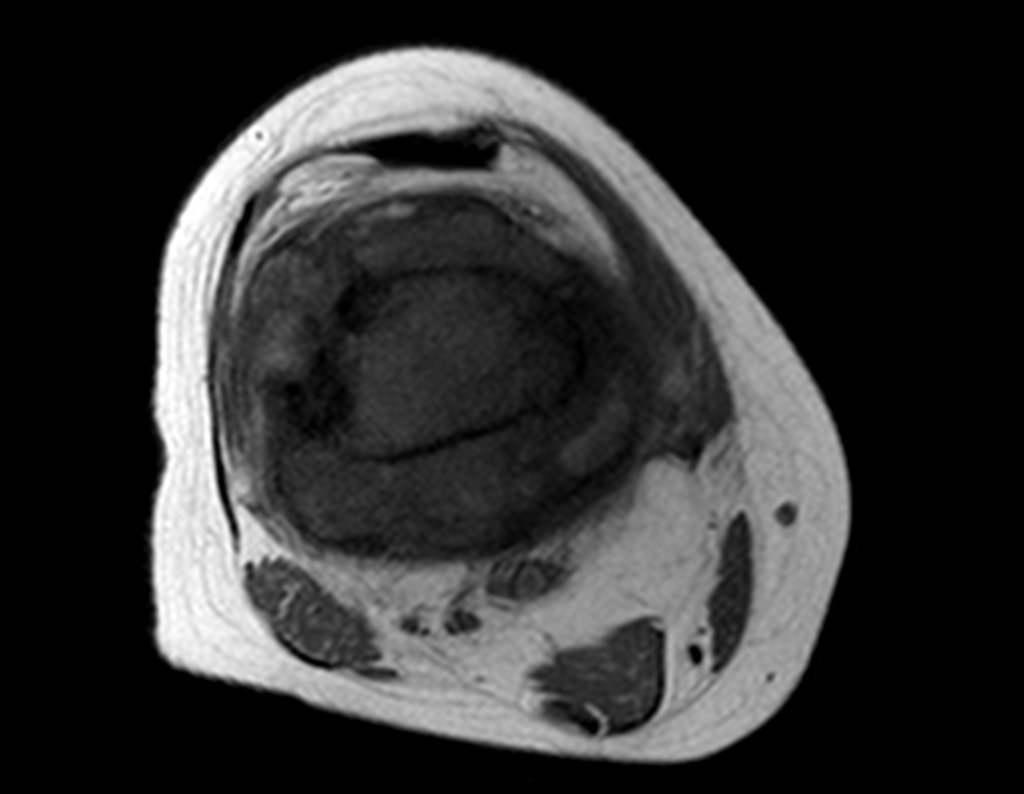
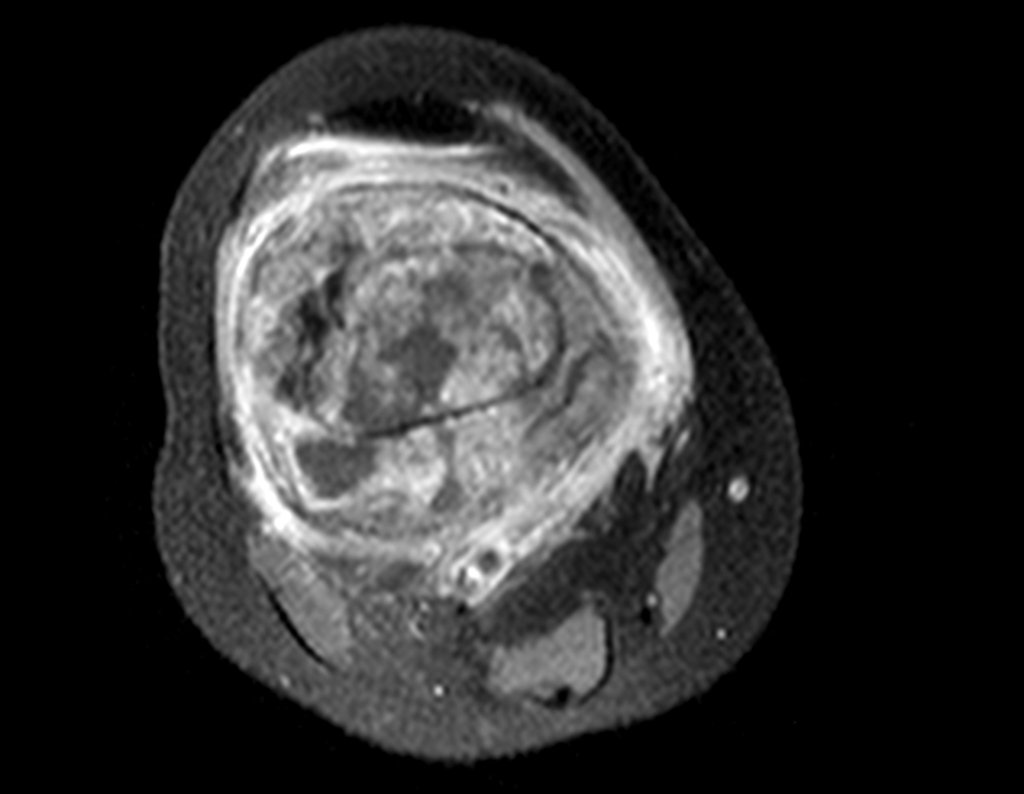
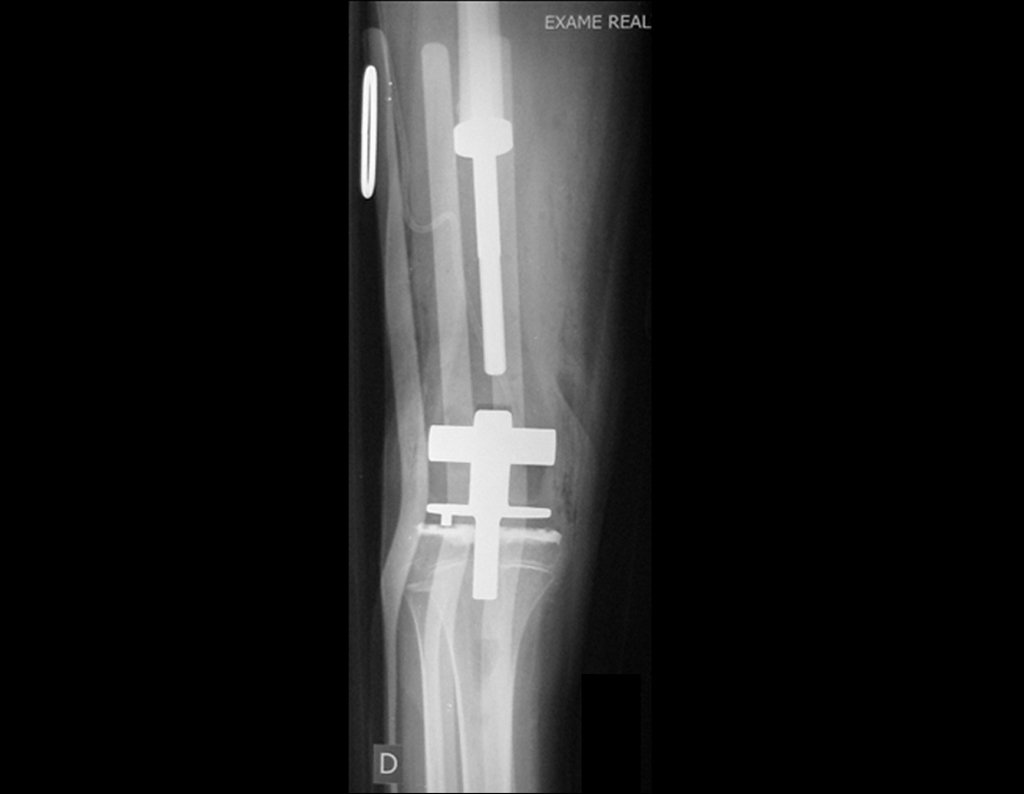
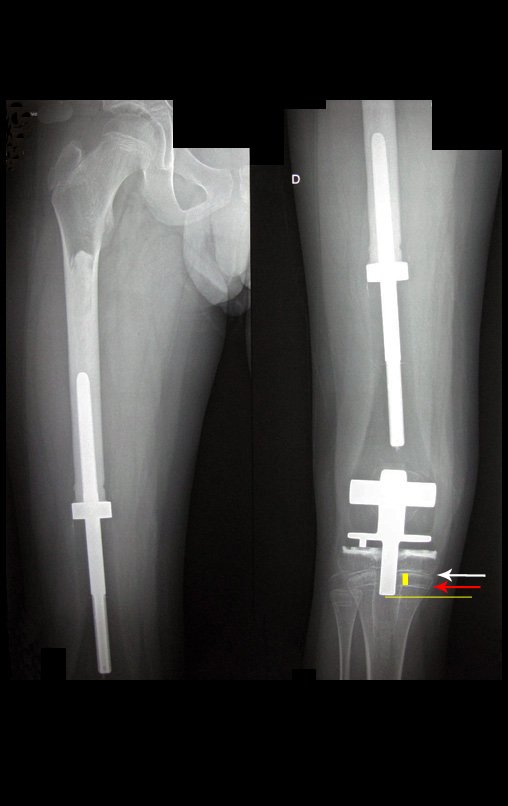
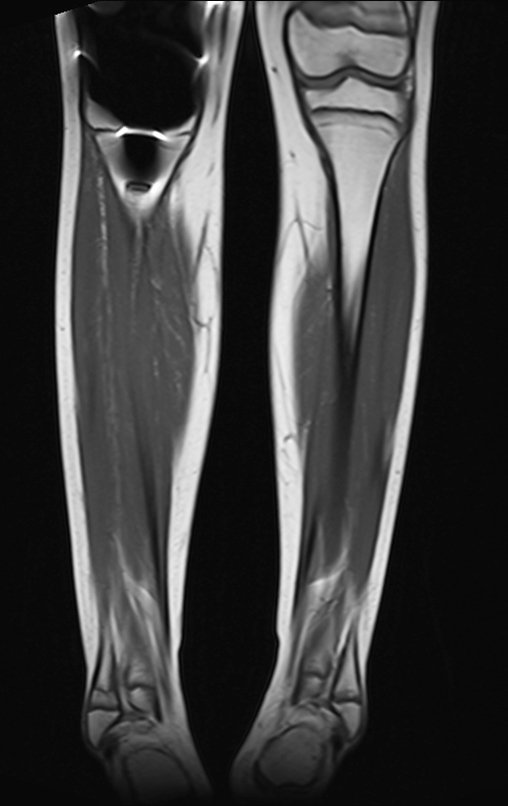
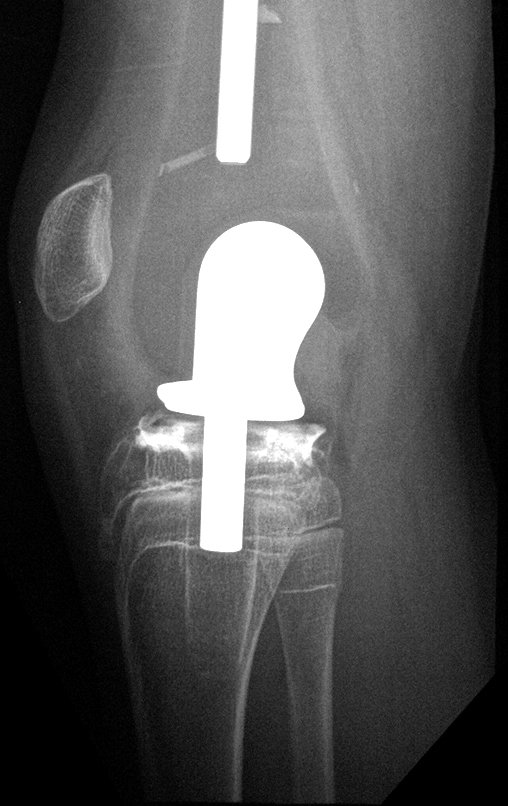
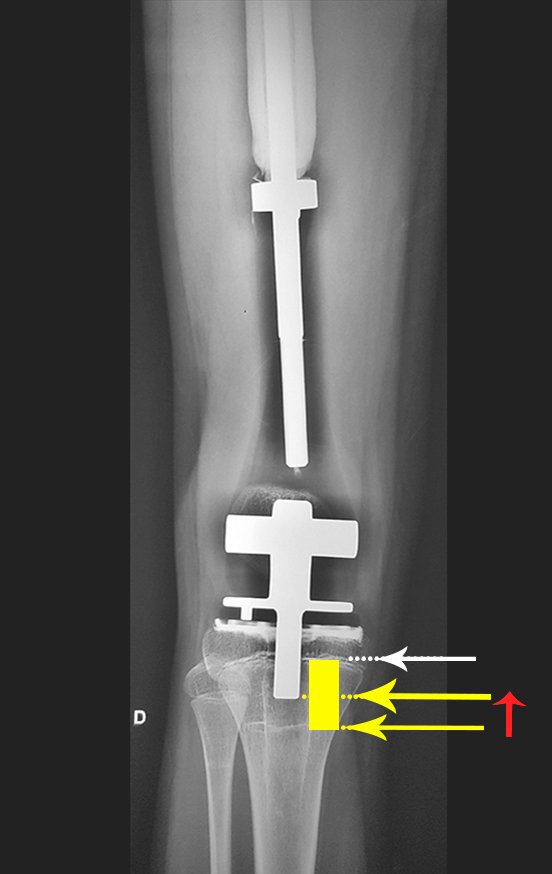
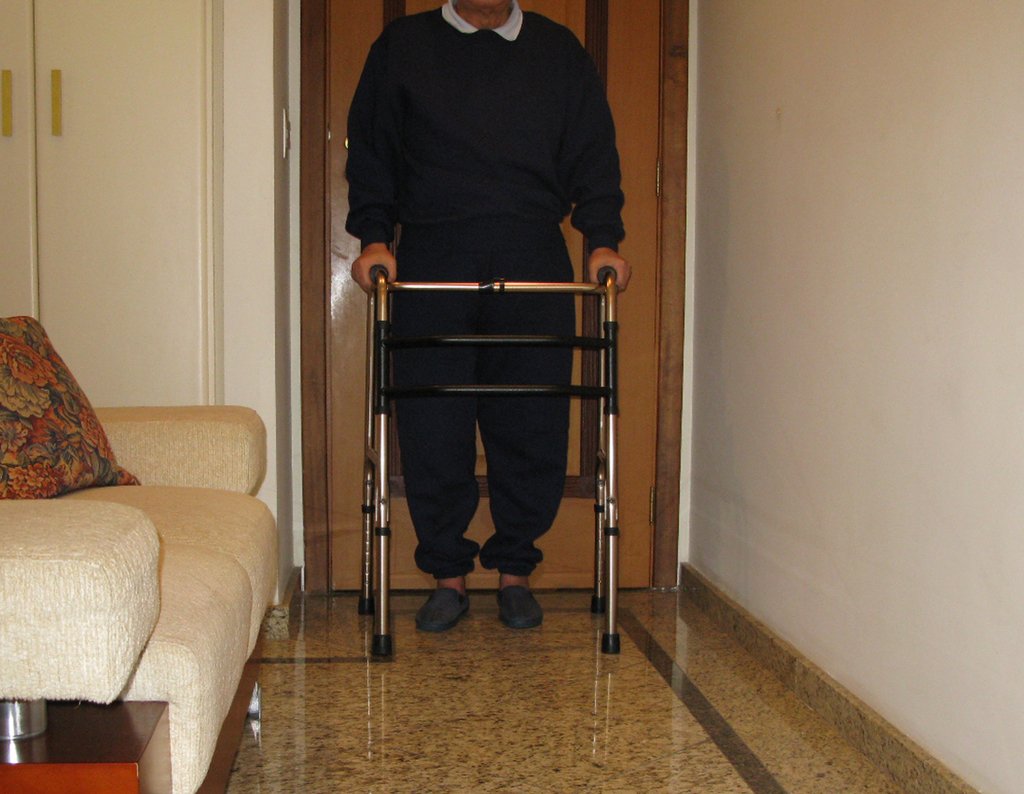
Para el tratamiento de tumores del extremo distal del fémur, como esta lesión, con este grado de afectación y localización, recomendamos la biopsia descrita y quimioterapia de inducción neoadyuvante, resección con margen oncológico y reconstrucción con prótesis modular y quimioterapia adyuvante.
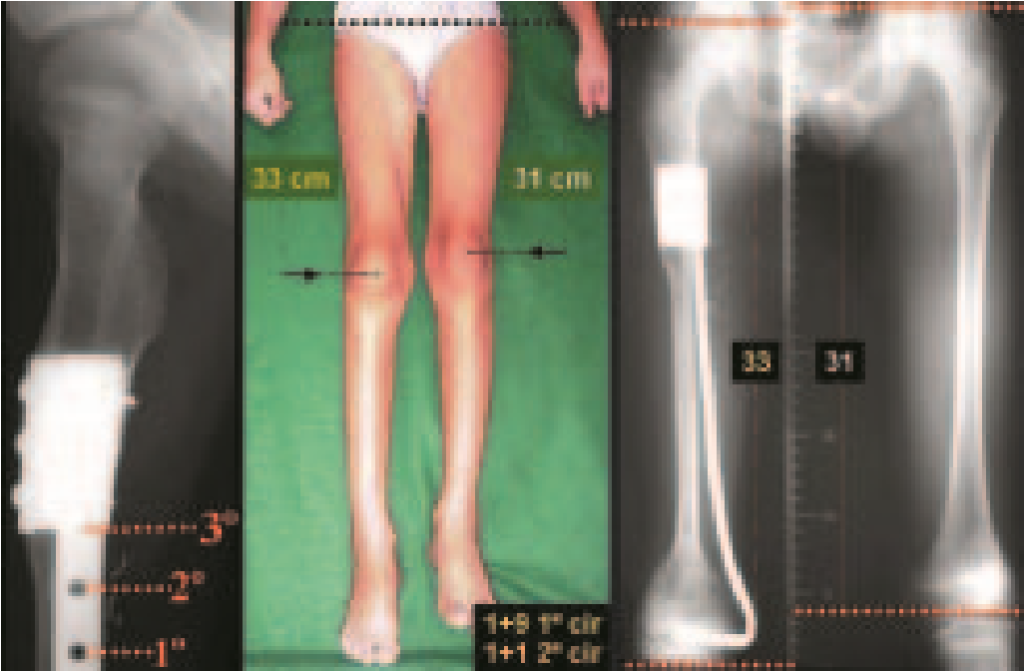
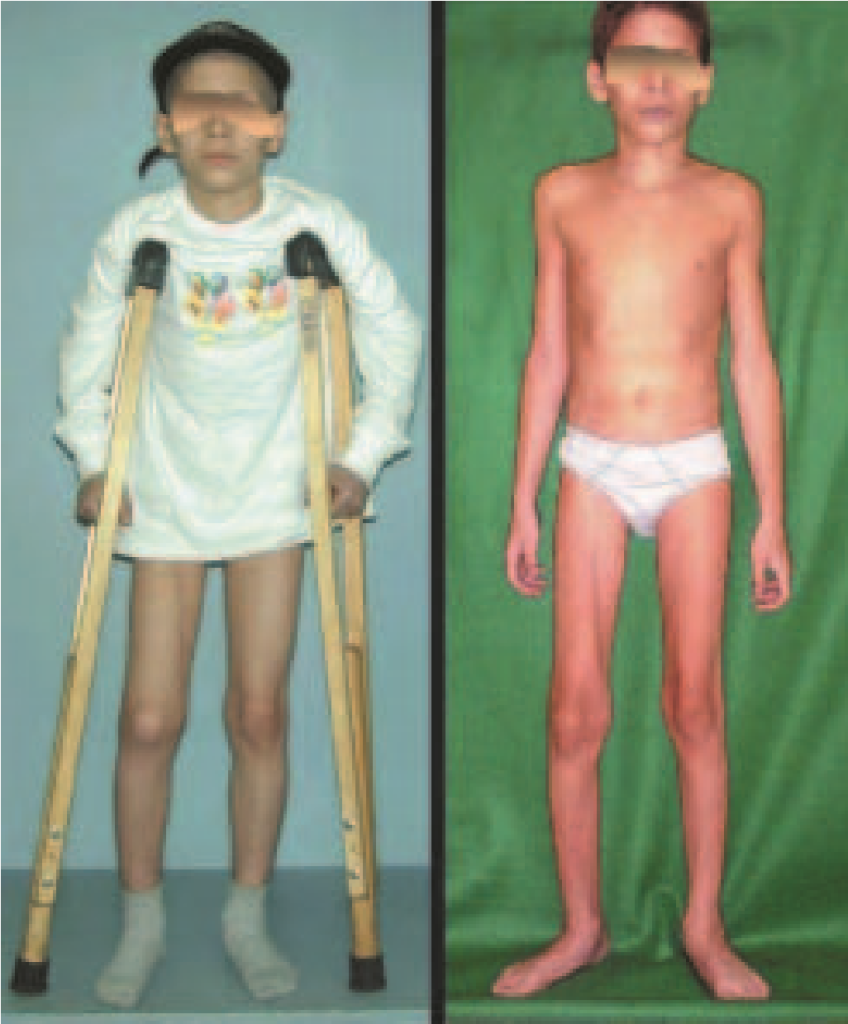
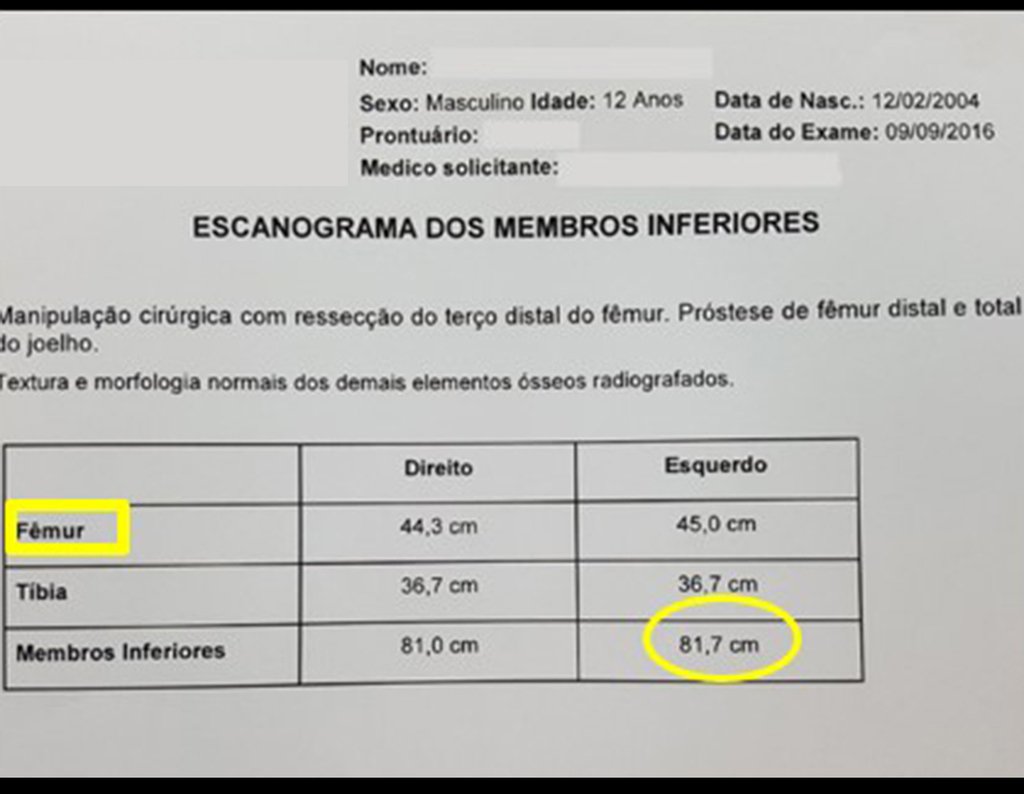
El paciente de este ejemplo está fuera de tratamiento, con excelente función y el caso completo se puede ver en el Enlace: http://osteosarcoma-length discrepancy .
La realización de una biopsia musculoesquelética, encaminada al diagnóstico y tratamiento adecuado de las neoplasias, debe ser muy bien planificada y realizada por profesionales experimentados.
“La realización de biopsias musculoesqueléticas, encaminadas al diagnóstico y tratamiento adecuado de las neoplasias, debe ser muy bien planificada y realizada por profesionales experimentados y con la participación del cirujano que atenderá el caso”.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com