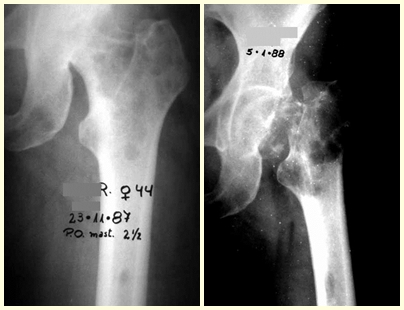
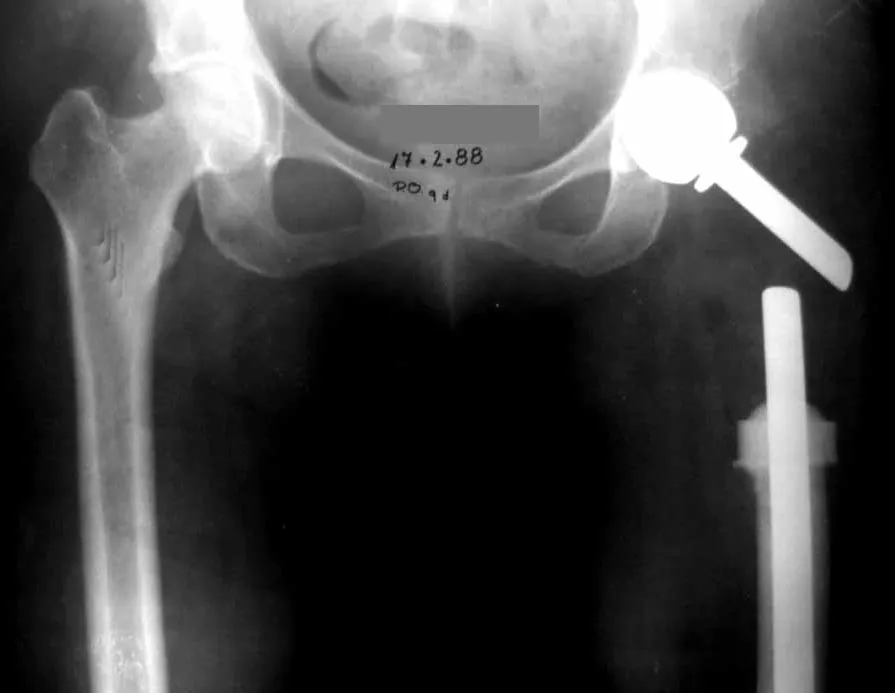
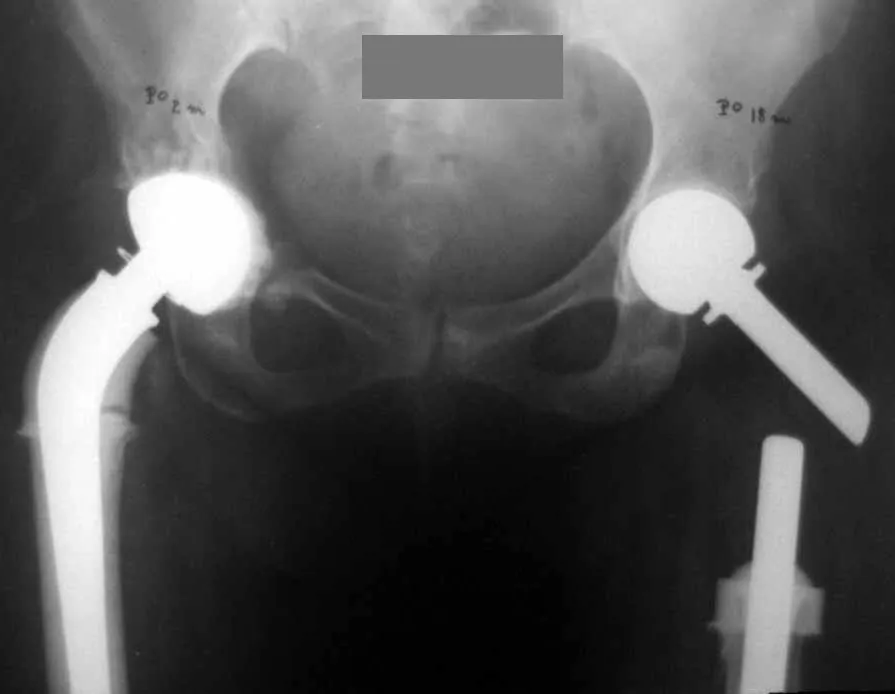
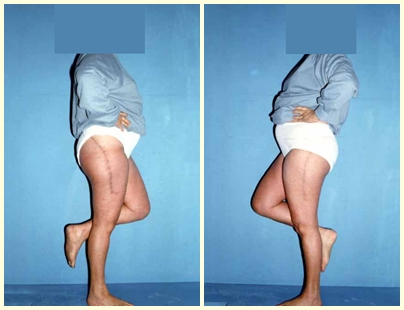
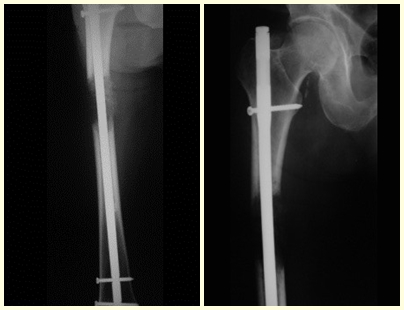
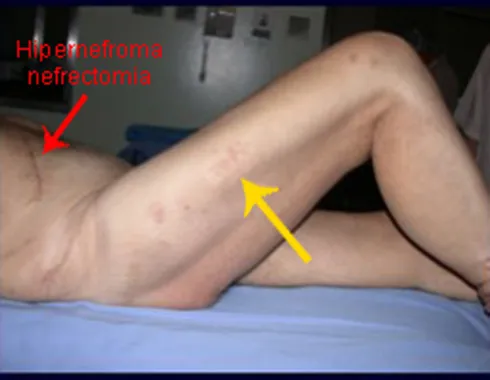
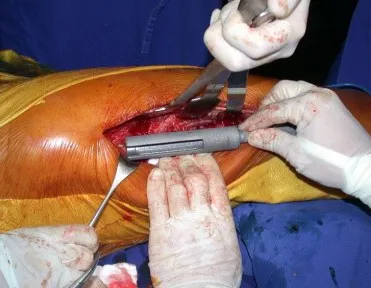
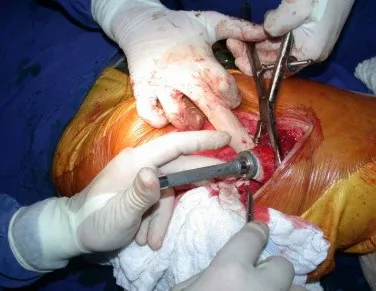
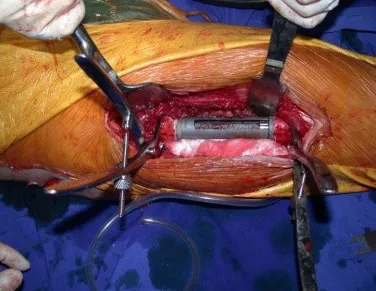
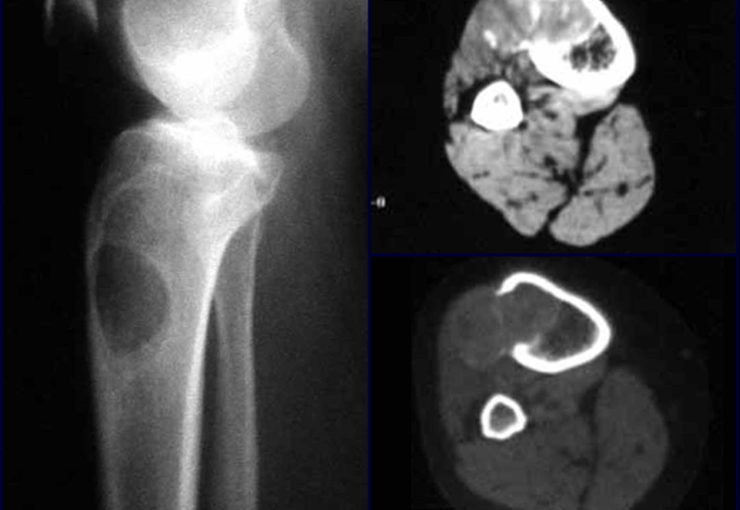
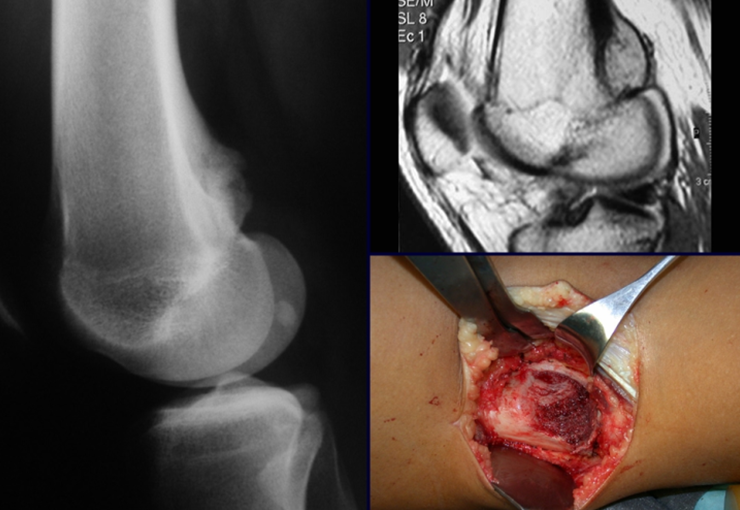
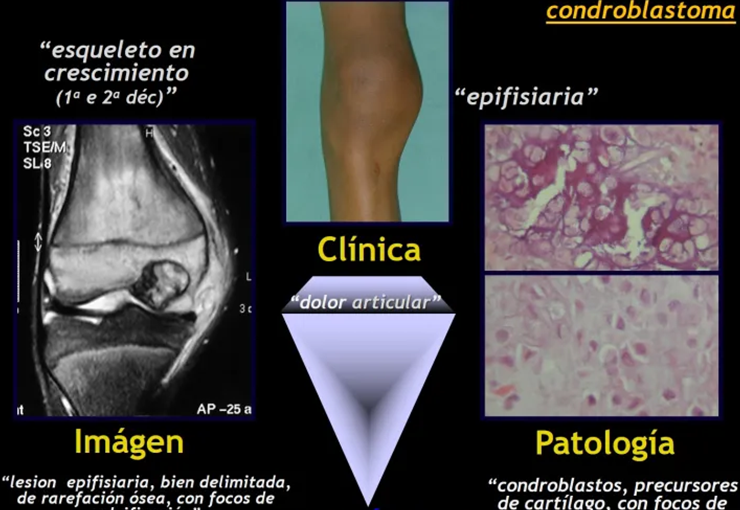
Introducción al estudio de los tumores óseos. La filosofía de este capítulo es presentar nuestra experiencia y una forma de razonamiento objetivo. Para tratarlo, primero hay que realizar el diagnóstico correcto.
Iniciamos el abordaje de los tumores óseos buscando transmitir “cómo pienso” sobre las lesiones musculoesqueléticas.
Introducción al estudio de los tumores óseos
En primer lugar, debemos enmarcar la condición que estamos evaluando dentro de uno de los cinco capítulos principales de Patología:
1- MALFORMACIONES CONGÉNITAS
2- TRASTORNOS CIRCULATORIOS
3- PROCESOS DEGENERATIVOS
4- INFLAMATORIO
5- NEOPLASICOS
Si el caso fue clasificado dentro del capítulo de neoplasias, nuestro objetivo es establecer el diagnóstico para poder instaurar el tratamiento. Es fundamental establecer un diagnóstico certero.
Para ser diagnosticado es necesario conocer y aprender el universo de tumores ya descritos.
¿No somos ya conscientes, como estudiantes de medicina, de todas las neoplasias musculoesqueléticas?
Solemos transmitir, en nuestras clases, que nuestro cerebro puede almacenar información de forma aleatoria. Sin embargo, si cuando asimilamos conocimientos intentamos hacerlo de forma ordenada, quedará “almacenado” en “carpetas”, estas en “cajones” y tendremos un “ archivo ” . De esta manera podremos recuperar la información más fácilmente.
Por lo tanto, lo ayudaremos a construir este archivo, organizando el “HD” .
En primer lugar, debemos recordar que la neoplasia se origina a partir de una célula que ya existe en nuestro cuerpo. Esta célula, al reproducirse, sufre cambios en su código genético, debido a diferentes factores (radiaciones, virus, mutaciones, translocaciones, etc.) y esta luego se convierte en la “ célula madre ” de la neoplasia.
Como ya aprendimos histología en la Facultad, conocemos todas las posibles neoplasias. Sólo nos falta añadir algunos conceptos para nombrar y clasificar con seguridad todos los tumores ya descritos.
El término carcinoma se reservó para las neoplasias malignas cuyas células primitivas se originan en la capa ectodérmica y sarcoma para las del mesodermo.
Si tomamos como ejemplo nuestro muslo y hacemos un ejercicio recordando todas las células que lo componen, empezando por la piel y profundizando en el tejido subcutáneo, músculos, etc., hasta la médula ósea del fémur, conseguiremos Hemos revisado todas las células del aparato locomotor y por tanto podremos nombrar todas las neoplasias musculoesqueléticas.
Hagamos este ejercicio. Empezando por la piel, recordamos el carcinoma de células escamosas , el carcinoma de células basales y el melanoma . Estas neoplasias son tratadas con mayor frecuencia por dermatólogos y cirujanos plásticos y rara vez requieren la ayuda de un ortopedista.
Debajo de la piel, todas las estructuras derivan del mesodermo y por ello añadiremos el sufijo oma para las lesiones benignas y sarcoma para las malignas .
Por tanto, debajo de la piel tenemos el tejido celular subcutáneo (grasa) cuya célula más representativa es el lipocito. Si la lesión está formada por células parecidas al típico lipocito, tendremos un lipoma , formado por células desordenadas, con mitosis atípicas, un liposarcoma . En este mismo tejido subcutáneo tenemos fibroblastos, fibrohistiocitos y en consecuencia fibroma , fibrosarcoma , fibrohistiocitoma de bajo y alto grado de malignidad.
Otra estructura que conforma nuestro muslo son los músculos estriados, (músculos voluntarios), dando lugar así al rabdomiosarcoma . Los músculos lisos, que se encuentran en el aparato locomotor, se sitúan alrededor de los vasos y, aunque son raros, también encontramos leiomiosarcoma .
El tejido nervioso está representado aquí por los axones de los nervios periféricos. Estos axones tienen una vaina, cuyas células fueron descritas por Schwann, a partir de las cuales puede originarse el schwannoma .
En los tejidos blandos, recordándose, como derivados del tejido linfático, el linfangioma y el linfangiosarcoma ; tejido vascular, hemangioma y angiosarcoma .
El hueso está recubierto por el periostio, cuya función es formar tejido óseo, además de proteger, inervar y nutrir. El trauma puede conducir a la formación de un hematoma subperióstico que, si se produce una osificación madura y homogénea, puede traducirse como un periosteoma (“osteoma”). De esta misma superficie ósea se puede derivar un osteosarcoma de superficie de bajo grado conocido como osteosarcoma paraóstico (grado I) así como un osteosarcoma de alto grado .
En nuestro ejercicio llegamos ahora a la región medular del hueso. Esta región está formada por grasa, que luego puede dar lugar al liposarcoma intraóseo y a la médula ósea roja, de la que podemos tener todas las neoplasias del ERS ( Sistema Retículo Endotelial ) como el mieloma de células plasmáticas , el linfoma linfocítico , el sarcoma de Ewing .
Si recordamos, en lo más profundo de nuestra memoria, la histología de la osificación endocondral, encontraremos varias células precursoras. Uno de ellos es el grande (gigante) formado por células con varios núcleos, responsables de la resorción ósea, el osteoclasto y en consecuencia tenemos el osteoclastoma , más conocido como tumor de células gigantes ( TCG ). Del condroblasto el condroblastoma ; osteoblasto , osteoblastoma ; del condrocito el condroma , el condrosarcoma ; y así sucesivamente, podremos deducir todas las neoplasias descritas. Bastará nombrarlas en base al conocimiento de la célula normal, añadiendo oma a la lesión benigna y sarcoma a la maligna.
Consideramos importante esta forma de introducción, ya que así nos ayudará mejor a recordar lo que ya sabemos y llegar al diagnóstico.
La Organización Mundial de la Salud agrupa estas lesiones según el tejido que intentan reproducir, clasificándolas en:
I – Tumores que forman tejido óseo
Benigno: Osteoma – Osteoma osteoide – Osteoblastoma
Intermedio : Osteoblastoma agresivo
Maligno : Osteosarcoma central – Paróstico – Perióstico – Alto grado
II – Tumores formadores de cartílago
Benigno : Condroma (encondroma) – Osteocondroma – Condroblastoma – Fibroma condromixoide
Maligno : Primario – Secundario – Yuxtacortical – Mesenquimatoso – Desdiferenciado – Condrosarcoma de células claras
III – Tumores de Células Gigantes (TCG) (Osteoclastoma)
IV – Tumores de Médula Ósea
Maligno : Sarcoma de Ewing – Linfoma linfocítico – Mieloma de plasmocitos – PNET
V – Tumores Vasculares
Benigno : Hemangioma – Linfangioma – Tumor glómico
Intermedio : Hemangioendotelioma – Hemangiopericitoma
Maligno : angiosarcoma
VI – Tumores del Tejido Conectivo
Benigno : Fibroma – Lipoma – Fibrohistiocitoma
Maligno : Fibrosarcoma – Liposarcoma – Fibrohistiocitoma maligno – Leiomiosarcoma – Sarcoma indiferenciado
VII – Otros tumores
Benigno : Schwannoma – Neurofibroma
Maligno : Cordoma – Adamantinoma de huesos largos.
VIII – Tumores metastásicos en el hueso
Carcinomas: mama, próstata, pulmón, tiroides, riñón, neuroblastoma, melanoma, etc.
IX – Lesiones pseudotumorales
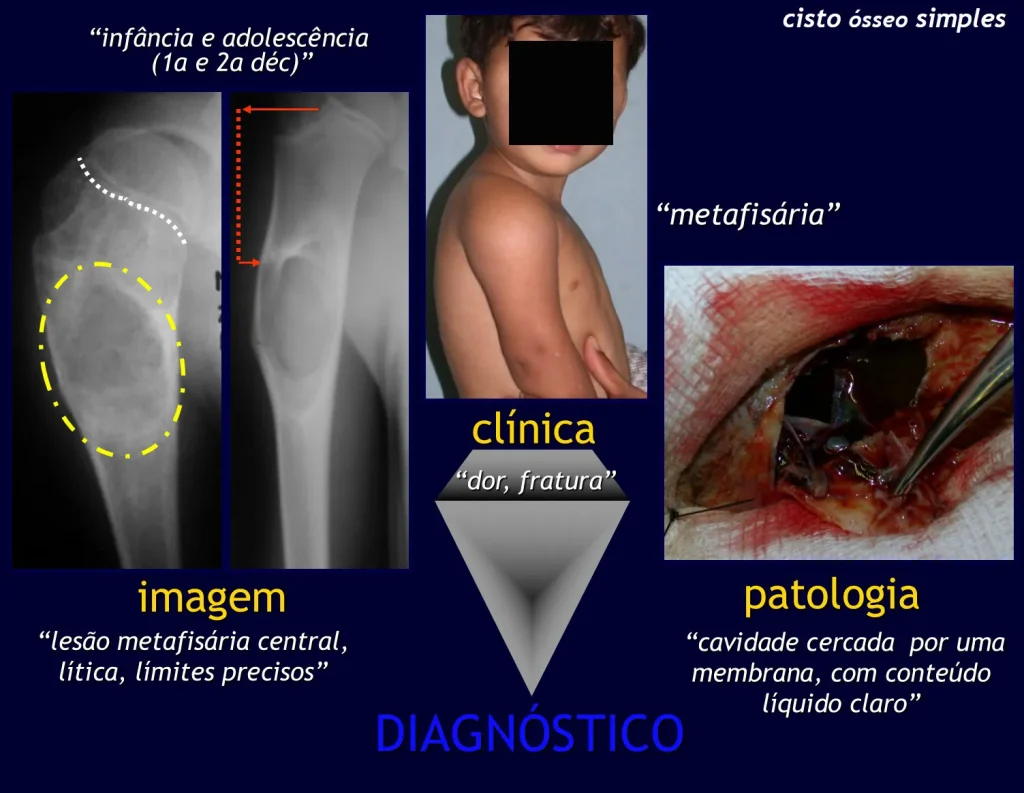
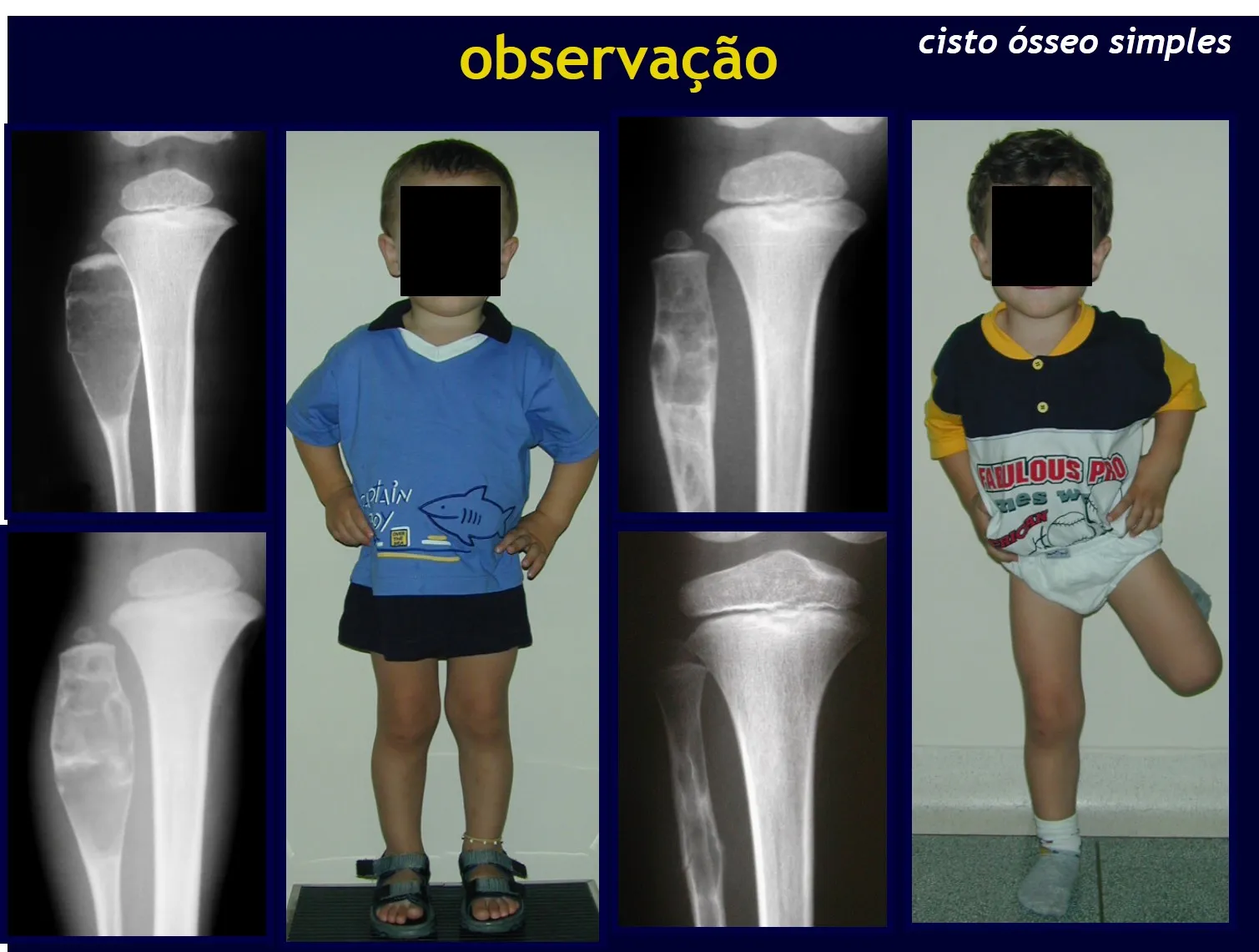
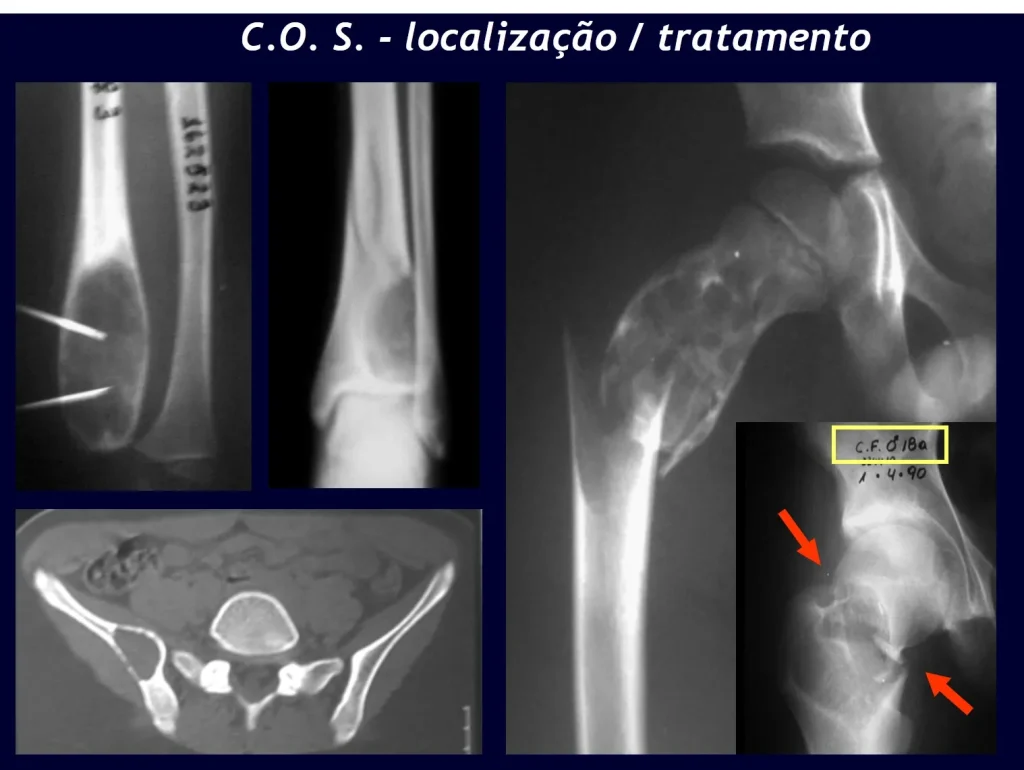
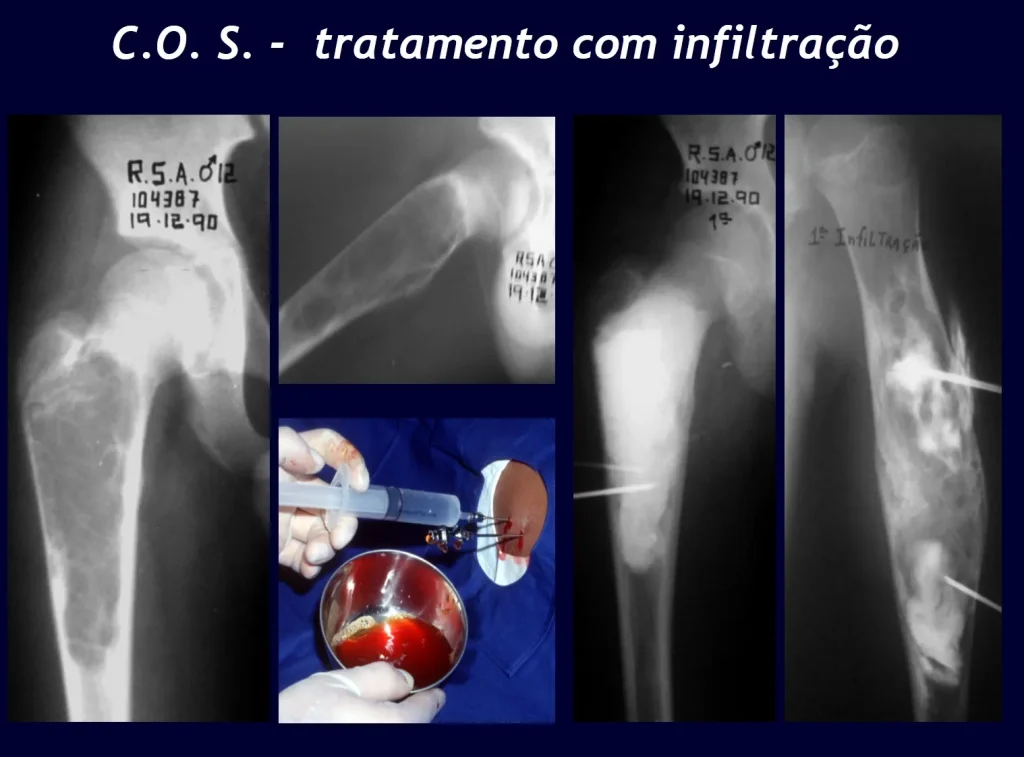
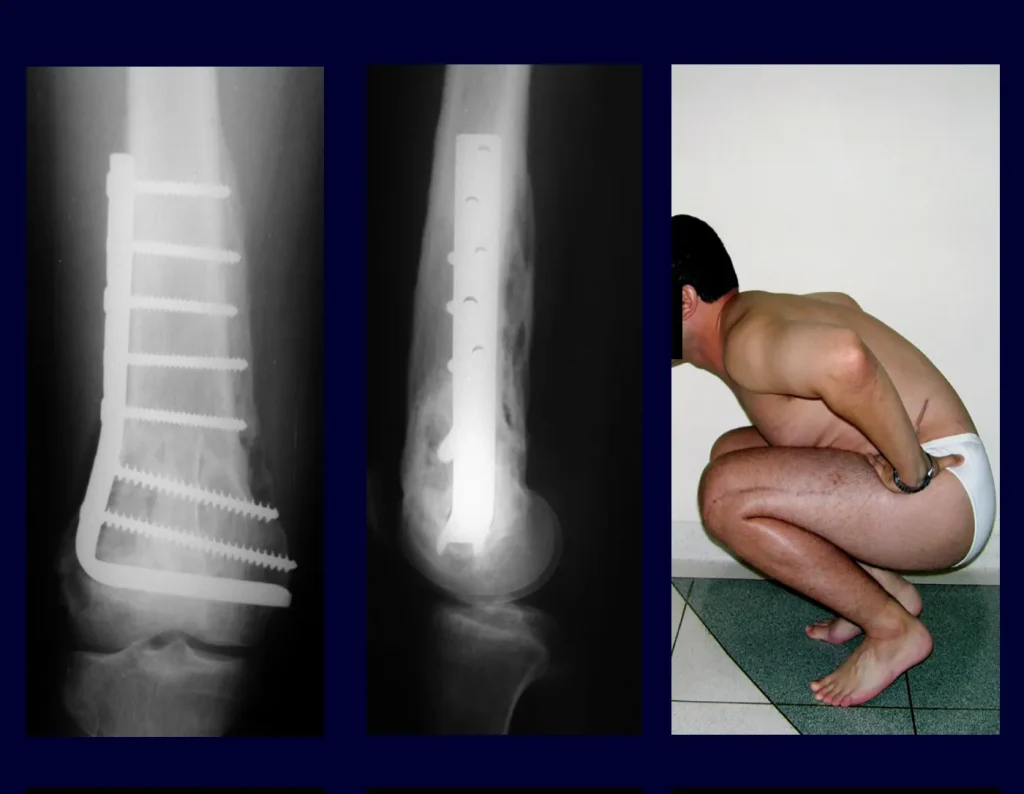
Quiste óseo simple (COS)
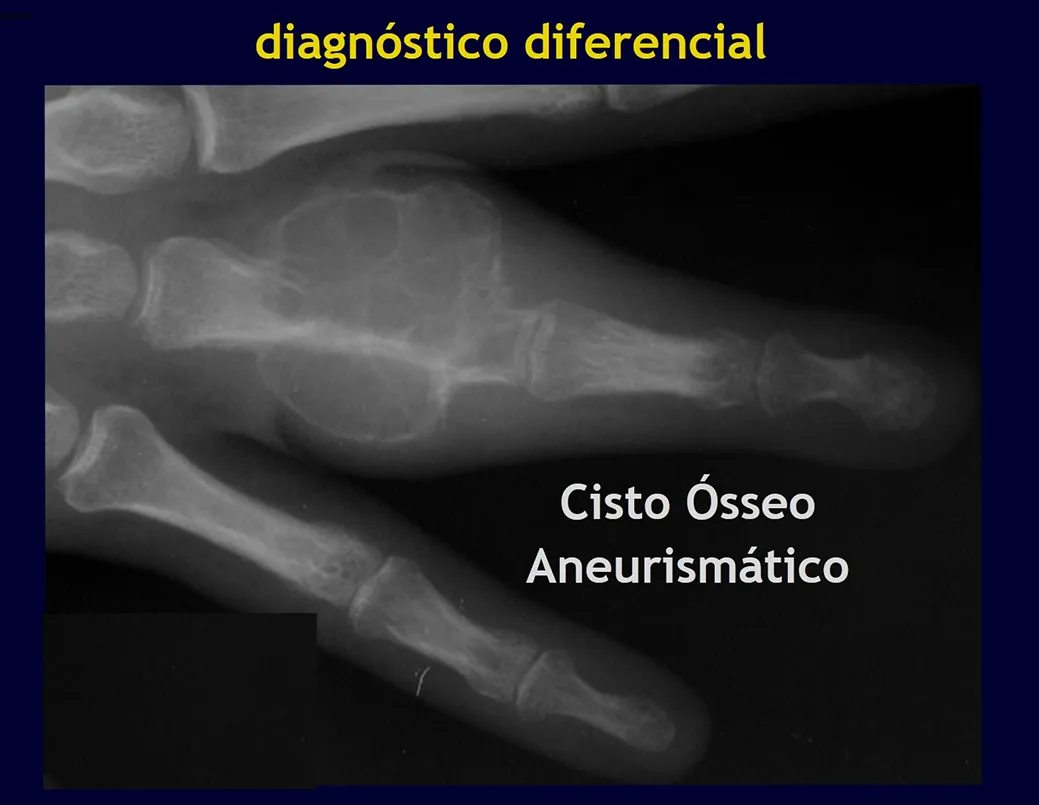
Quiste óseo aneurismático (AOC)
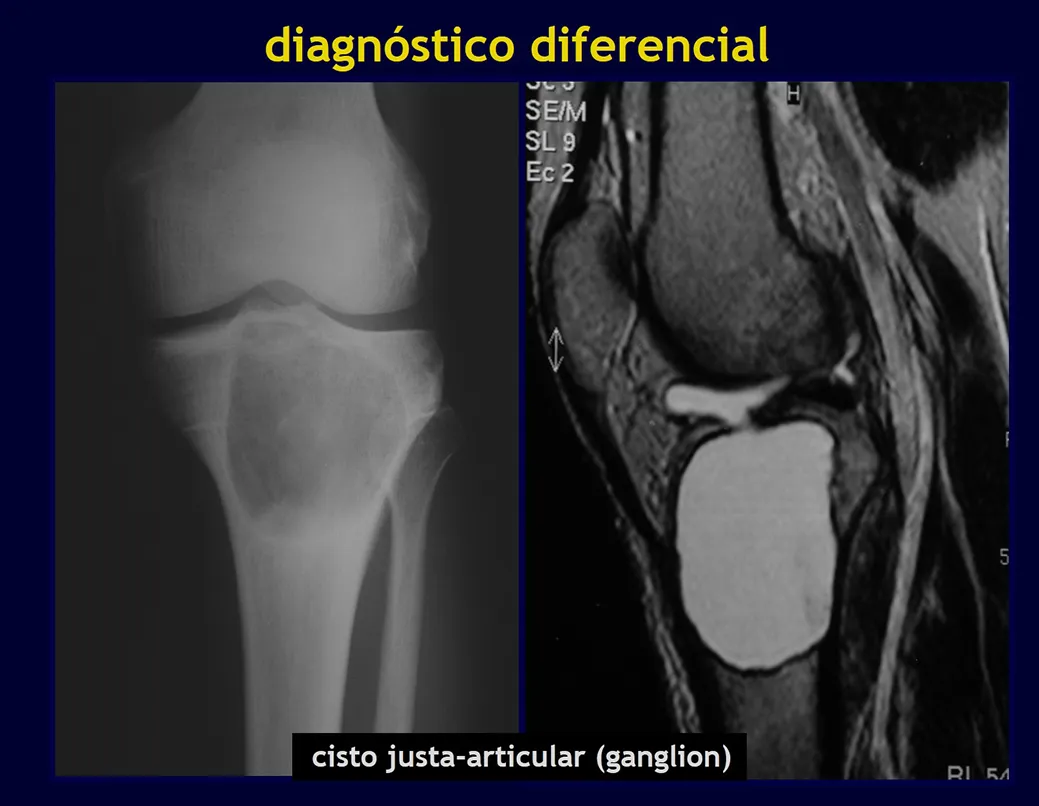
Quiste óseo yuxtaarticular (ganglio intraóseo)
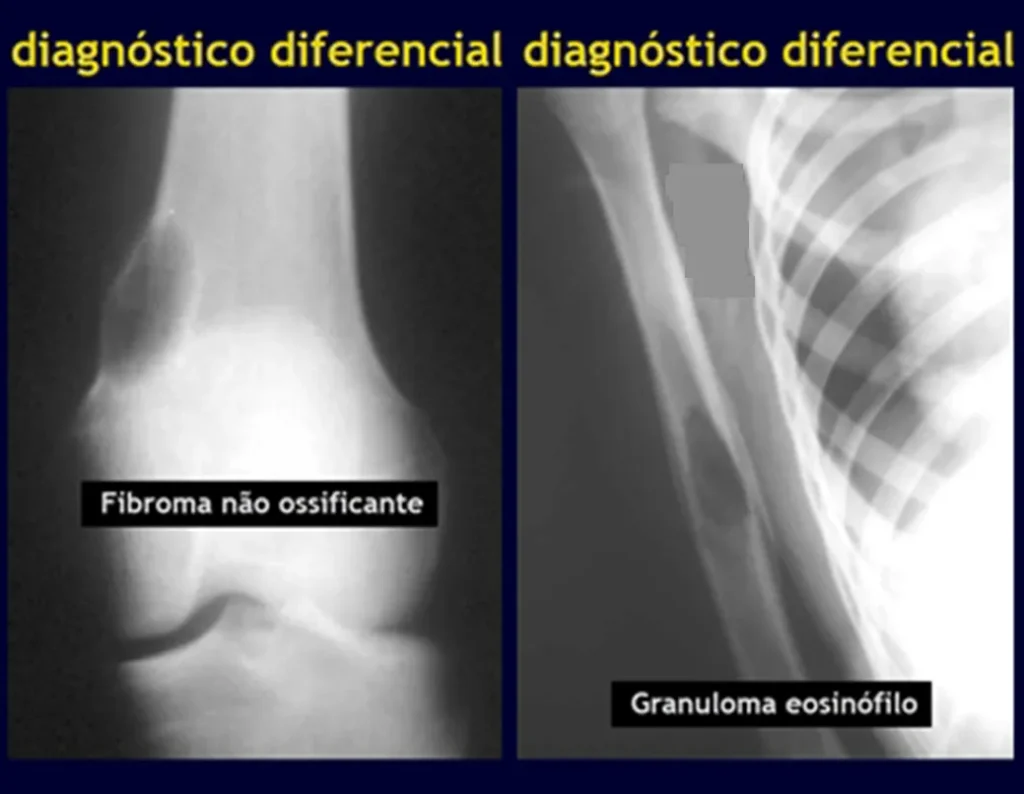
Defecto fibroso metafisario (fibroma no osificante)
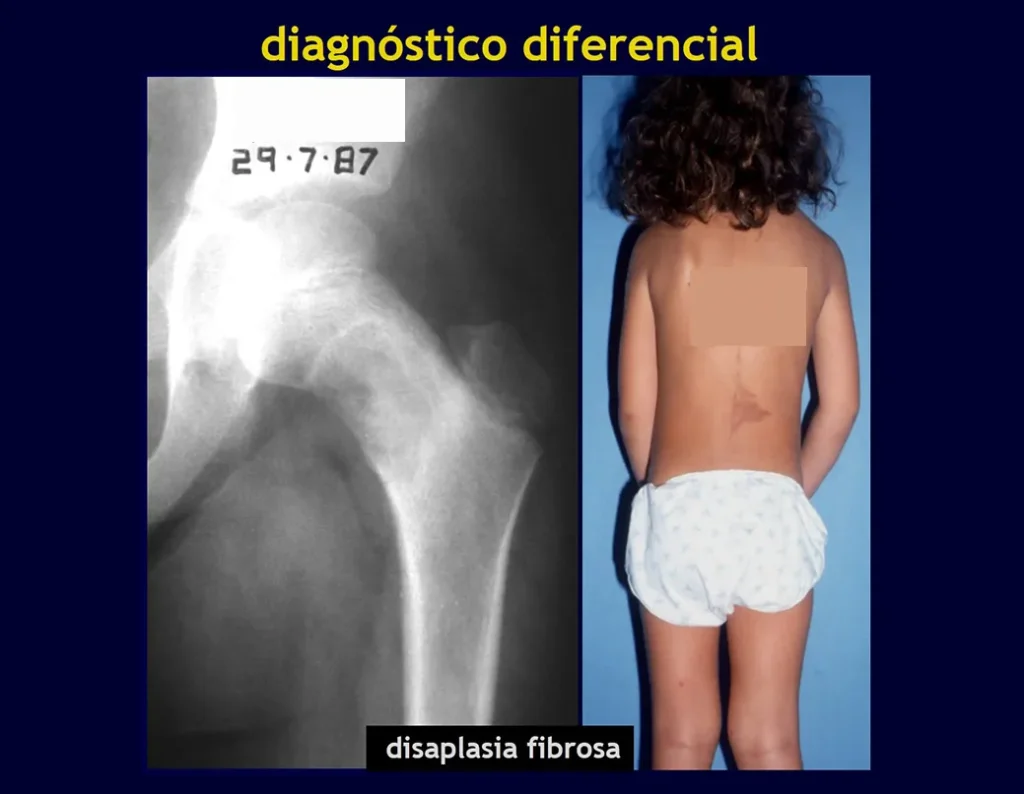
displasia fibrosa
Granuloma eosinofílico
“Miositis osificante”
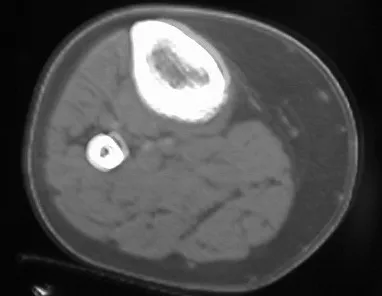
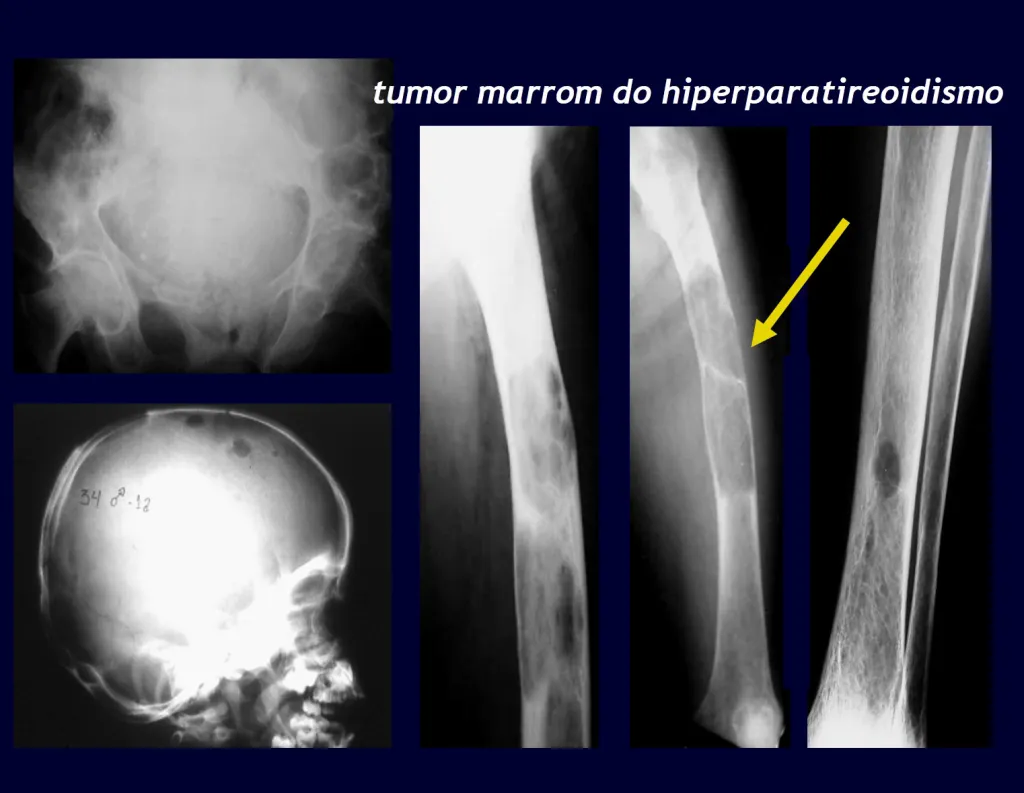
Tumor marrón del hiperparatiroidismo
Quiste epidermoide intraóseo
Granuloma reparativo de células gigantes
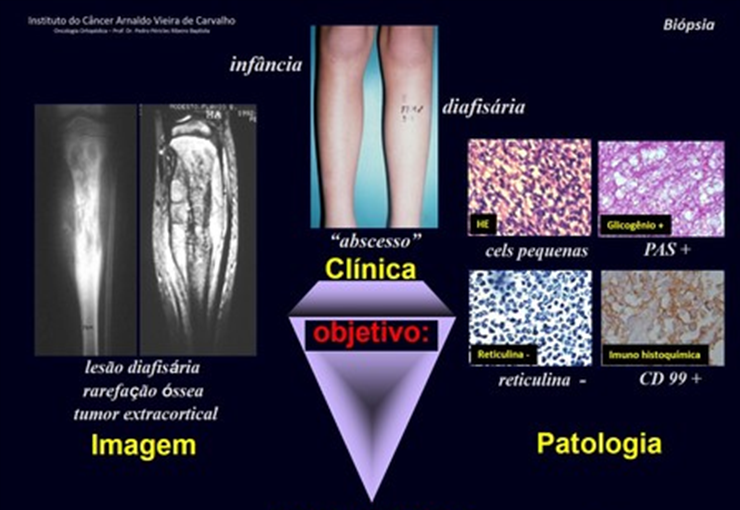
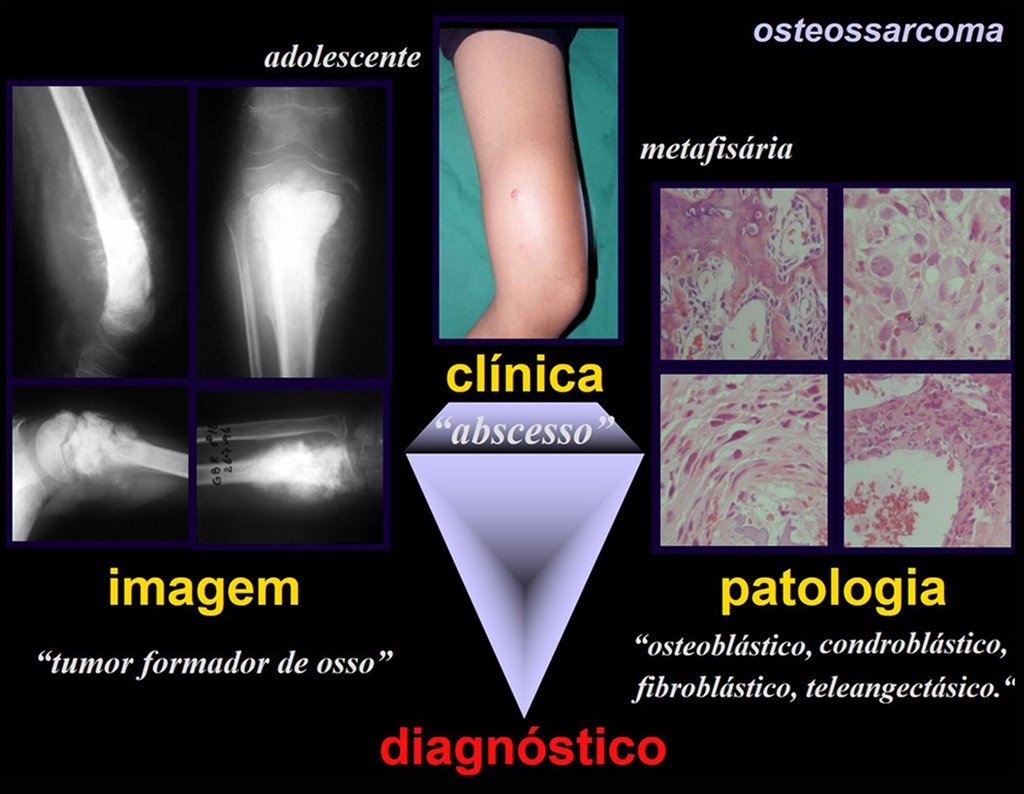
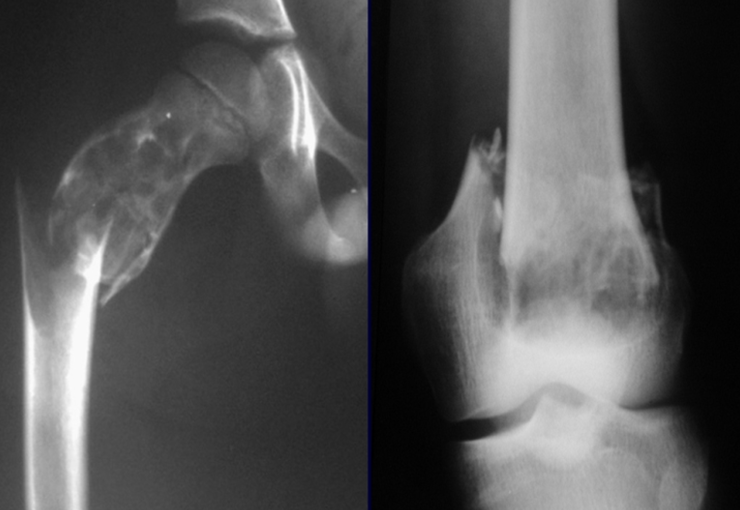
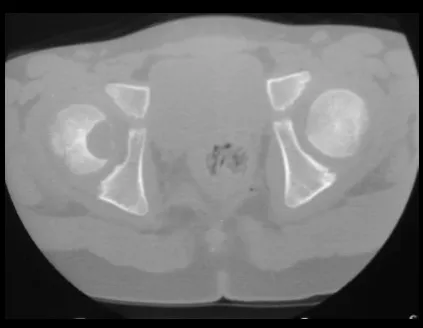
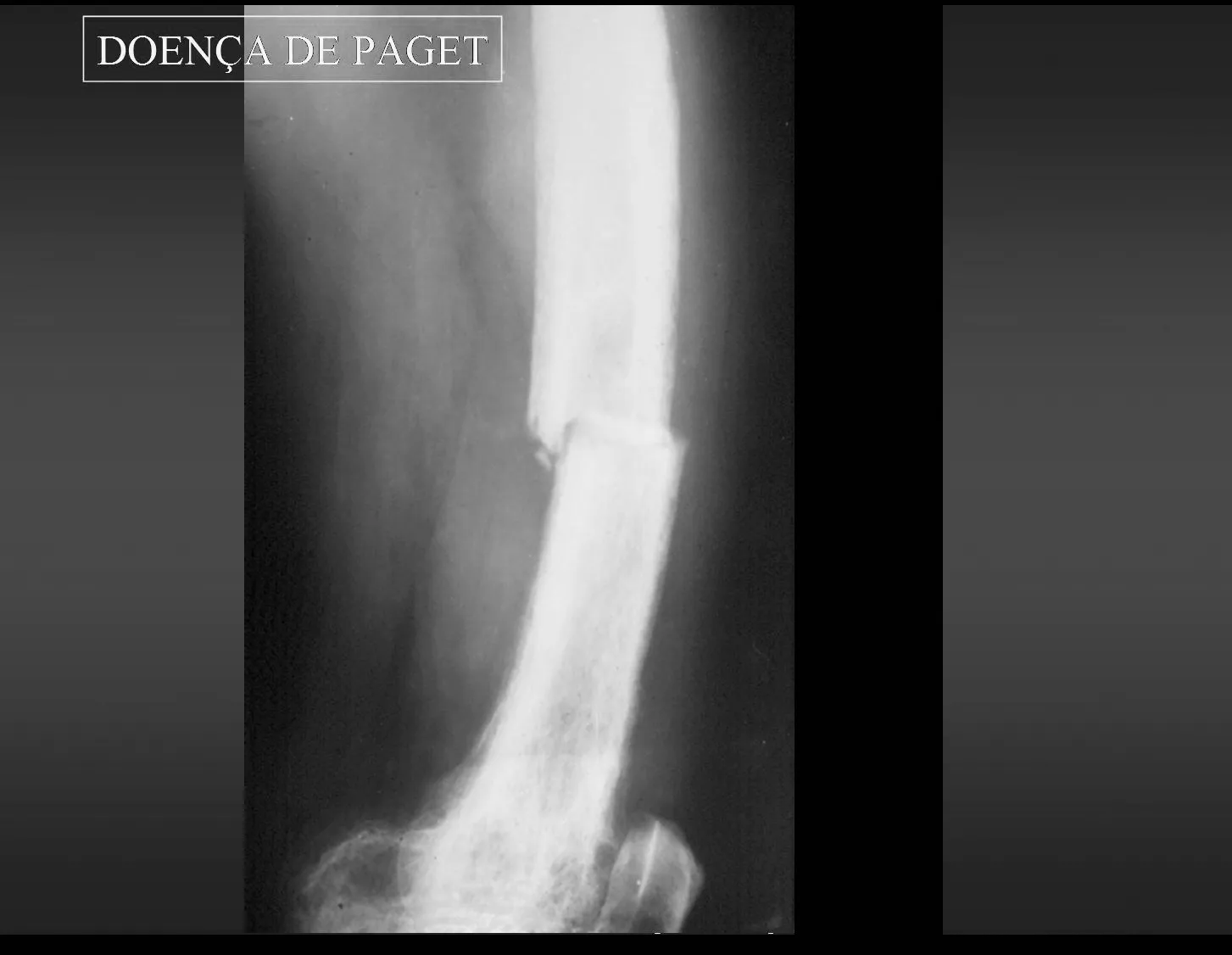
Todas estas lesiones mencionadas tienen particularidades clínicas , características imagenológicas y aspectos histológicos que necesitan ser analizados en conjunto para correlacionar cada una de ellas.
Esto es fundamental, ya que podemos tener lesiones radiológica y/o histológicamente similares pero con diagnósticos diferentes.
Por lo tanto, los estudios de imagen y la histología siempre deben correlacionarse con el cuadro clínico, para el correcto diagnóstico.

En este ejemplo, si el diagnóstico de la biopsia es condrosarcoma, fibrosarcoma o quiste óseo aneurismático, el médico que maneja el caso debe revisarlo con el equipo multidisciplinario o de patología.
Es posible que la biopsia no muestre tejido óseo recién formado y, por lo tanto, no diagnosticará el osteosarcoma condroblástico ni el osteosarcoma fibroblástico, ni el osteosarcoma teleangiectásico.
Cuando el patólogo no tiene datos sobre la historia, el examen físico y las imágenes del paciente, se limita al material que recibió, que es una muestra del tumor. Si tienes acceso a estos datos podrás realizar el diagnóstico correcto, sin necesidad de repetir la biopsia.
La repetición de la biopsia retrasa el tratamiento, aumenta la agresión local y no garantizará la obtención de una muestra con tejido óseo neoformado.
El patólogo no se equivocará si hace el informe sólo con el diagnóstico de lo que está en la diapositiva, cuando no conoce los datos y exámenes del paciente.
Pero el médico que lleva el caso cometerá un gran error si no aclara el caso, pues es él quien tiene todos los datos del paciente, cuadro clínico, historia, examen físico, pruebas de laboratorio y de imagen.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com