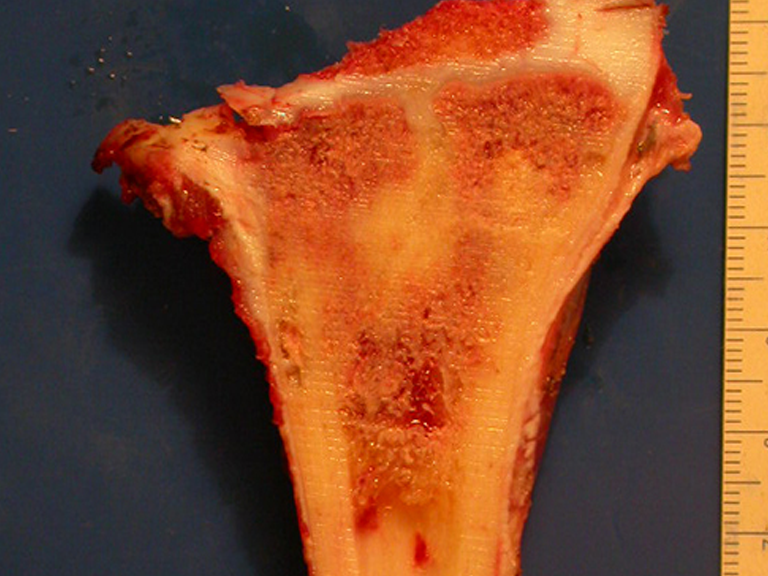
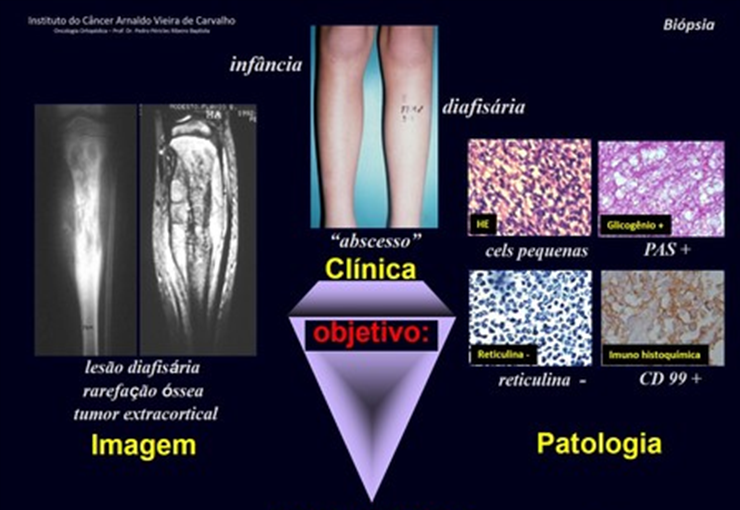
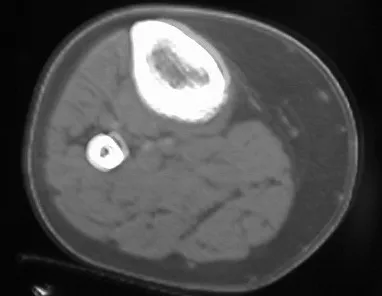
El osteosarcoma de superficie, también conocido como paróstico o yuxtacortical, es aquel que comienza en la superficie del hueso y crece externamente. No hay lesión en la médula ósea y en su superficie tenemos representada la zona de crecimiento tumoral, por tanto la región más inmadura. Tiene dos representaciones histológicas: -a) de bajo grado : prácticamente no hay mitosis atípicas y se asemeja a hueso maduro. Su diagnóstico se confirma mediante pruebas clínicas y de imagen.
Osteosarcoma de superficie
-b) alto grado : presenta las mismas características clínicas pero con atipia y polimorfismo de neoplasia inmadura.
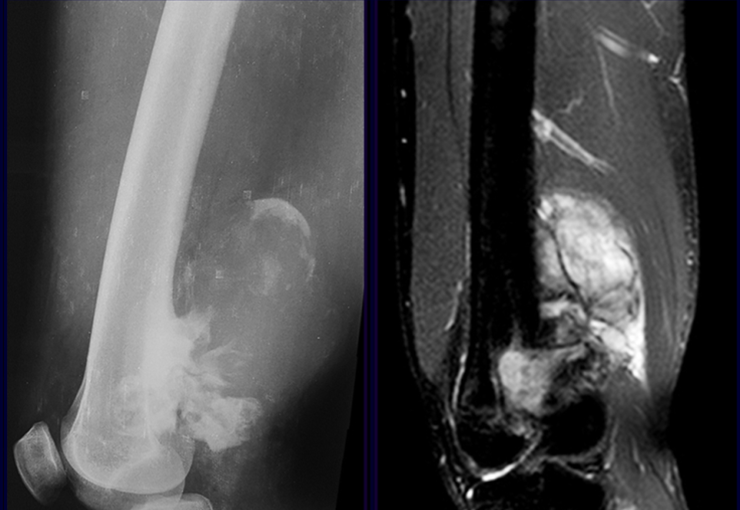
Su manifestación clínica se caracteriza por una evolución lenta , afectando la tercera y cuarta década, presentándose en la región metafisaria posterior y distal del fémur, cavo poplíteo, húmero proximal y radio distal.
Radiológicamente se caracteriza por una lesión densa, de neoformación ósea tumoral, cuya base se encuentra en continuidad con la corteza del hueso afectado. La superficie puede tener una capa cartilaginosa y representa la zona inmadura.
El principal diagnóstico diferencial es la miositis osificante (que presenta inmadurez en el centro de la lesión y cuya periferia es más madura, calcificada).
El tratamiento del osteosarcoma superficial de bajo grado consiste en la resección oncológica de la lesión, que puede ser parieltal parcial o segmentaria, y la reconstrucción con injerto óseo o endoprótesis.
El grado alto se trata como un osteosarcoma central, es decir, quimioterapia – cirugía – quimioterapia.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Osteosarcoma
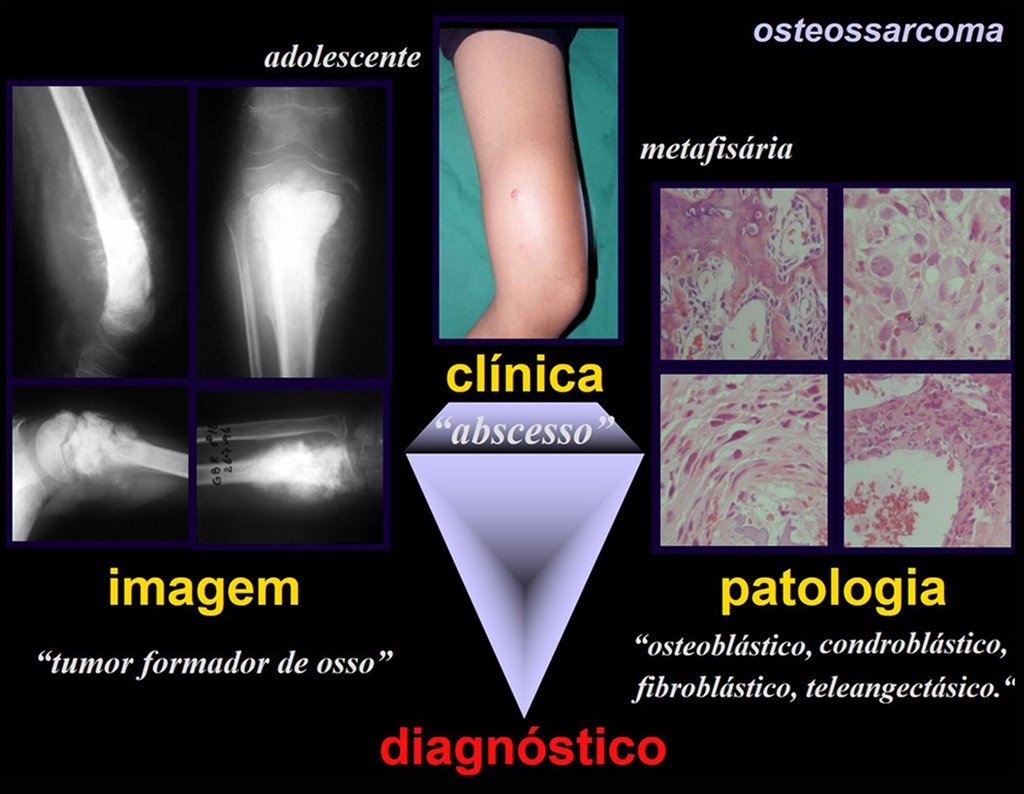
Afecta a personas jóvenes en la primera y segunda década, afectando la región metafisaria de los huesos largos, cercana a la placa de crecimiento. Clínicamente presenta dolor en la región afectada, calor por hiperemia, tumor por aumento de volumen local más alguna limitación funcional .
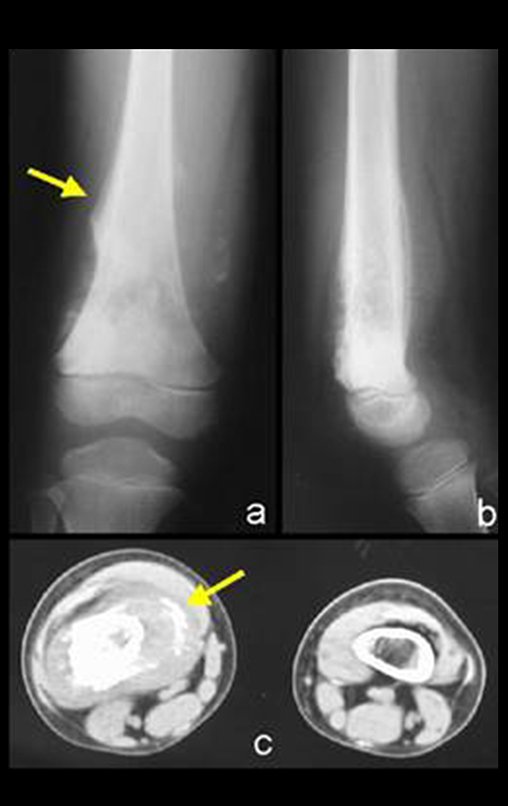
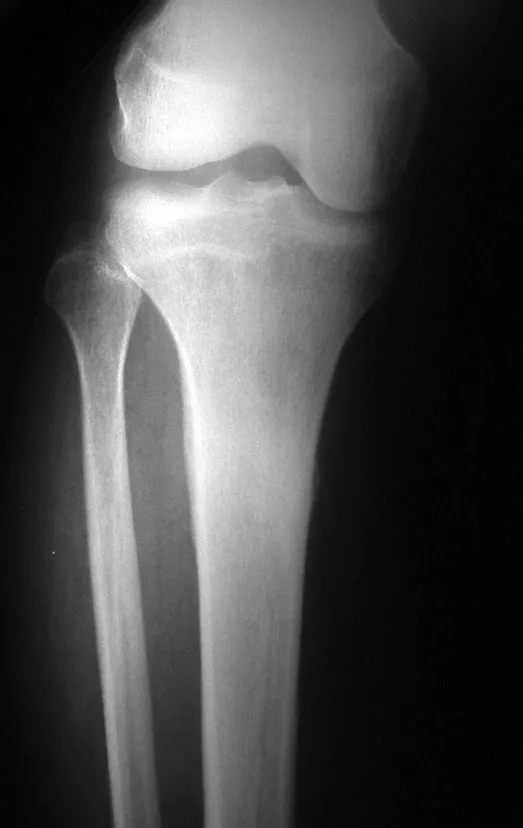
Radiográficamente presenta una lesión en la región metafisaria caracterizada por áreas de formación de hueso nuevo intercaladas con áreas de rarefacción ósea, de límites imprecisos, con erosión cortical y una reacción perióstica laminar delgada, formando el triángulo de Codman. La presencia del triángulo de Codman denota la existencia de un tumor extracortical.
El triángulo de Codman (figura 2) es un signo radiológico que se presenta en otras afecciones como osteomielitis, granuloma eosinofílico, sarcoma de Ewing y otros tumores. Puede aparecer siempre que se produce una lesión dentro de un hueso y crece fuera de él. Cuando la lesión (o pus en la osteomielitis) sobrepasa el hueso cortical, provoca el desprendimiento del periostio que estaba adherido al hueso cortical. Por tanto, la lesión crece y este desprendimiento estimula el periostio para que produzca hueso. De esta forma se produce una capa de mineralización como si se formara una neocortical. Este proceso puede ocurrir de forma sucesiva, formando verdaderas capas (lamellas) (figuras 3a y 3b). Estas capas pueden ser delgadas (reacción perióstica laminar delgada, que caracteriza la velocidad de crecimiento de la lesión) o gruesas (reacción perióstica laminar gruesa, que caracteriza el crecimiento lento) . A medida que avanza la lesión, este intento de “barrera” se rompe y radiográficamente aparece un triángulo delimitado externamente por el periostio (que fue sucesivamente desprendido y eliminado de la corteza ósea), internamente por la corteza ósea y en la base por el tumor en expansión.
El estudio imagenológico de la lesión puede ser más detallado mediante tomografía (figura 3c), que permite evaluar la erosión de la corteza ósea y la afectación extracortical. La resonancia magnética es importante para definir la extensión del tumor, tanto en la zona medular como extracortical (figuras 4d, 4e y 4f). Este examen también permite evaluar la relación entre el tumor y las partes blandas (músculos, vasos y nervios) y es fundamental para la planificación quirúrgica.
El tratamiento actual del osteosarcoma consiste en poliquimioterapia preoperatoria, durante aproximadamente 3 a 4 ciclos, seguida de resección completa del tumor y complementada con quimioterapia posoperatoria. Actualmente es posible resecar el tumor (figuras 5, 6 y 7) y reconstruir el segmento afectado con prótesis o soluciones biológicas (figura 6) (injerto óseo autólogo u homólogo). Las cirugías ablativas (amputaciones) se reservan para casos de tumor avanzado, de gran volumen, que compromete la piel y/o el haz vascular-nervioso o en aquellos casos que no obtuvieron buena respuesta a la quimioterapia preoperatoria y cuya resección conservadora, con preservación de la extremidad, implica un riesgo de recurrencia local de la lesión.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
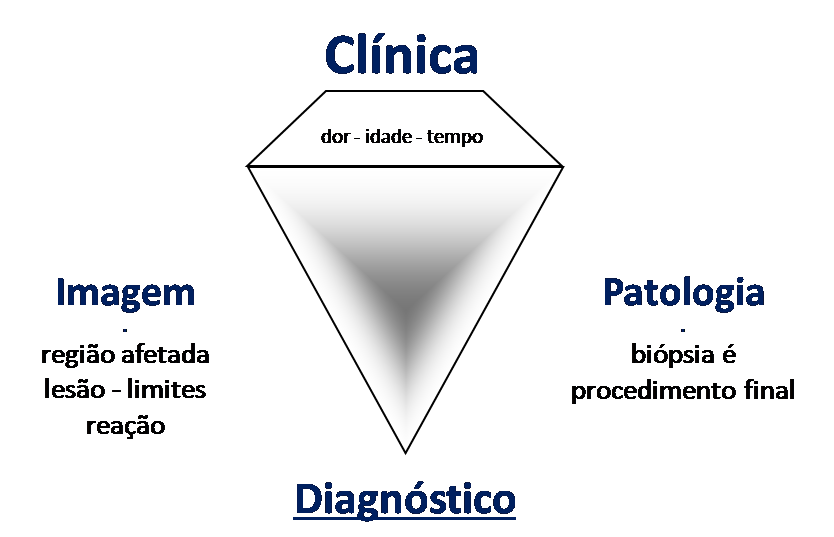
Introducción al estudio de los tumores óseos. La filosofía de este capítulo es presentar nuestra experiencia y una forma de razonamiento objetivo. Para tratarlo, primero hay que realizar el diagnóstico correcto.
Iniciamos el abordaje de los tumores óseos buscando transmitir “cómo pienso” sobre las lesiones musculoesqueléticas.
Introducción al estudio de los tumores óseos
En primer lugar, debemos enmarcar la condición que estamos evaluando dentro de uno de los cinco capítulos principales de Patología:
1- MALFORMACIONES CONGÉNITAS
2- TRASTORNOS CIRCULATORIOS
3- PROCESOS DEGENERATIVOS
4- INFLAMATORIO
5- NEOPLASICOS
Si el caso fue clasificado dentro del capítulo de neoplasias, nuestro objetivo es establecer el diagnóstico para poder instaurar el tratamiento. Es fundamental establecer un diagnóstico certero.
Para ser diagnosticado es necesario conocer y aprender el universo de tumores ya descritos.
¿No somos ya conscientes, como estudiantes de medicina, de todas las neoplasias musculoesqueléticas?
Solemos transmitir, en nuestras clases, que nuestro cerebro puede almacenar información de forma aleatoria. Sin embargo, si cuando asimilamos conocimientos intentamos hacerlo de forma ordenada, quedará “almacenado” en “carpetas”, estas en “cajones” y tendremos un “ archivo ” . De esta manera podremos recuperar la información más fácilmente.
Por lo tanto, lo ayudaremos a construir este archivo, organizando el “HD” .
En primer lugar, debemos recordar que la neoplasia se origina a partir de una célula que ya existe en nuestro cuerpo. Esta célula, al reproducirse, sufre cambios en su código genético, debido a diferentes factores (radiaciones, virus, mutaciones, translocaciones, etc.) y esta luego se convierte en la “ célula madre ” de la neoplasia.
Como ya aprendimos histología en la Facultad, conocemos todas las posibles neoplasias. Sólo nos falta añadir algunos conceptos para nombrar y clasificar con seguridad todos los tumores ya descritos.
El término carcinoma se reservó para las neoplasias malignas cuyas células primitivas se originan en la capa ectodérmica y sarcoma para las del mesodermo.
Si tomamos como ejemplo nuestro muslo y hacemos un ejercicio recordando todas las células que lo componen, empezando por la piel y profundizando en el tejido subcutáneo, músculos, etc., hasta la médula ósea del fémur, conseguiremos Hemos revisado todas las células del aparato locomotor y por tanto podremos nombrar todas las neoplasias musculoesqueléticas.
Hagamos este ejercicio. Empezando por la piel, recordamos el carcinoma de células escamosas , el carcinoma de células basales y el melanoma . Estas neoplasias son tratadas con mayor frecuencia por dermatólogos y cirujanos plásticos y rara vez requieren la ayuda de un ortopedista.
Debajo de la piel, todas las estructuras derivan del mesodermo y por ello añadiremos el sufijo oma para las lesiones benignas y sarcoma para las malignas .
Por tanto, debajo de la piel tenemos el tejido celular subcutáneo (grasa) cuya célula más representativa es el lipocito. Si la lesión está formada por células parecidas al típico lipocito, tendremos un lipoma , formado por células desordenadas, con mitosis atípicas, un liposarcoma . En este mismo tejido subcutáneo tenemos fibroblastos, fibrohistiocitos y en consecuencia fibroma , fibrosarcoma , fibrohistiocitoma de bajo y alto grado de malignidad.
Otra estructura que conforma nuestro muslo son los músculos estriados, (músculos voluntarios), dando lugar así al rabdomiosarcoma . Los músculos lisos, que se encuentran en el aparato locomotor, se sitúan alrededor de los vasos y, aunque son raros, también encontramos leiomiosarcoma .
El tejido nervioso está representado aquí por los axones de los nervios periféricos. Estos axones tienen una vaina, cuyas células fueron descritas por Schwann, a partir de las cuales puede originarse el schwannoma .
En los tejidos blandos, recordándose, como derivados del tejido linfático, el linfangioma y el linfangiosarcoma ; tejido vascular, hemangioma y angiosarcoma .
El hueso está recubierto por el periostio, cuya función es formar tejido óseo, además de proteger, inervar y nutrir. El trauma puede conducir a la formación de un hematoma subperióstico que, si se produce una osificación madura y homogénea, puede traducirse como un periosteoma (“osteoma”). De esta misma superficie ósea se puede derivar un osteosarcoma de superficie de bajo grado conocido como osteosarcoma paraóstico (grado I) así como un osteosarcoma de alto grado .
En nuestro ejercicio llegamos ahora a la región medular del hueso. Esta región está formada por grasa, que luego puede dar lugar al liposarcoma intraóseo y a la médula ósea roja, de la que podemos tener todas las neoplasias del ERS ( Sistema Retículo Endotelial ) como el mieloma de células plasmáticas , el linfoma linfocítico , el sarcoma de Ewing .
Si recordamos, en lo más profundo de nuestra memoria, la histología de la osificación endocondral, encontraremos varias células precursoras. Uno de ellos es el grande (gigante) formado por células con varios núcleos, responsables de la resorción ósea, el osteoclasto y en consecuencia tenemos el osteoclastoma , más conocido como tumor de células gigantes ( TCG ). Del condroblasto el condroblastoma ; osteoblasto , osteoblastoma ; del condrocito el condroma , el condrosarcoma ; y así sucesivamente, podremos deducir todas las neoplasias descritas. Bastará nombrarlas en base al conocimiento de la célula normal, añadiendo oma a la lesión benigna y sarcoma a la maligna.
Consideramos importante esta forma de introducción, ya que así nos ayudará mejor a recordar lo que ya sabemos y llegar al diagnóstico.
La Organización Mundial de la Salud agrupa estas lesiones según el tejido que intentan reproducir, clasificándolas en:
I – Tumores que forman tejido óseo
Benigno: Osteoma – Osteoma osteoide – Osteoblastoma
Intermedio : Osteoblastoma agresivo
Maligno : Osteosarcoma central – Paróstico – Perióstico – Alto grado
II – Tumores formadores de cartílago
Benigno : Condroma (encondroma) – Osteocondroma – Condroblastoma – Fibroma condromixoide
Maligno : Primario – Secundario – Yuxtacortical – Mesenquimatoso – Desdiferenciado – Condrosarcoma de células claras
III – Tumores de Células Gigantes (TCG) (Osteoclastoma)
IV – Tumores de Médula Ósea
Maligno : Sarcoma de Ewing – Linfoma linfocítico – Mieloma de plasmocitos – PNET
V – Tumores Vasculares
Benigno : Hemangioma – Linfangioma – Tumor glómico
Intermedio : Hemangioendotelioma – Hemangiopericitoma
Maligno : angiosarcoma
VI – Tumores del Tejido Conectivo
Benigno : Fibroma – Lipoma – Fibrohistiocitoma
Maligno : Fibrosarcoma – Liposarcoma – Fibrohistiocitoma maligno – Leiomiosarcoma – Sarcoma indiferenciado
VII – Otros tumores
Benigno : Schwannoma – Neurofibroma
Maligno : Cordoma – Adamantinoma de huesos largos.
VIII – Tumores metastásicos en el hueso
Carcinomas: mama, próstata, pulmón, tiroides, riñón, neuroblastoma, melanoma, etc.
IX – Lesiones pseudotumorales
Quiste óseo simple (COS)
Quiste óseo aneurismático (AOC)
Quiste óseo yuxtaarticular (ganglio intraóseo)
Defecto fibroso metafisario (fibroma no osificante)
displasia fibrosa
Granuloma eosinofílico
“Miositis osificante”
Tumor marrón del hiperparatiroidismo
Quiste epidermoide intraóseo
Granuloma reparativo de células gigantes
Todas estas lesiones mencionadas tienen particularidades clínicas , características imagenológicas y aspectos histológicos que necesitan ser analizados en conjunto para correlacionar cada una de ellas.
Esto es fundamental, ya que podemos tener lesiones radiológica y/o histológicamente similares pero con diagnósticos diferentes.
Por lo tanto, los estudios de imagen y la histología siempre deben correlacionarse con el cuadro clínico, para el correcto diagnóstico.

En este ejemplo, si el diagnóstico de la biopsia es condrosarcoma, fibrosarcoma o quiste óseo aneurismático, el médico que maneja el caso debe revisarlo con el equipo multidisciplinario o de patología.
Es posible que la biopsia no muestre tejido óseo recién formado y, por lo tanto, no diagnosticará el osteosarcoma condroblástico ni el osteosarcoma fibroblástico, ni el osteosarcoma teleangiectásico.
Cuando el patólogo no tiene datos sobre la historia, el examen físico y las imágenes del paciente, se limita al material que recibió, que es una muestra del tumor. Si tienes acceso a estos datos podrás realizar el diagnóstico correcto, sin necesidad de repetir la biopsia.
La repetición de la biopsia retrasa el tratamiento, aumenta la agresión local y no garantizará la obtención de una muestra con tejido óseo neoformado.
El patólogo no se equivocará si hace el informe sólo con el diagnóstico de lo que está en la diapositiva, cuando no conoce los datos y exámenes del paciente.
Pero el médico que lleva el caso cometerá un gran error si no aclara el caso, pues es él quien tiene todos los datos del paciente, cuadro clínico, historia, examen físico, pruebas de laboratorio y de imagen.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Fracturas en niños con afecciones óseas preexistentes
Este capítulo tiene como objetivo abordar más específicamente las fracturas que se desarrollan en niños con tales afecciones. Es importante resaltar que el alcance de este tema es amplio, lo que nos lleva a definir los temas a tratar.
Decidimos no incluir en este capítulo las fracturas relacionadas con procesos infecciosos o trastornos metabólicos, como el raquitismo o la osteopsatirosis. En cambio, nos centraremos en las fracturas por estrés, considerando el diagnóstico diferencial, así como en aquellas que surgen de lesiones óseas tumorales o pseudotumorales preexistentes.
Las fracturas por estrés son particularmente relevantes debido a su naturaleza y los desafíos asociados con el diagnóstico y el tratamiento. Además, las fracturas resultantes de lesiones óseas tumorales o pseudotumorales requieren un abordaje especializado para garantizar un tratamiento adecuado y el mejor pronóstico posible.
Por ello, al delinear este capítulo buscamos brindar una visión integral de las fracturas en niños con afecciones óseas preexistentes, destacando los aspectos más relevantes para su comprensión y manejo clínico.
Tumores óseos benignos:
Entre las lesiones tumorales benignas de la infancia, que con mayor frecuencia pueden provocar fracturas, destacamos el osteoblastoma y el condroblastoma.
Osteoblastoma –
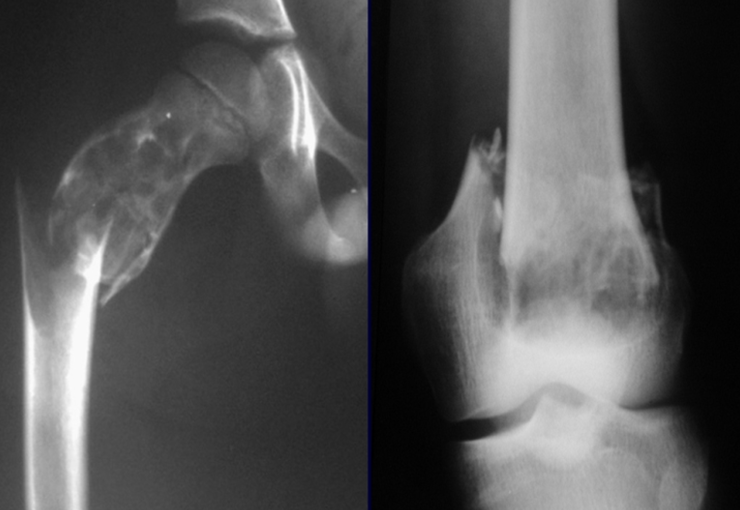
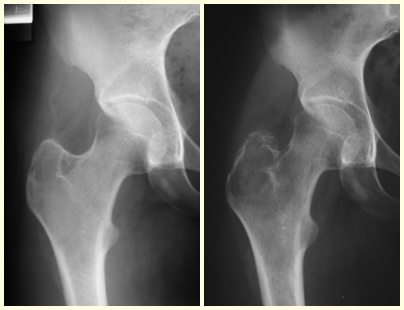
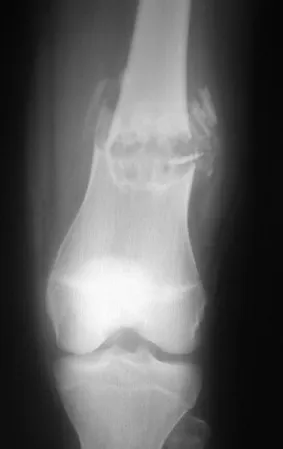
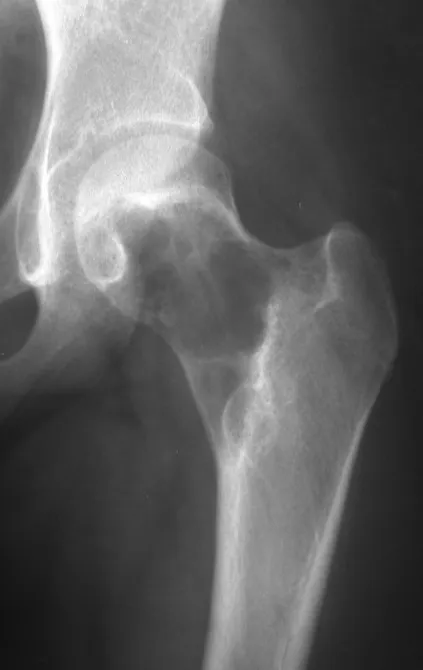
El osteoblastoma es un tumor óseo localmente agresivo que en huesos largos tiene una localización metafisaria, inicialmente cortical y excéntrica. Esta lesión, al ser localmente agresiva, con gran destrucción de la estructura ósea, provoca microfracturas, por erosión del hueso cortical (figs. 1 y 2). La destrucción progresiva de la corteza predispone a la fractura completa, cuando la afectación supera el cincuenta por ciento de la circunferencia ósea. La fractura de esta lesión facilita la diseminación local, dificultando el tratamiento oncológico, que requiere reconstrucciones elaboradas y limita la recuperación funcional (figs. 3 y 4).
Condroblastoma –
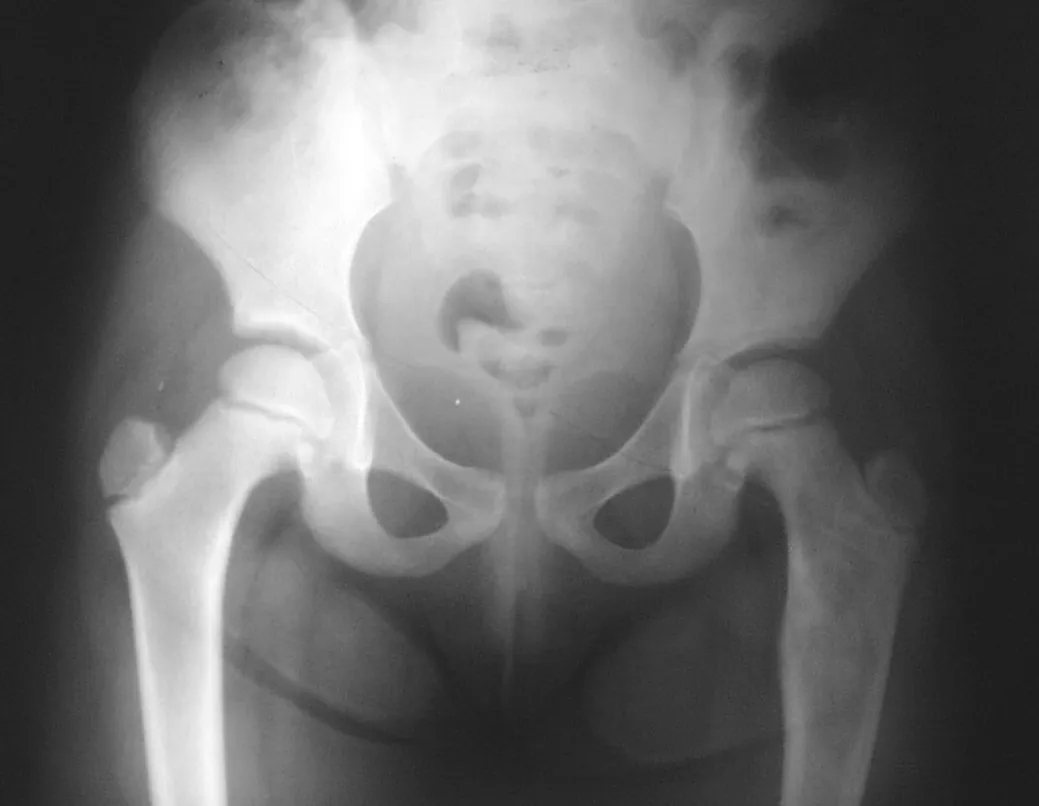
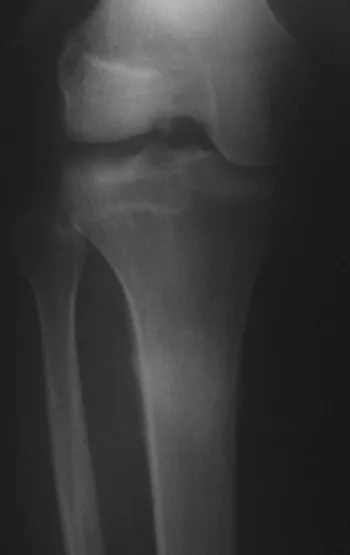
El condroblastoma afecta la región epifisaria de los huesos largos en crecimiento (figs. 7 y 8) y, con menor frecuencia, la porción apofisaria (figs. 9 y 10).
Este tumor óseo provoca reabsorción de la epífisis (o apófisis), erosión de la corteza ósea e invasión articular, dando lugar a artralgia, que puede provocar deformidad y fractura por hundimiento articular.
El tratamiento tanto del osteoblastoma como del condroblastoma es quirúrgico y debe realizarse lo antes posible, ya que estas lesiones, a pesar de ser histológicamente benignas, progresan rápidamente hasta la destrucción de la estructura ósea local.
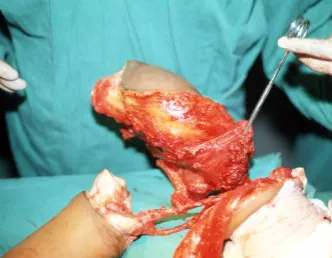
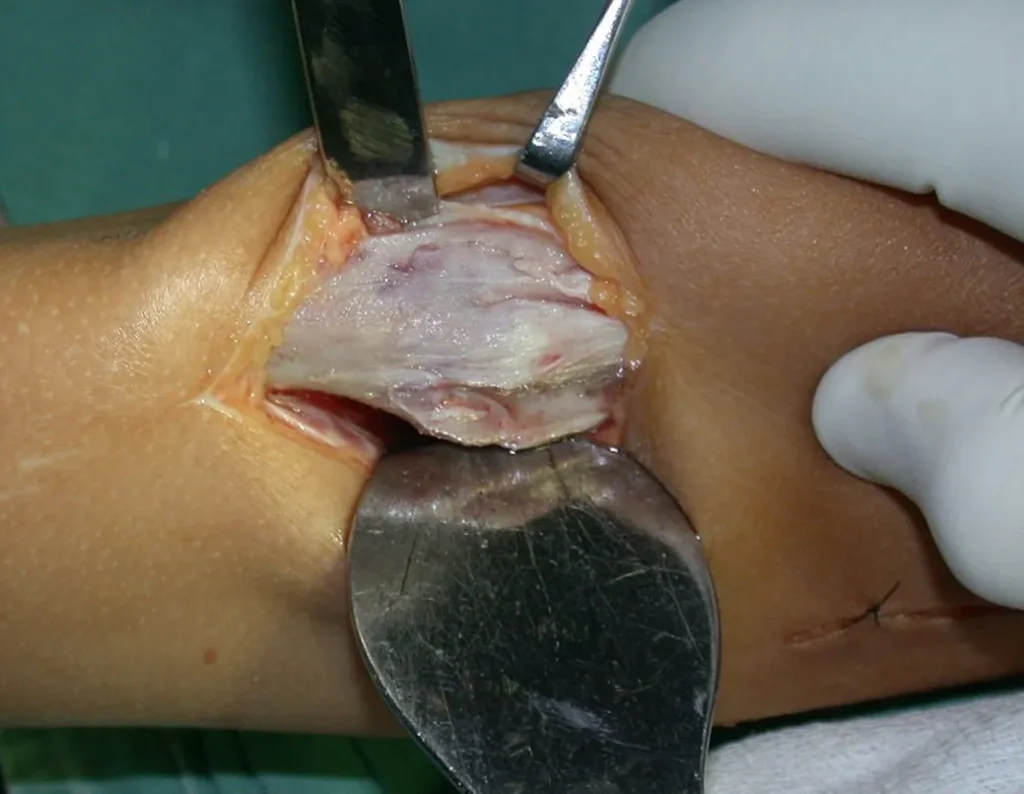
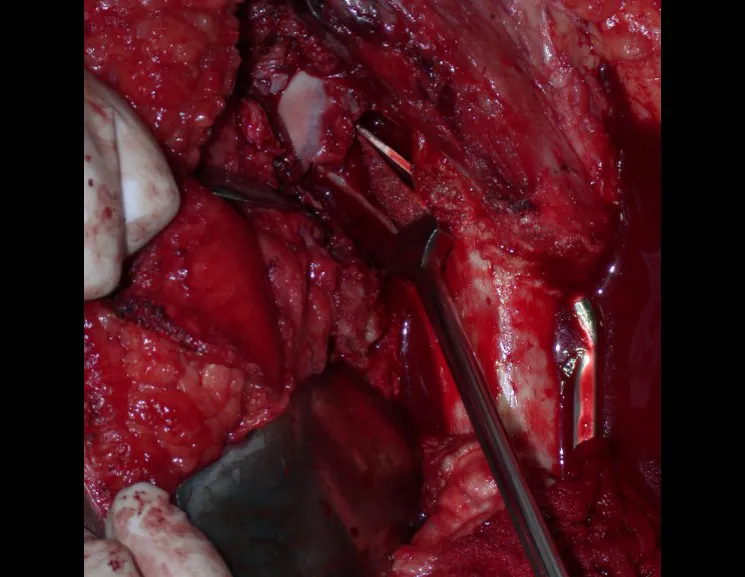
La mejor indicación para evitar la recurrencia local es la resección segmentaria. Sin embargo, debido a la localización articular del condroblastoma, es preferible proporcionar un acceso quirúrgico adecuado a cada región, como en este ejemplo que afecta a la región posteromedial de la cabeza femoral (fig. 11), para realizar un cuidadoso legrado intralesional, seguido de adyuvante local, como fenol, nitrógeno líquido o electrotermia (fig. 12), para posteriormente rellenar la cavidad con un injerto óseo autólogo, restaurando la anatomía de la región (fig. 13) y restableciendo la función (figs 14 y 15) .
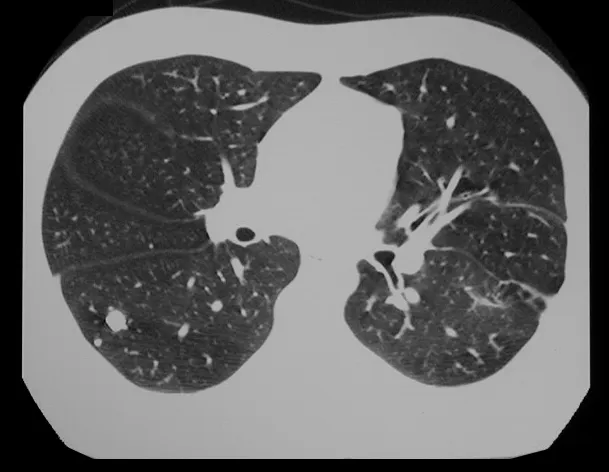
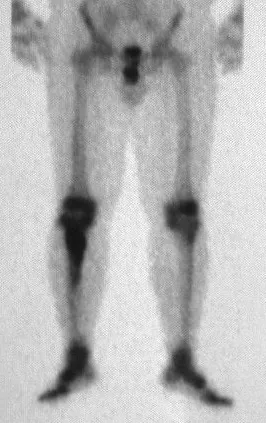
El condroblastoma, a pesar de ser una lesión benigna, además de la recurrencia local, puede evolucionar a metástasis pulmonares (fig. 16 y 17) que permanecen histológicamente benignas, lo que hace controvertida la indicación de quimioterapia adicional.
En nuestra experiencia tuvimos dos casos de osteoblastoma y un caso de condroblastoma con enfermedad pulmonar secundaria. En este caso de condroblastoma se realizó toracotomía y se encontraron numerosos nódulos pulmonares, que persisten hasta el día de hoy. Este paciente, en el momento del diagnóstico de metástasis, presentaba osteopatía pulmonar hipertrófica. No realizó ningún tratamiento complementario y se encuentra asintomático hasta el día de hoy, trece años después (fig. 18 y ’19) y quince años después de la cirugía (fig. 20 y 21).
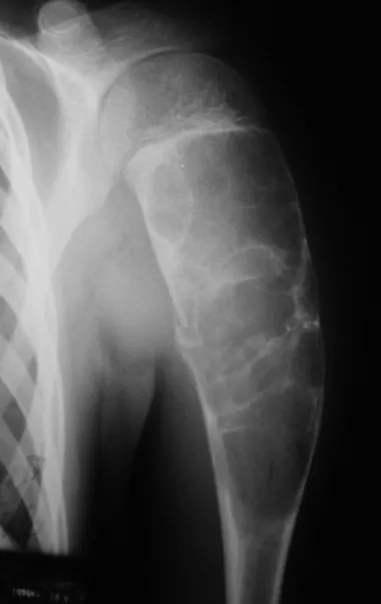
Tumores óseos malignos:
Las neoplasias óseas malignas más frecuentes en la infancia son el osteosarcoma y el sarcoma de Ewing, que deben diagnosticarse al inicio de los síntomas, ya que provocan dolor y un tumor palpable y deben tratarse tempranamente.
Osteosarcoma –
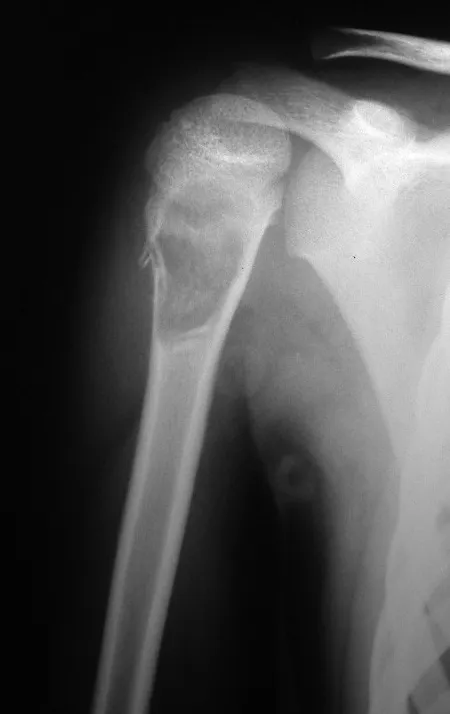
En nuestro país no es raro que el osteosarcoma se presente con una fractura en el momento del diagnóstico (figs. 22 y 23).
Sarcoma de Ewing –
El sarcoma de Ewing es un tumor óseo maligno que puede confundirse con osteomielitis y diagnosticarse tras una fractura (figs. 30 a 36).
Haga clic aquí para ver el caso completo
En los niños, los casos de neoplasias malignas que provocan fracturas son, afortunadamente, raros.
Lesiones óseas pseudotumorosas:
Las lesiones óseas que con mayor frecuencia acompañan a las fracturas en niños son las lesiones pseudotumorales, con énfasis en los quistes óseos simples, quistes óseos aneurismáticos, displasia fibrosa y granulomas eosinofílicos, en este orden de frecuencia.
Granuloma eosinofílico –
El granuloma eosinofílico se presenta como una afección inflamatoria local y una lesión con rarefacción ósea acompañada de una reacción perióstica laminar espesa, que es una característica radiológica de benignidad. Otro aspecto del granuloma eosinofílico es que presenta una zona de enrarecimiento del hueso sin su correspondiente afectación extraósea (fig. 37), distinguiéndolo del sarcoma de Ewing, que es el tumor que más tempranamente presenta un tumor extracortical. .
El granuloma eosinofílico puede presentarse con un cuadro clínico de fractura cuando afecta la columna vertebral donde se produce una fractura en cuña del cuerpo vertebral, descrita como vértebra plana de Calvé (fig. 38). En esta situación, esta lesión puede progresar hasta la curación espontánea, pudiendo incluso producirse la restauración del cuerpo vertebral.
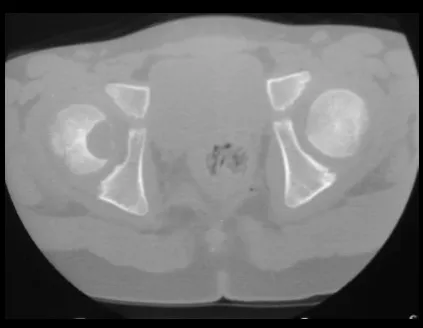
Otras localizaciones donde pueden producirse microfracturas son cuando afectan a la región supraacetabular (fig. 39), o en zonas de carga como la porción metafisaria proximal del fémur (fig. 40), debido a la erosión cortical medial. .
Esta lesión responde bien al tratamiento quirúrgico de legrado simple, siendo excepcional la necesidad de añadir un injerto óseo.
Displasia fibrosa –
La displasia fibrosa es una lesión pseudotumoral que con mayor frecuencia conduce a deformidad ósea. Sin embargo, cuando afecta al fémur, puede provocar una deformidad previa, en forma de cayado de pastor, característica de esta patología, con la consiguiente fractura (fig. 41). La región del cuello femoral con displasia fibrosa a menudo desarrolla una fractura, incluso sin deformidad previa (fig. 42).
Para corregir el defecto es necesario raspar la lesión, rellenarla con injerto óseo autólogo y osteotomías correctoras de la deformidad (fig. 43). Una fractura en esta localización puede ser de difícil resolución, debido a la dificultad de consolidación por el aspecto displásico del hueso (fig. 44), provocando recurrencia de la enfermedad y deformidad.
La displasia fibrosa también puede formar parte de la pseudoartrosis congénita, que afecta con mayor frecuencia al tercio distal de la tibia, pero puede presentarse en otras localizaciones como el tercio proximal de la tibia (figuras 52, 53 y 54), con todas las dificultades para alcanzarla. si es consolidación.
La pseudoartrosis congénita es una afección que merece ser estudiada en un capítulo aparte.
Quiste óseo aneurismático –
El quiste óseo aneurismático, también llamado quiste hemático multilocular, es una lesión de rarefacción ósea insuflativa llena de líquido serosanguinolento, intercalada con espacios de tamaño variable y separada por septos de tejido conectivo que contienen trabéculas de tejido óseo o osteoide y células gigantes ostoclásticas (figs. 55 y 56).
El paciente generalmente presenta dolor leve en el sitio de la lesión, cuando el hueso afectado es superficial, y se pueden observar signos inflamatorios como aumento de volumen y calor. Generalmente, el paciente correlaciona la aparición de los síntomas con algún trauma.
En la evolución puede haber un aumento lento, progresivo o rápidamente expansivo. Afecta a cualquier hueso, con mayor frecuencia a los miembros inferiores, tibia (figs. 57 y 58) y fémur representando el 35% de los casos.
Las vértebras también se ven afectadas por esta lesión, incluido el sacro. En la pelvis, la rama iliopúbica es la más frecuentemente afectada. Pueden imitar síntomas articulares cuando llegan a la epífisis. El compromiso en la columna puede provocar síntomas neurológicos compresivos, aunque en la mayoría de los casos afecta a las estructuras posteriores.
El tratamiento de elección ha sido la resección marginal o legrado intralesional, seguido de relleno de la cavidad con injerto autólogo u homólogo, cuando sea necesario. La cavidad también se puede rellenar con metilmetacrilato, aunque preferimos utilizar un injerto autólogo cuando sea posible, al tratarse de una lesión benigna. Algunos autores asocian el tratamiento adyuvante intralesional con la aplicación de fenol, electrotermia o crioterapia. En los quistes óseos aneurismáticos clásicos, no veo el sentido de esta terapia, que, sin embargo, debería aplicarse cuando el cirujano encuentra un área “sospechosa” que no fue detectada en las imágenes. Si se trata de tumores benignos antes mencionados, que pueden acompañarse de áreas de quiste óseo aneurismático, la terapia adyuvante local será beneficiosa.
Algunos segmentos óseos como los extremos del peroné, clavícula, costilla, tercio distal del cúbito, radio proximal, etc. se pueden resecar, sin necesidad de reconstrucción.
En otras situaciones podemos necesitar reconstrucciones segmentarias con injertos óseos libres o incluso vascularizados o reconstrucciones articulares con prótesis en casos avanzados con afectación articular importante. En la columna, tras la resección de la lesión, puede ser necesaria una artrodesis para evitar la inestabilidad.
La radioterapia debe evitarse por el riesgo de malignidad, sin embargo puede estar indicada para el control evolutivo de lesiones en localizaciones de difícil acceso, como la columna cervical, por ejemplo, u otras situaciones en las que no se recomienda la reintervención quirúrgica.
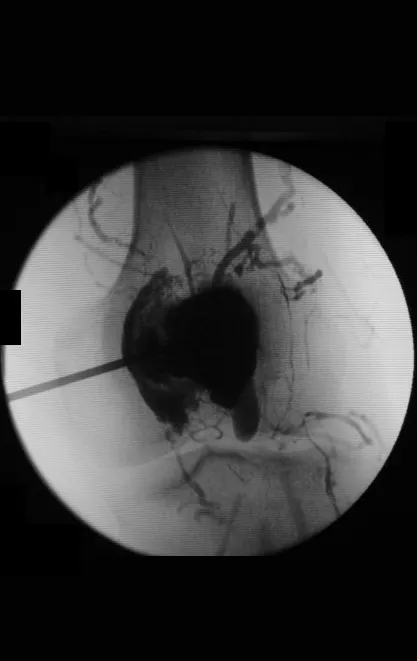
La embolización como terapia aislada es controvertida. Sin embargo, se puede utilizar antes de la operación para minimizar el sangrado durante la cirugía. Esta práctica es más utilizada en casos de difícil acceso, aunque no siempre se consigue su eficacia. En casos aislados se ha descrito infiltración con calcitonina con resultados satisfactorios.
Puede ocurrir una recurrencia, ya que se desconoce el fenómeno que causó el quiste y no podemos garantizar que la cirugía lo haya reparado. La tasa de recurrencia puede alcanzar el treinta por ciento de los casos.
Quiste óseo simple –
Un quiste óseo simple es una lesión pseudotumoral que puede ocurrir en cualquier parte del esqueleto y que con mayor frecuencia se presenta con fractura (figuras 59 a 64).
Un quiste óseo simple en ocasiones puede diagnosticarse por un aumento de volumen, pero cuando presenta un síntoma doloroso, generalmente se relaciona con microfracturas o muchas veces con una fractura completa.
El húmero es el hueso más afectado. Las microfracturas pueden eventualmente proporcionar una “cura” parcial en algunas áreas del quiste y con el crecimiento la metáfisis se aleja de la lesión, que comienza a ocupar la zona diafisaria (fig. 65 y 66). Esta progresión hacia la diáfisis puede ocurrir de forma asintomática y puede ocurrir de forma aguda una nueva manifestación clínica dolorosa (fig. 67).
En estas situaciones, el tratamiento adoptado debe ser el adecuado al hueso y a la fractura en cuestión, pudiendo ser cerrado o abierto, dependiendo únicamente de las necesidades específicas de la fractura la indicación de relleno con injerto óseo, cuando esté indicado el tratamiento quirúrgico. .
En los quistes óseos maduros, la fractura completa provoca una gran descompresión de la lesión y se puede conseguir simultáneamente la consolidación y curación de la lesión. Sin embargo, en algunos casos, es necesario un tratamiento adicional del quiste, después de la consolidación de la fractura, cuando se elige el tratamiento cerrado (fig. 72 a 78).
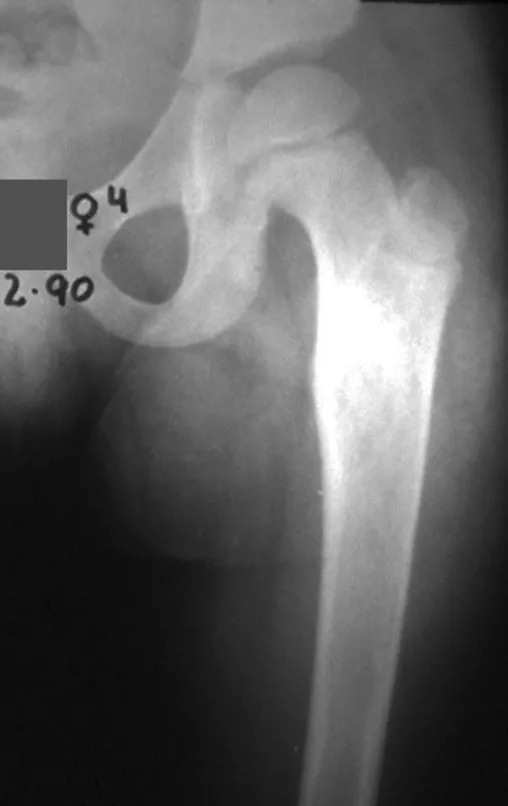
Algunas localizaciones, como el cuello femoral, merecen especial atención y preferiblemente deben operarse antes de que se produzca una fractura (fig. 87 y 88).
Haga clic aquí para ver el caso completo
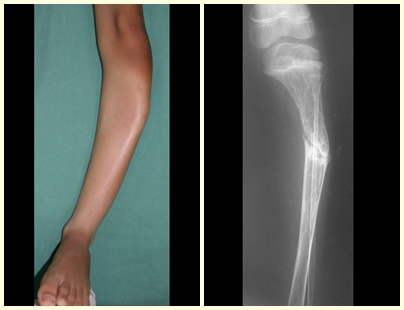
Fractura por estrés –
Las fracturas por estrés merecen especial atención en este artículo tanto por ser más frecuentes de lo reportado en la literatura, ya que muchos casos pasan desapercibidos, como por el aspecto florido que presentan los estudios de imagen, dificultando el diagnóstico diferencial.
El niño se queja de dolor, normalmente tras el esfuerzo físico, que al ser leve acaba resolviendo espontáneamente.
Sin embargo, se puede consultar a un ortopedista y, al solicitar una radiografía, sorprenderse con una reacción perióstica en la región metafisaria en un paciente en crecimiento.
La preocupación por la posibilidad de osteomielitis, granuloma eosinofílico, osteosarcoma o sarcoma de Ewing está justificada, pero es necesario tener en cuenta aspectos clínicos, como tiempo de evolución, factores de mejoría, apariencia local, para no complicar este diagnóstico, que es clínico .
Es necesario evaluar y preguntarse: ¿ en el tiempo que llevó realizar estas pruebas no hubo mejoría clínica?
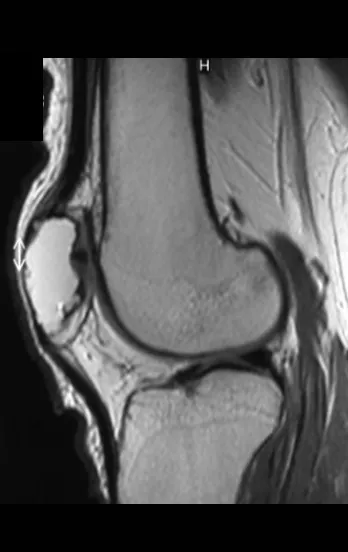
La resonancia magnética es un examen que debe interpretarse con mucho cuidado, ya que la fractura provoca un edema intra y extraóseo que puede asustar a las personas menos experimentadas.
Debemos observar el detalle de los dos puntos de baja señal del callo de fractura en la corteza lateral y medial en la figura 100 así como el punto de baja señal del callo óseo en la corteza posterior en la figura 101.
El proceso inflamatorio de la fractura, con marcada hemorragia y edema, es extenso. La histología del callo de fractura puede simular un osteosarcoma. Se conoce un caso de amputación por diagnóstico erróneo de osteosarcoma en un paciente con fractura por estrés.
La observación durante dos o tres semanas es fundamental para un diagnóstico preciso y no se considera una mala práctica, ni siquiera en el caso de neoplasias. La radiografía tomada tres semanas después mostró la fractura por estrés (fig. 102 y 103) y el cuadro clínico con mejoría de los síntomas y reducción del edema reafirma el diagnóstico. La clínica es soberana.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com