Quiste óseo aneurismático
El quiste óseo aneurismático (COA) pertenece al grupo de lesiones óseas pseudotumorales. Este grupo de enfermedades produce cambios óseos que mimetizan las lesiones tumorales, desde el punto de vista de la imagen radiográfica.
Quiste óseo aneurismático
Las lesiones que forman parte de este grupo son:
quiste óseo simple.
quiste óseo aneurismático.
Quiste óseo yuxtacortical (ganglio intraóseo).
defecto fibroso metafisario (fibroma no osificante).
granuloma eosinofílico.
displasia fibrosa (osteofibrodisplasia).
miositis osificante.
Tumor marrón del hiperparatiroidismo.
Quiste epidermoide intraóseo.
Granuloma reparativo de células gigantes.
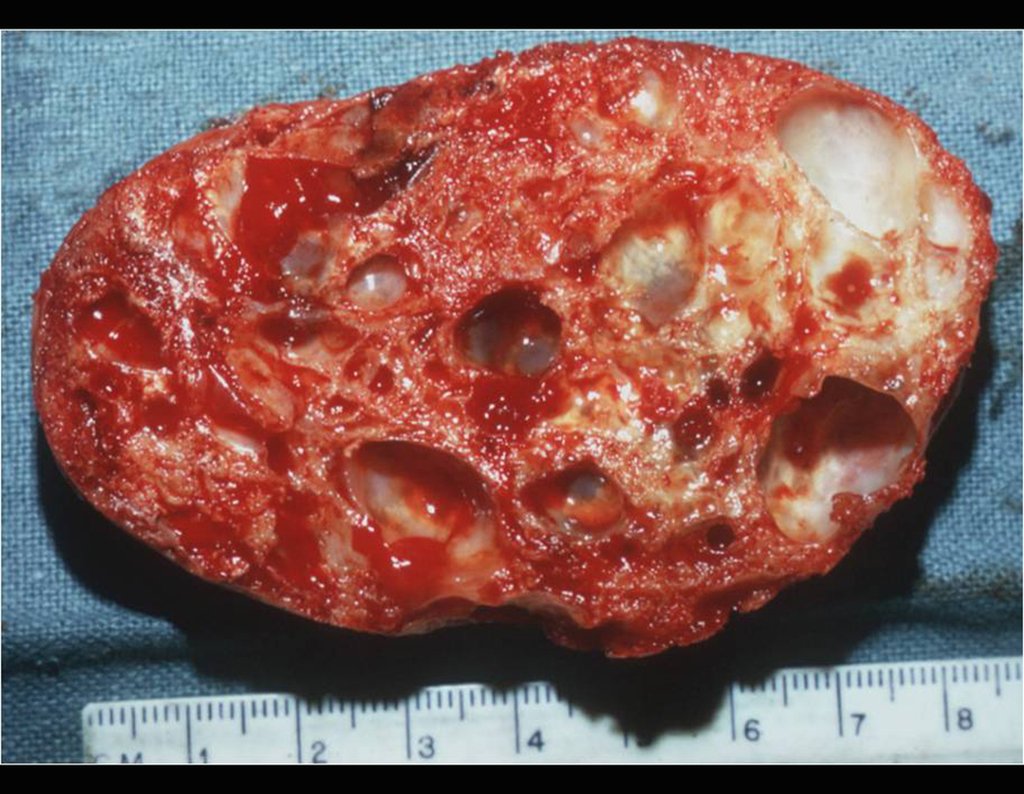
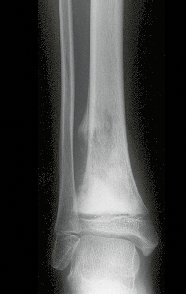
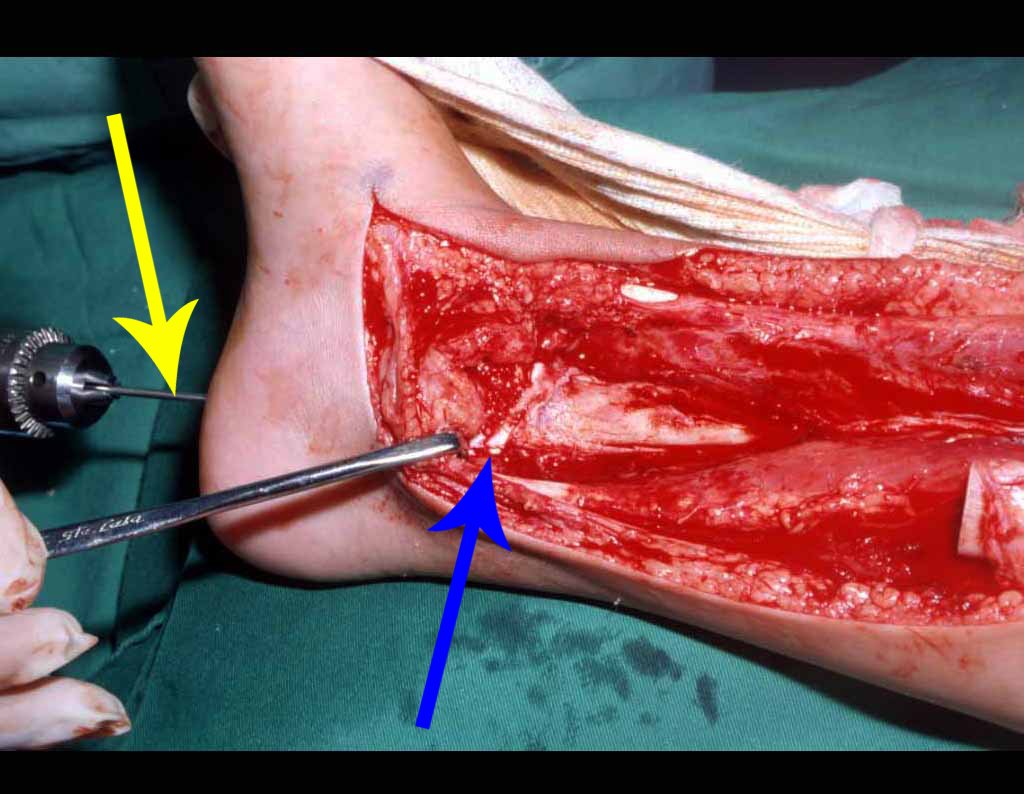
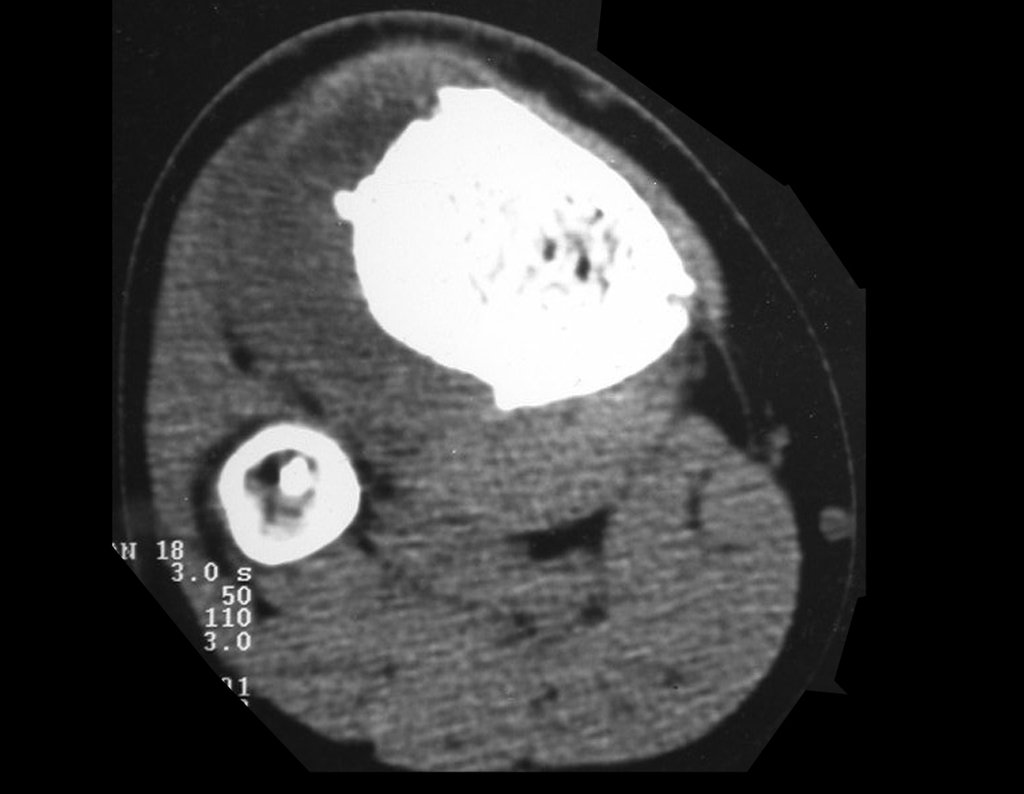
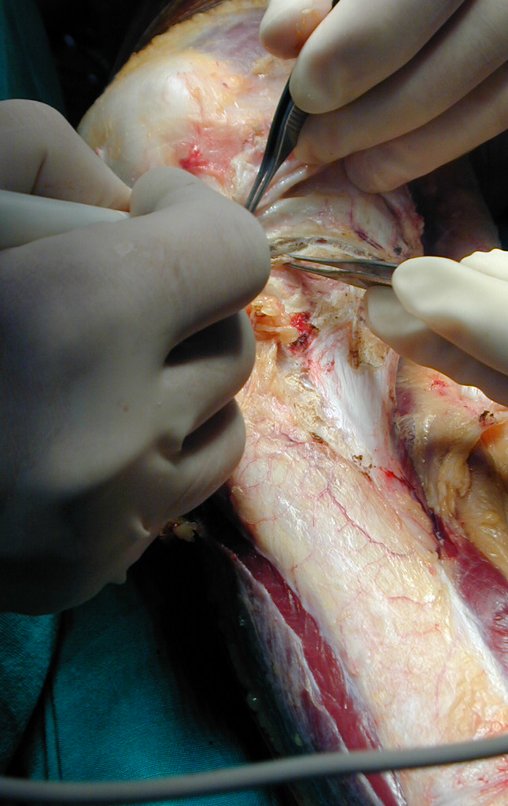
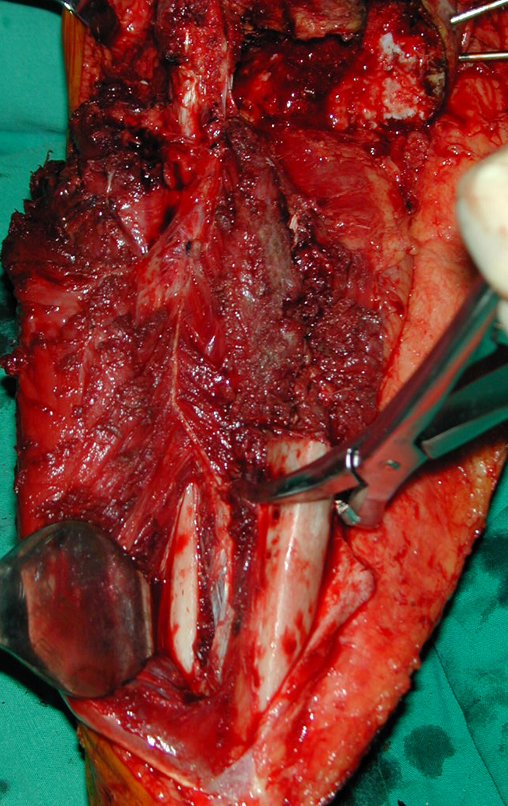
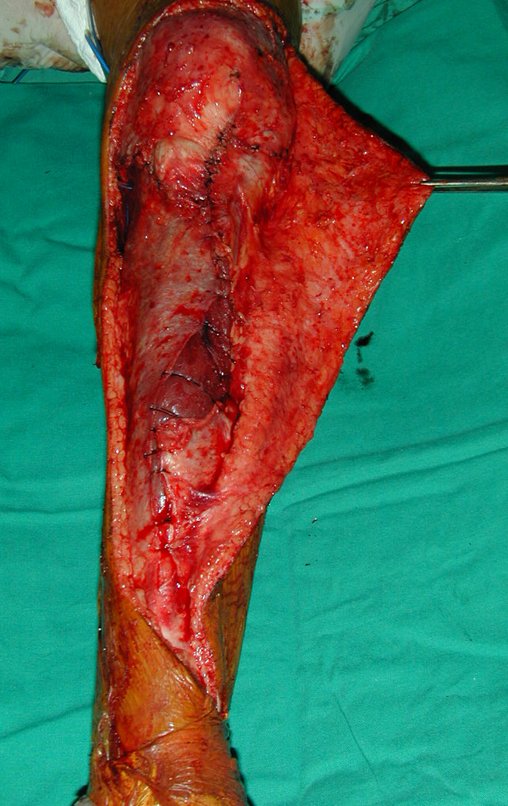
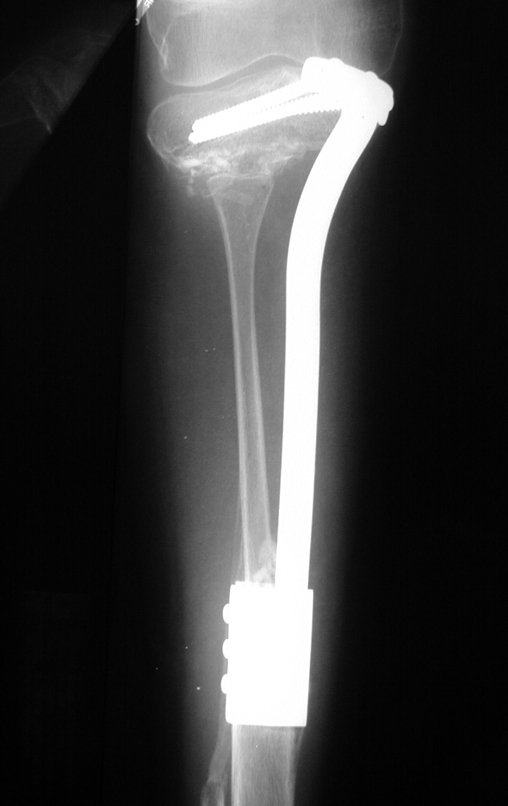
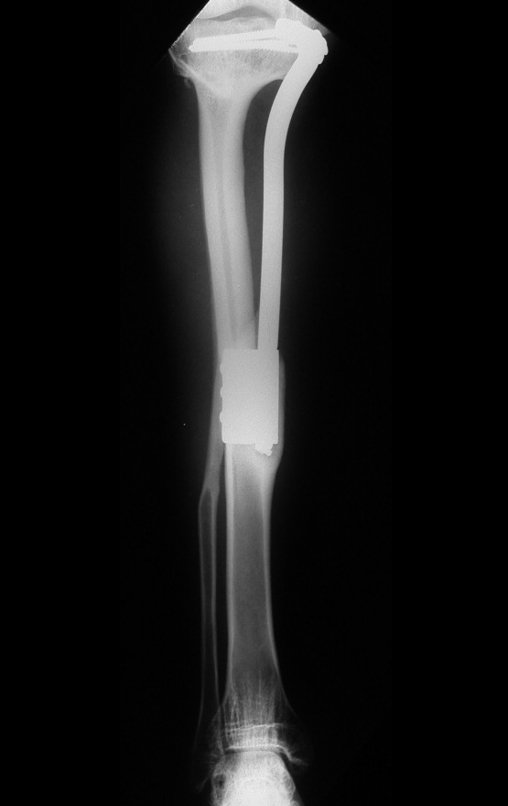
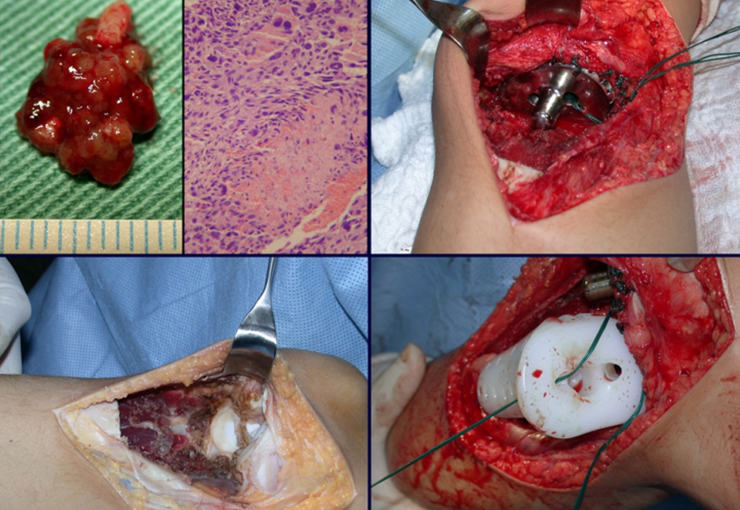
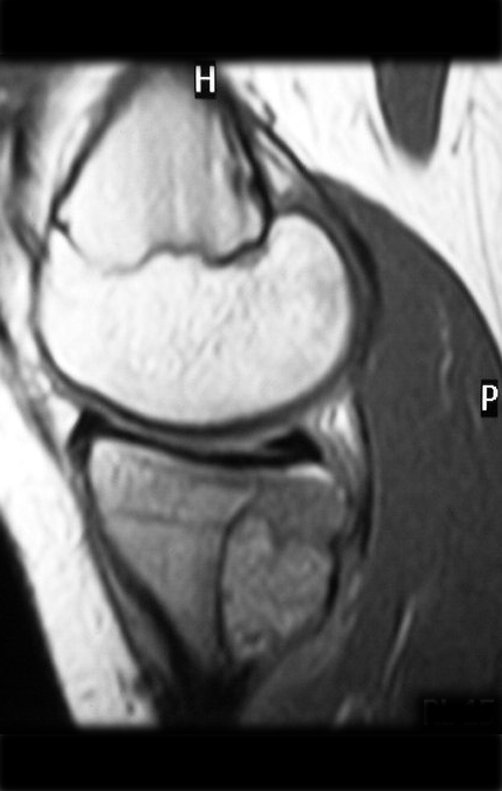
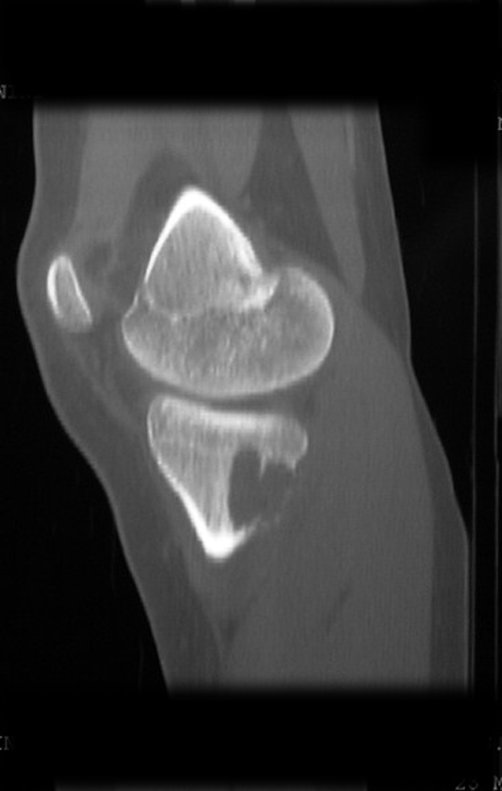
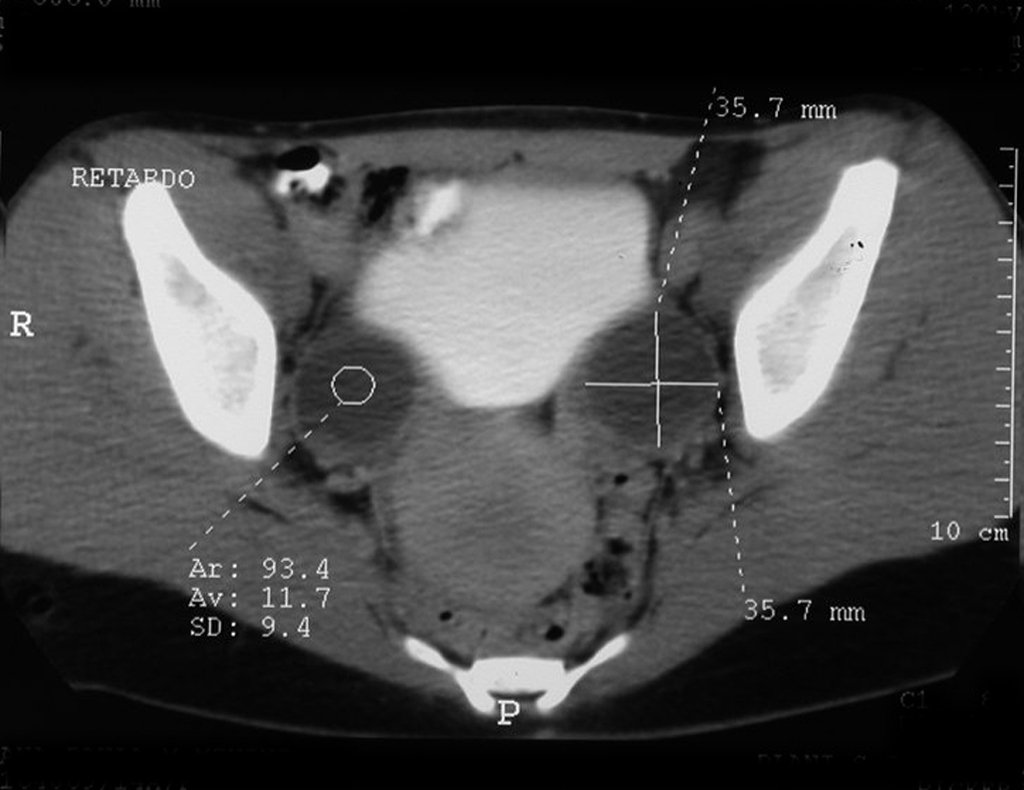
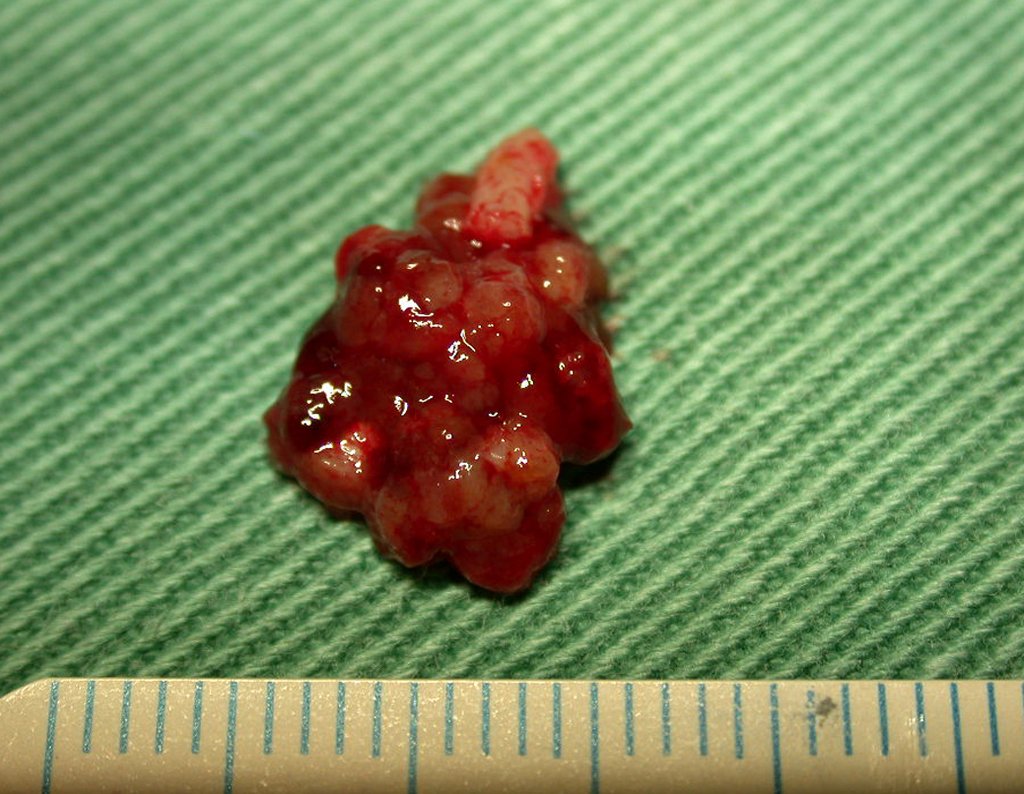
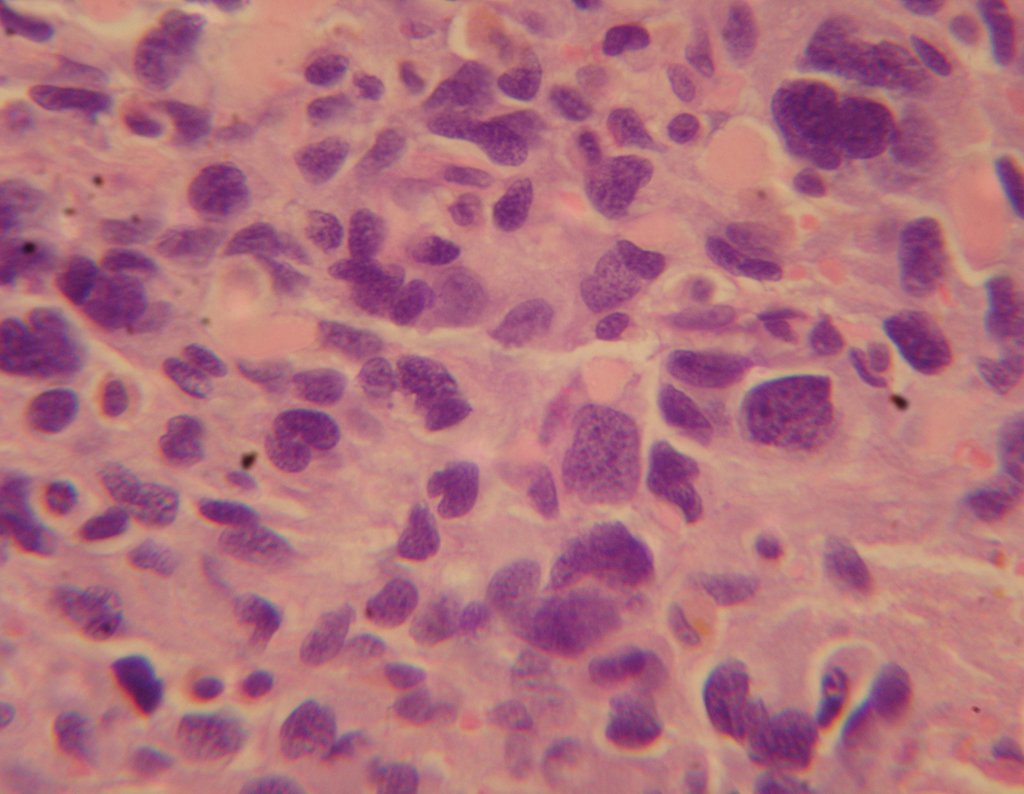
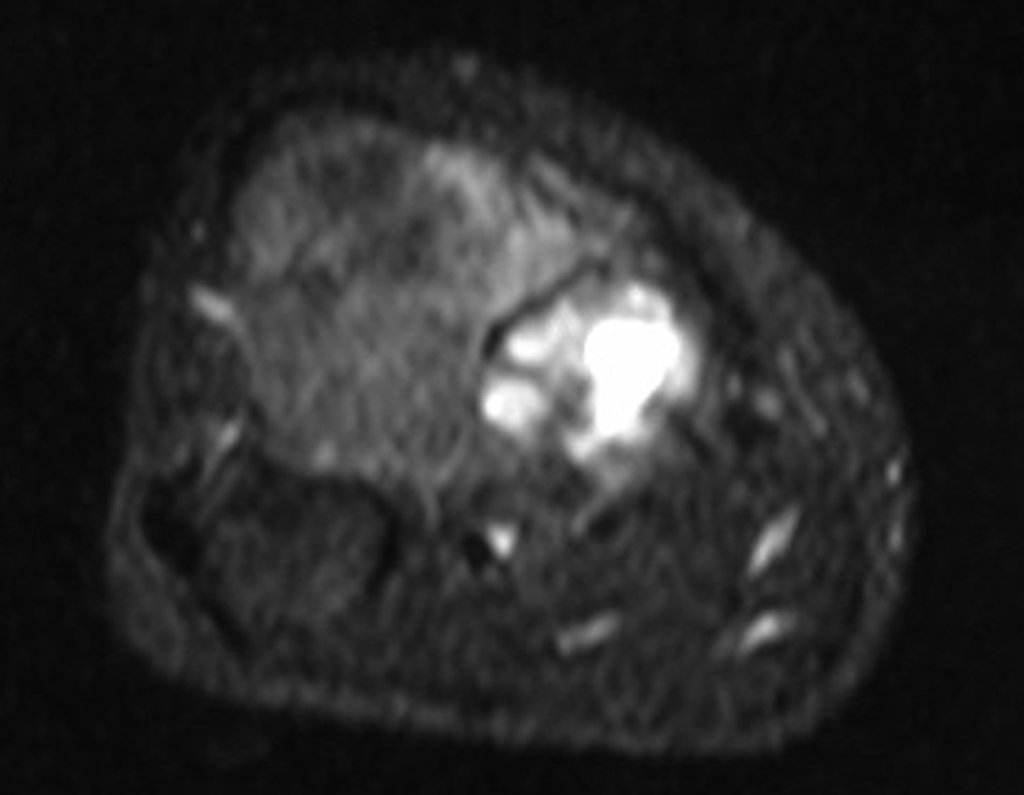
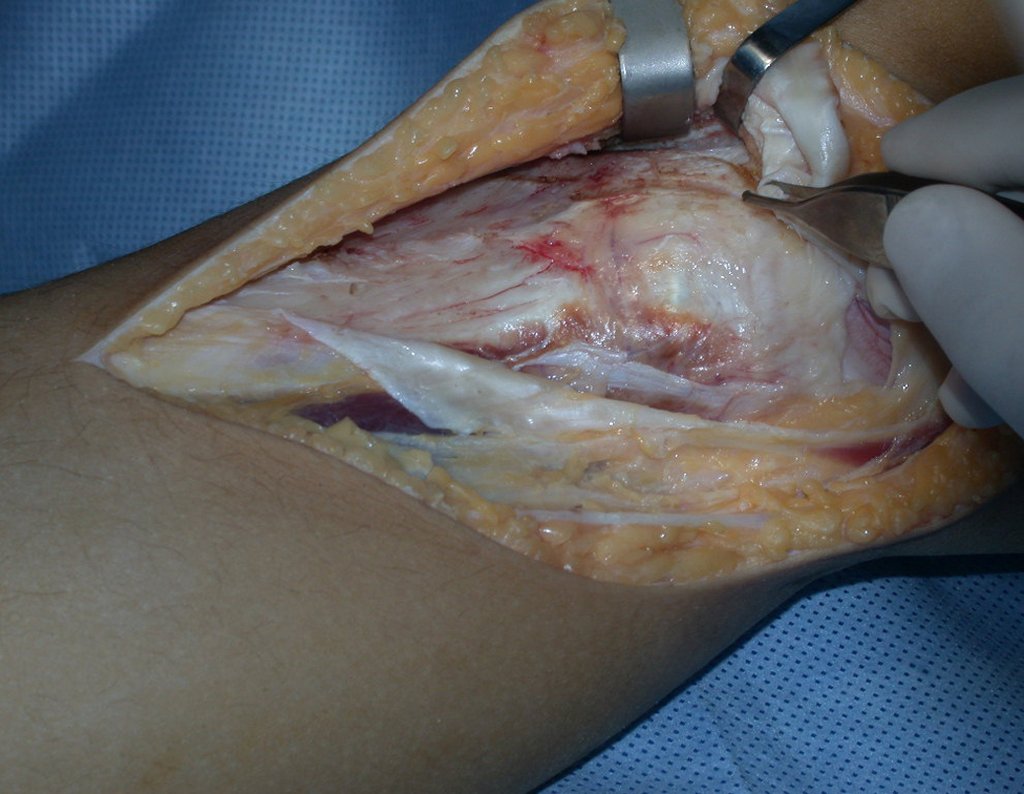
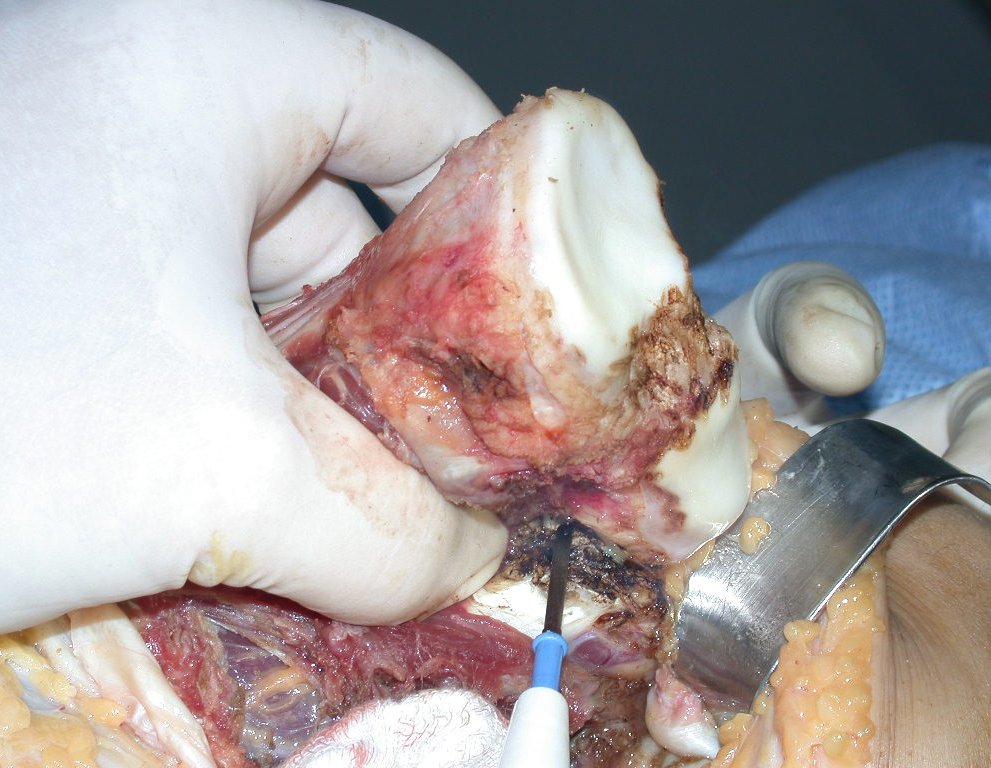
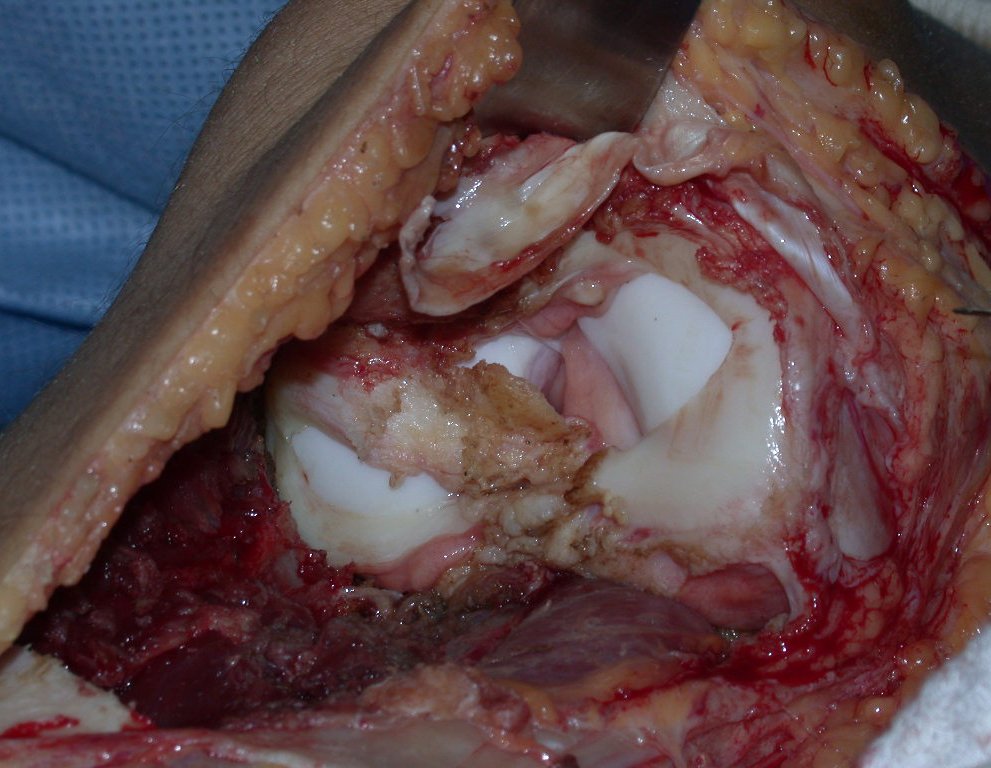
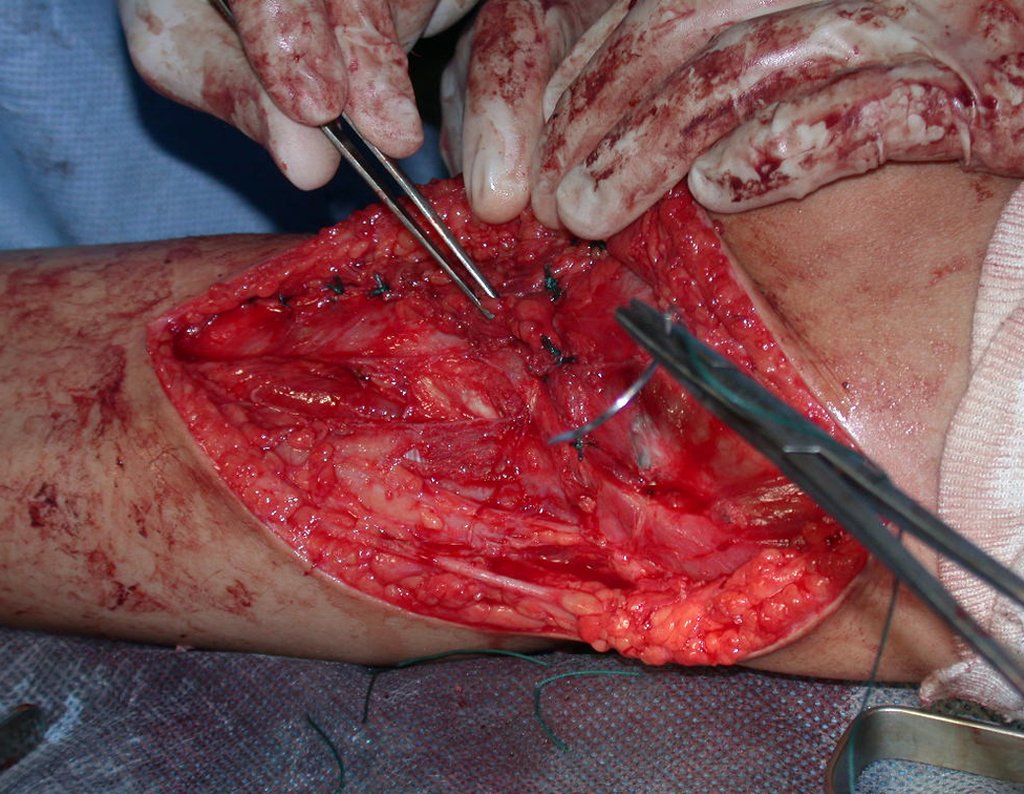
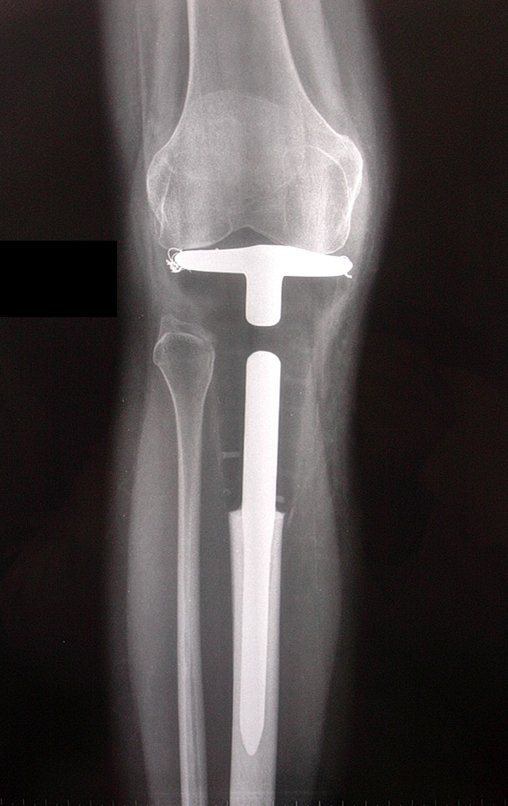
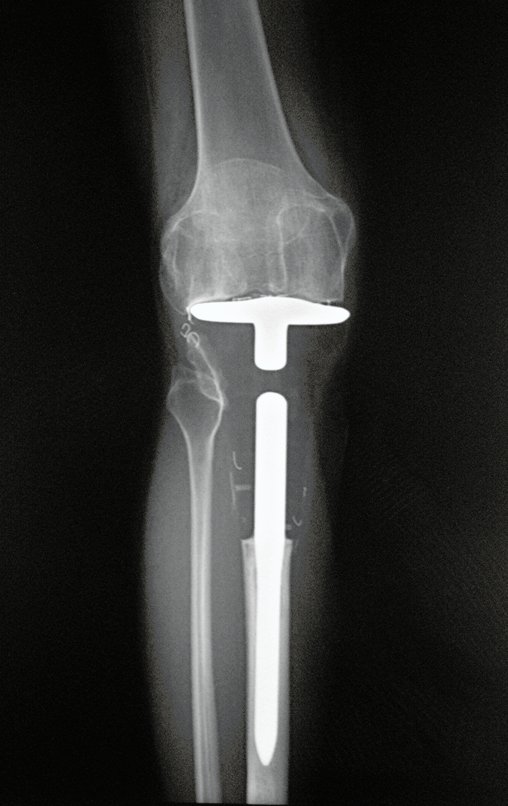
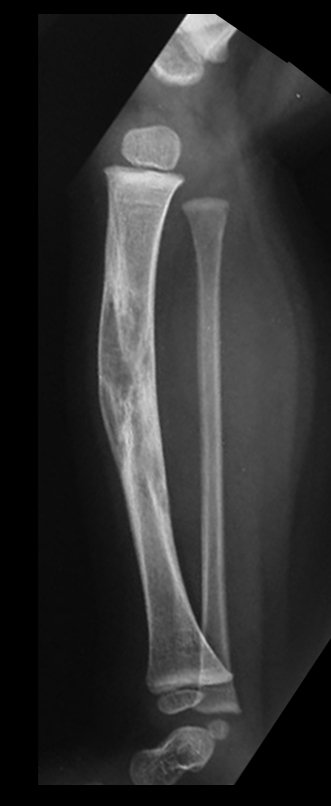
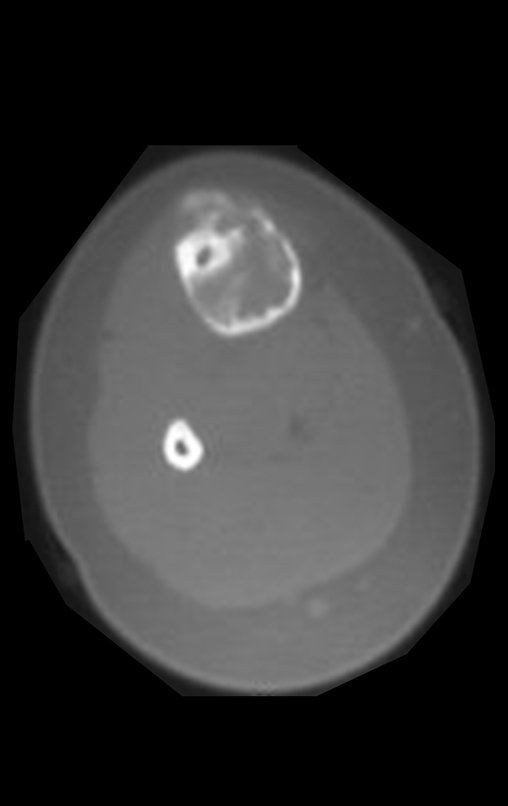
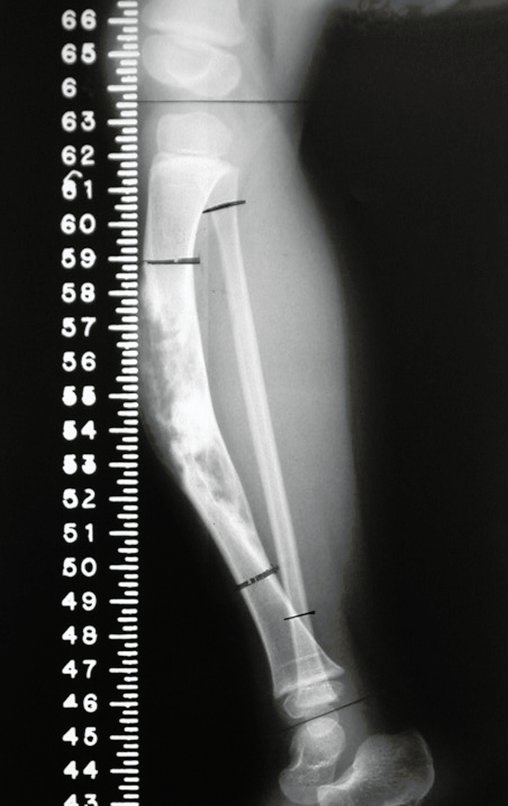
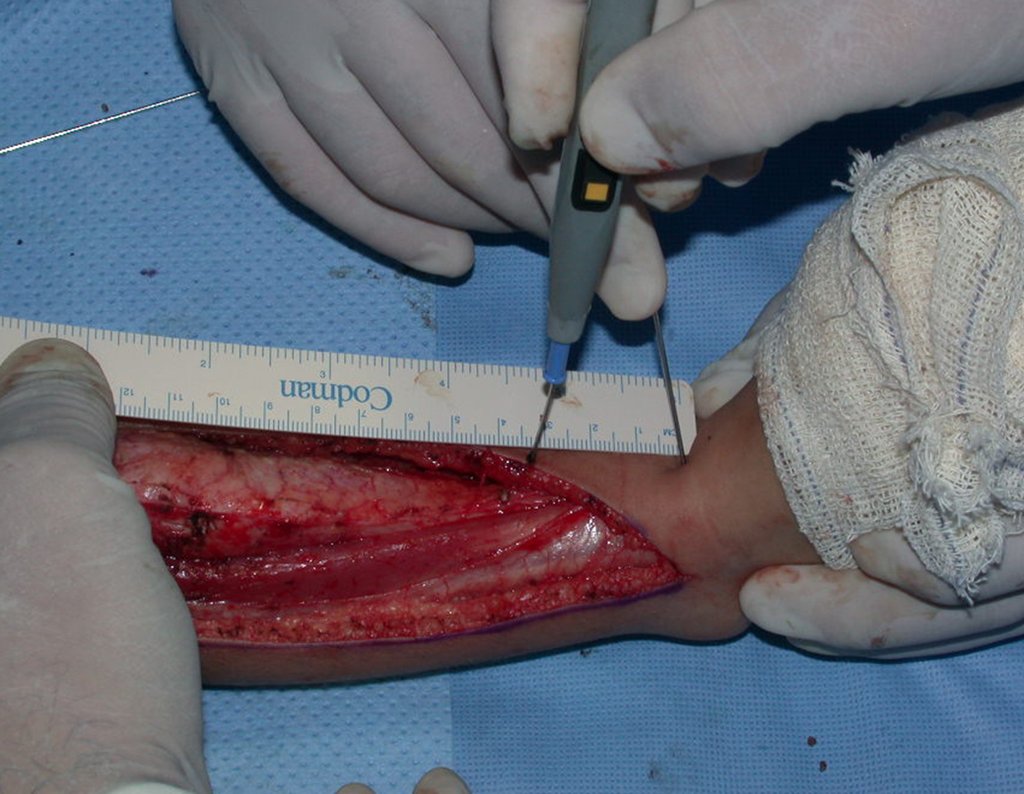
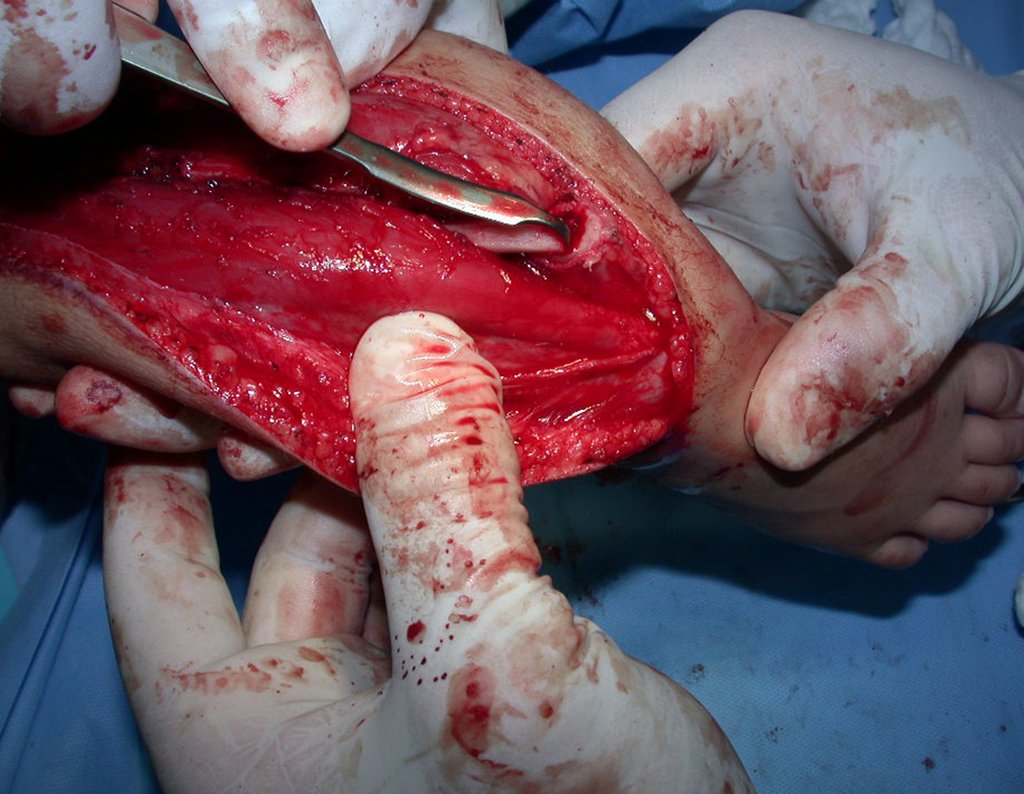
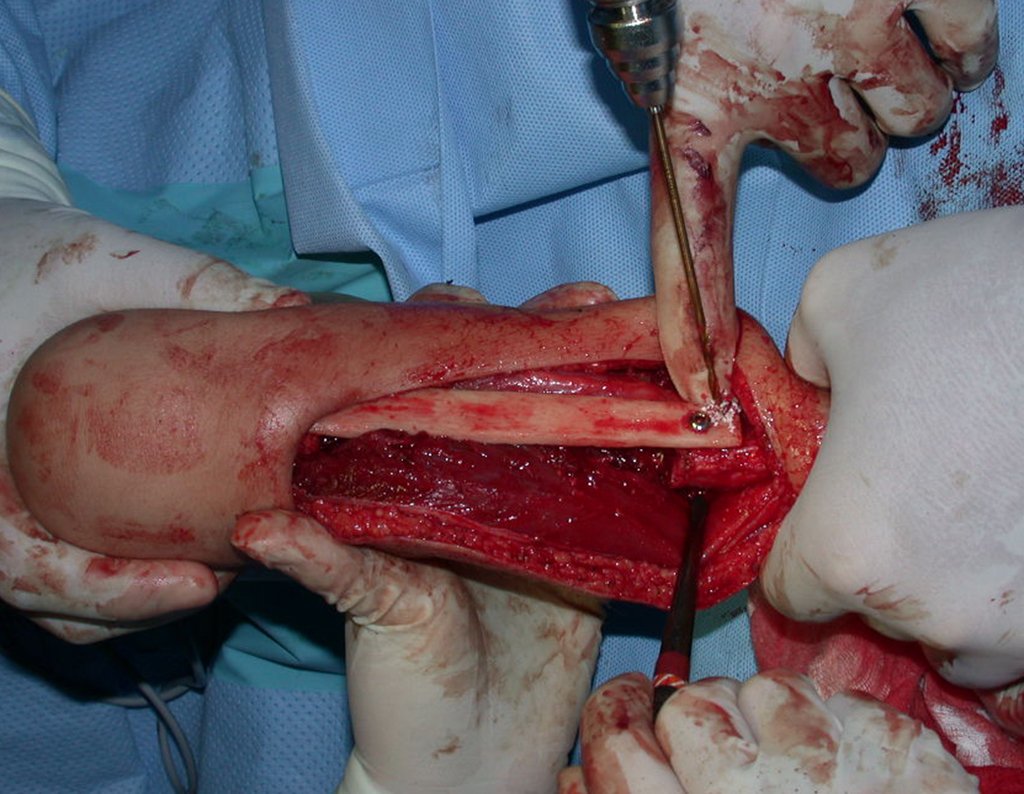
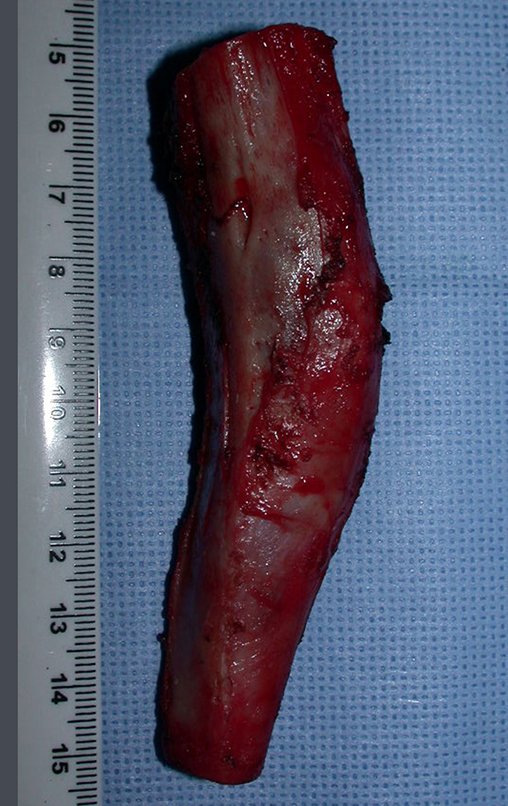
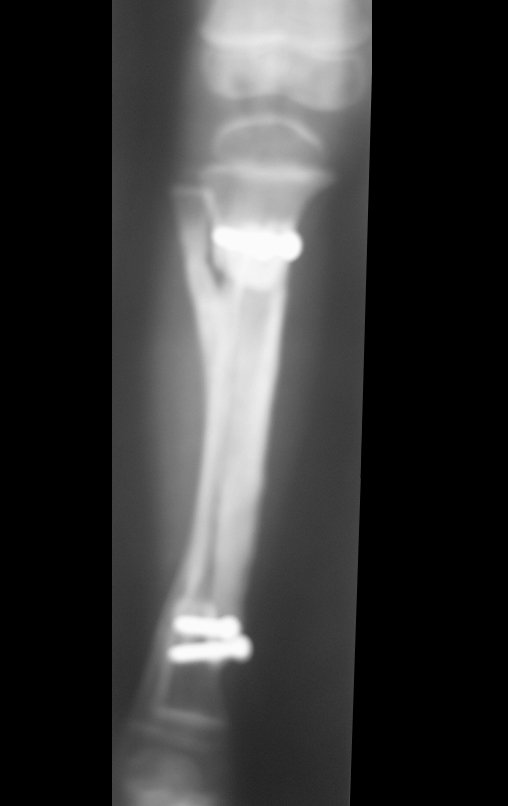
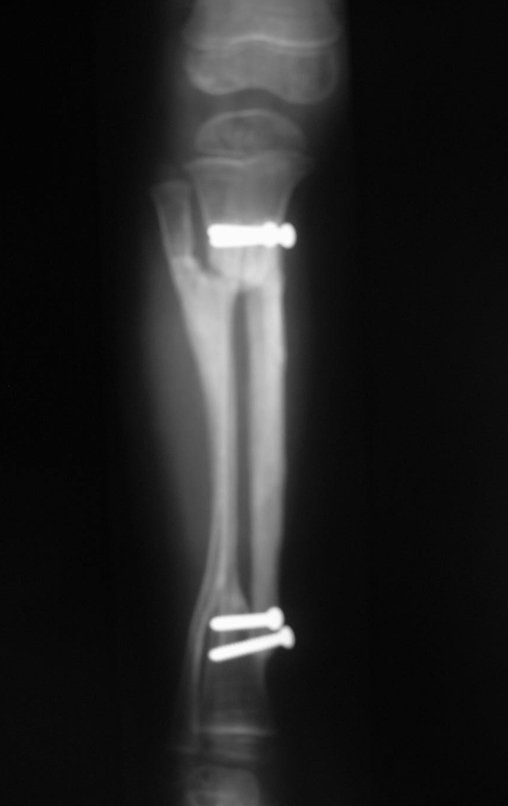
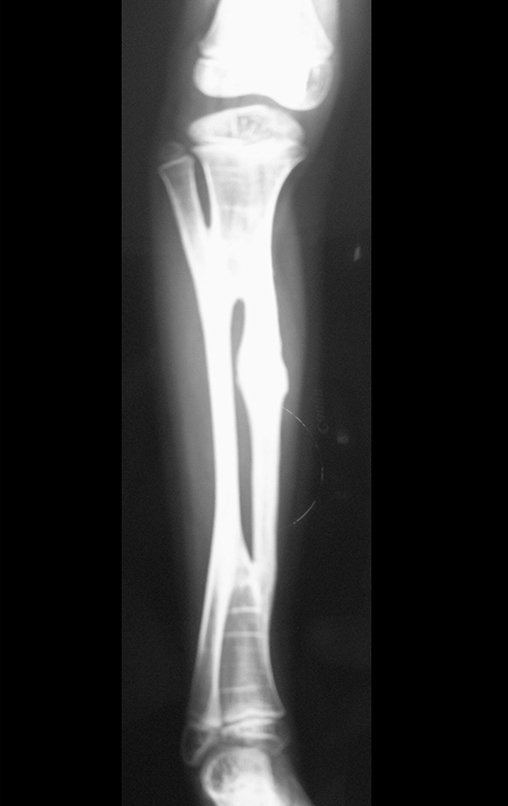
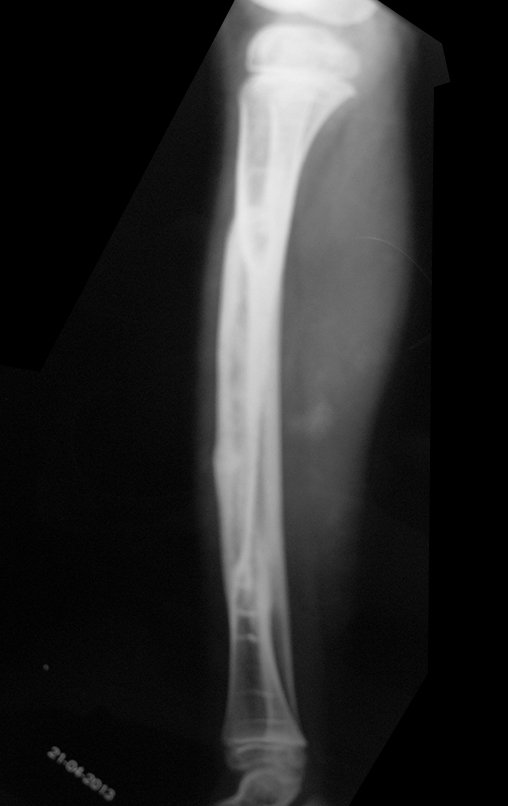
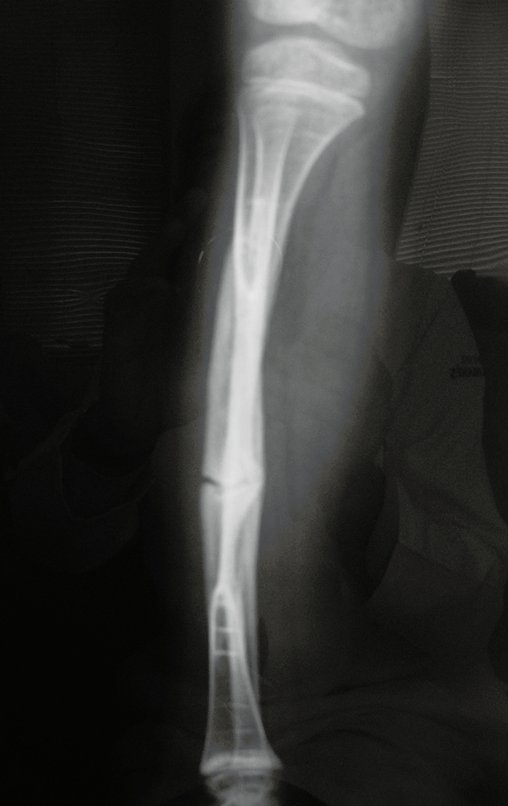
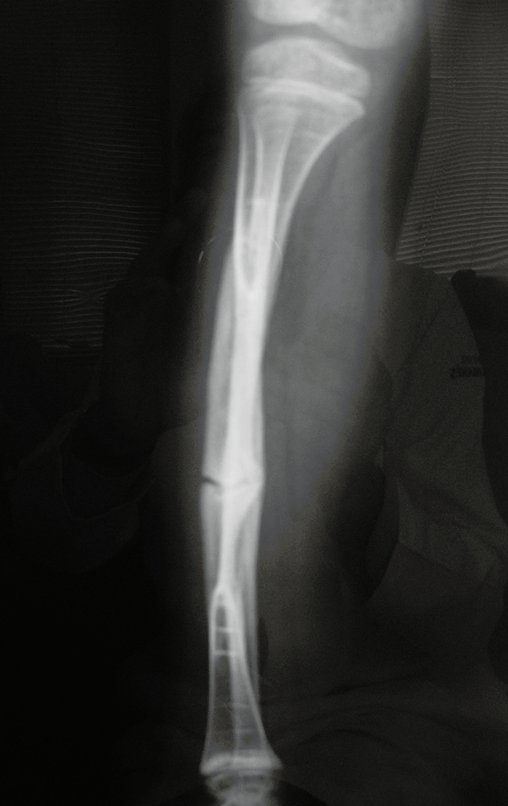
El quiste óseo aneurismático, también llamado quiste hemático multilocular, es una lesión de rarefacción ósea insuflativa llena de líquido serosanguinolento, intercalada con espacios de tamaño variable y separada por septos de tejido conectivo que contienen trabéculas de tejido óseo o osteoide y células gigantes ostoclásticas (fig. 1). ).
El origen y etiología de este proceso aún se desconocen, a pesar de haber sido descrito por Jaffe y Lichtenstein desde 1942. Los estudios citogenéticos sugieren que existe una correlación entre esta lesión y los fenómenos de translocación del cromosoma 17.
La presencia de células gigantes de tipo osteoclastos sugiere que se produjo un proceso de reabsorción ósea localizada, acompañada de acumulación de sangre y septada ya sea por tejido conectivo o por tejido osteoide con trabéculas óseas.
Estas cavidades llenas de sangre no tienen suministro de sangre que pueda demostrarse mediante arteriografía o infusión de contraste intraquístico y, en consecuencia, no tienen un carácter pulsátil. Estas bolsas no están vacías, por lo tanto no son quistes ni representan ningún tipo de aneurisma. El término “quiste óseo aneurismático” no es apropiado para esta afección.
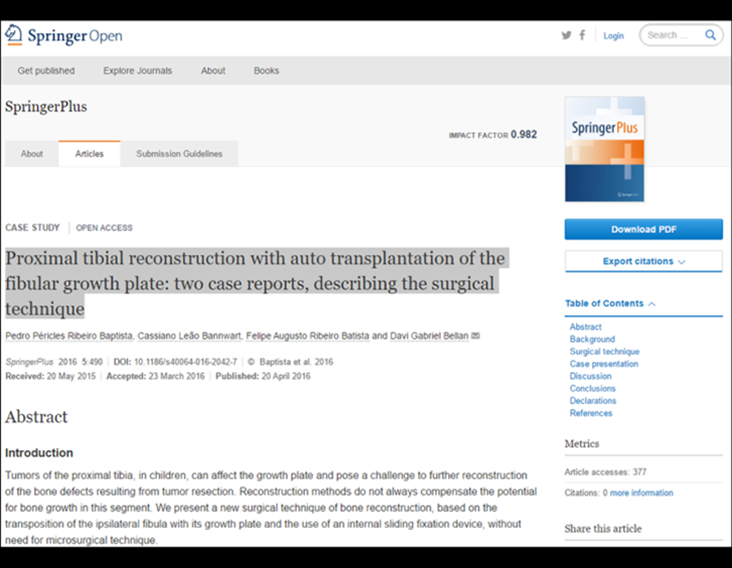
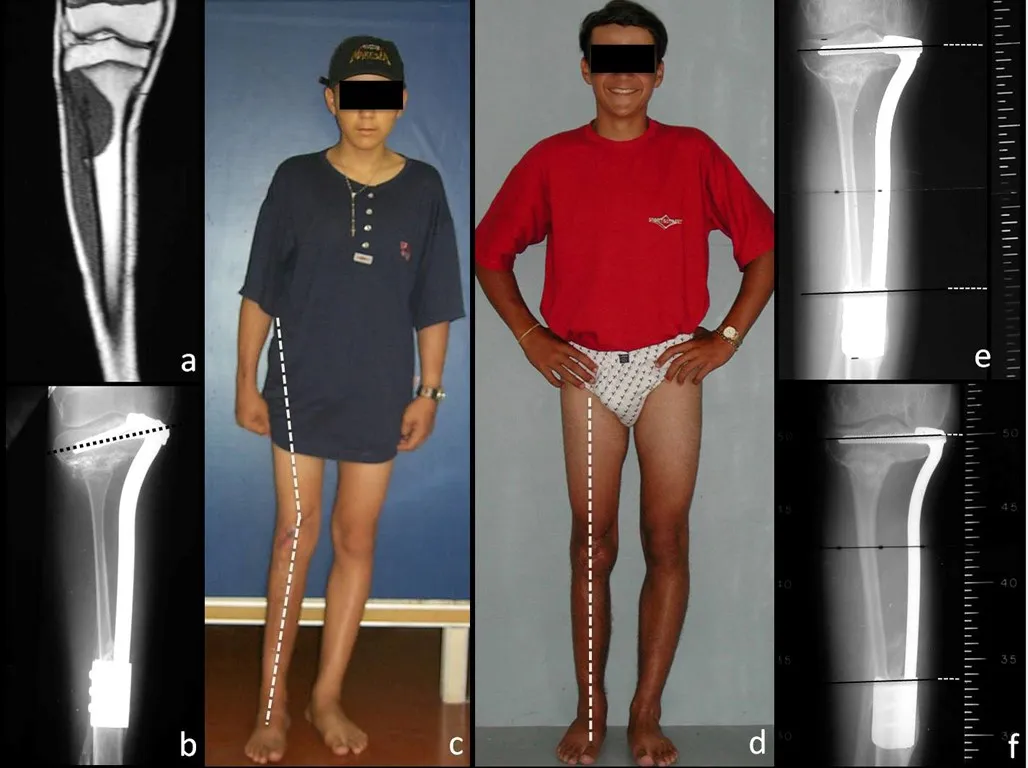
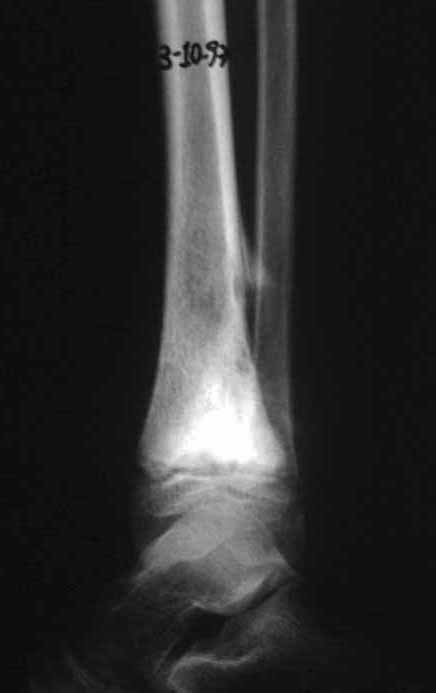
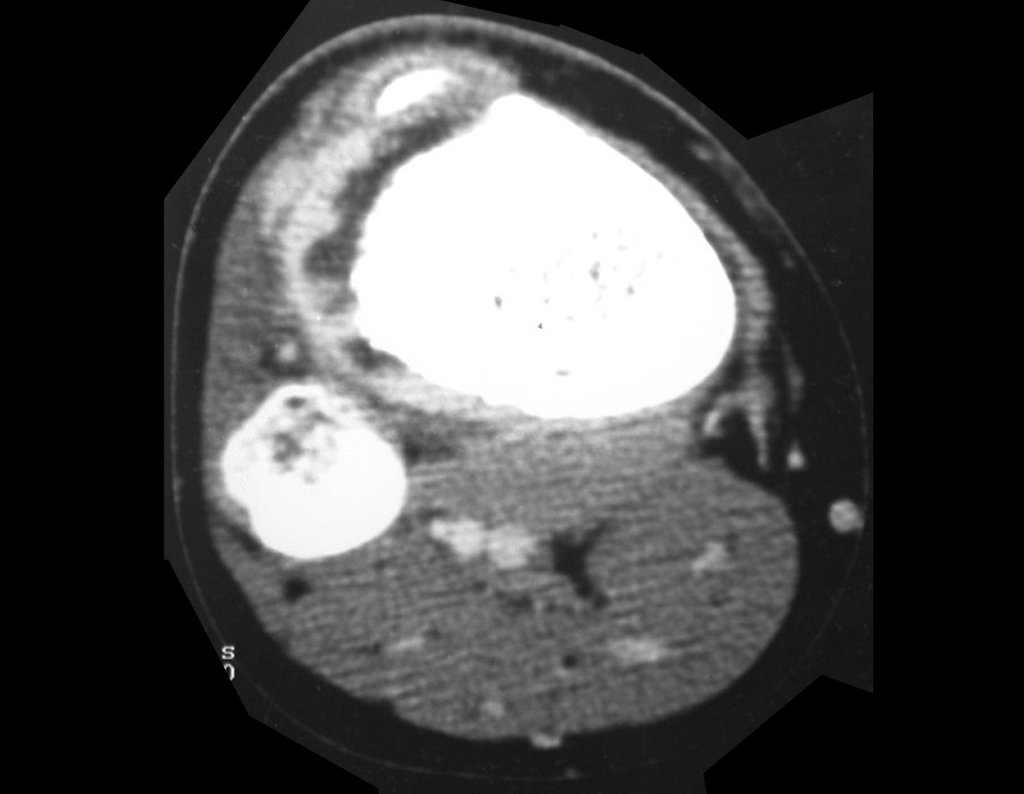
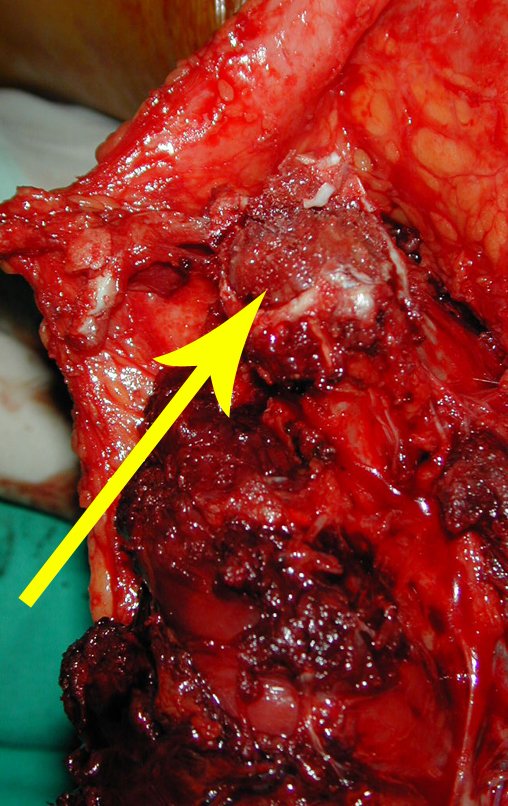
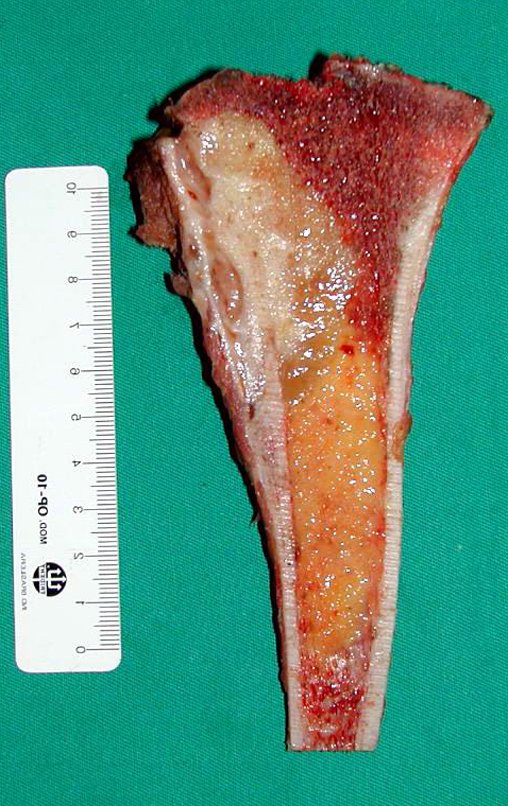
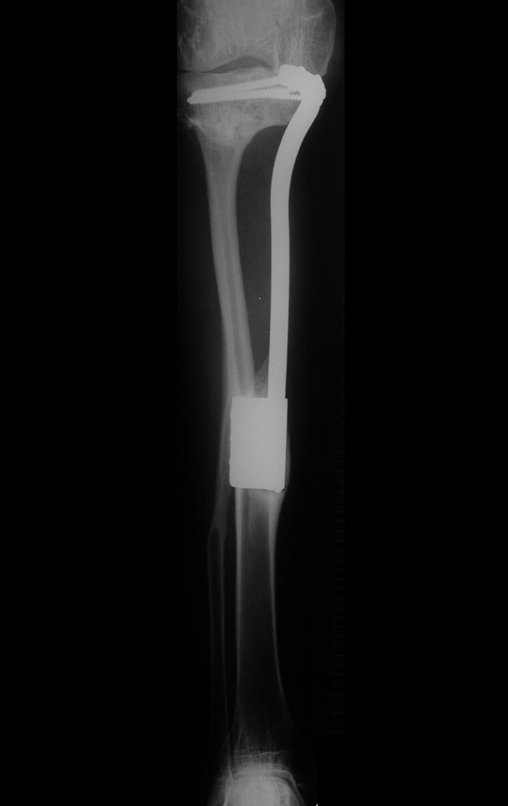
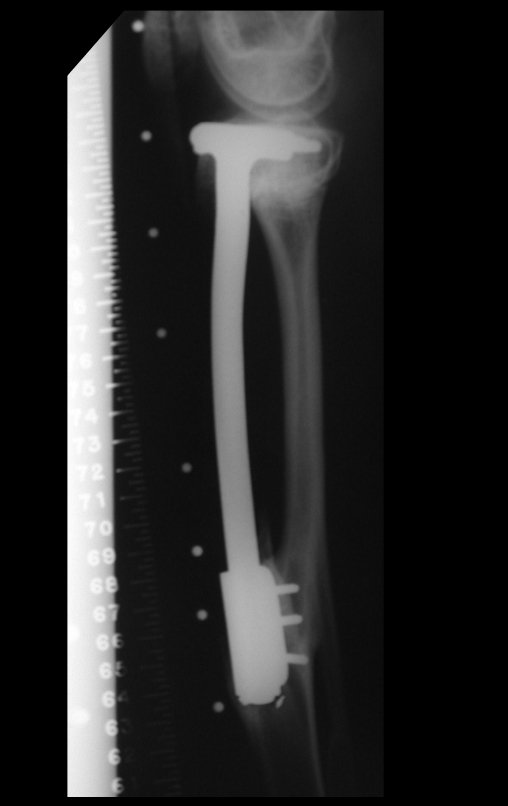
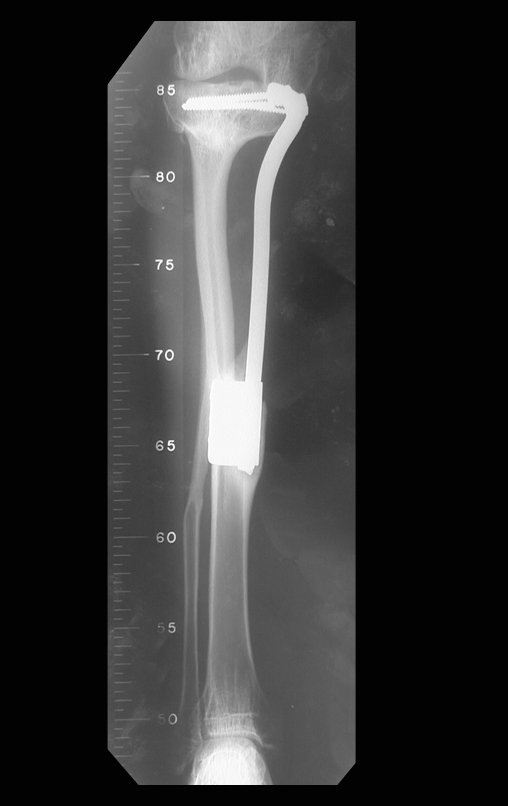
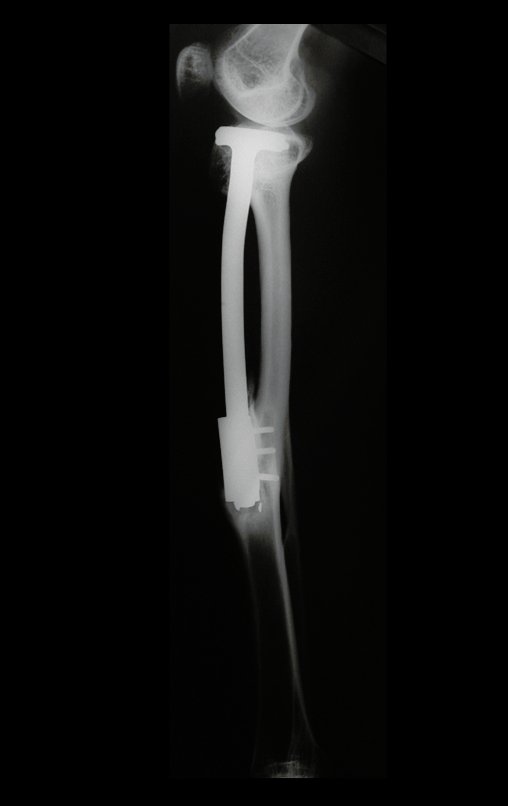
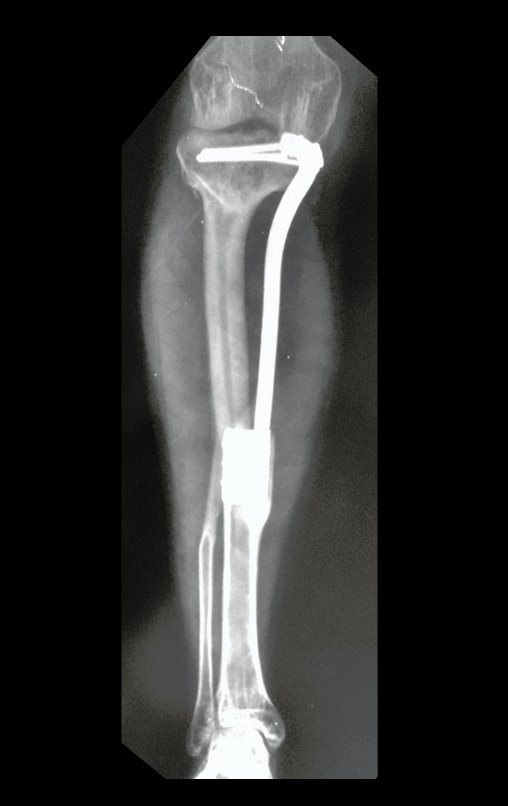
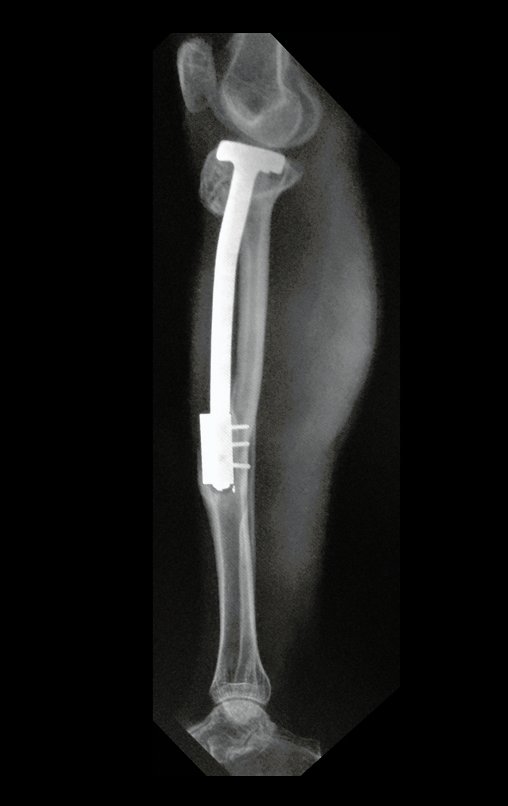
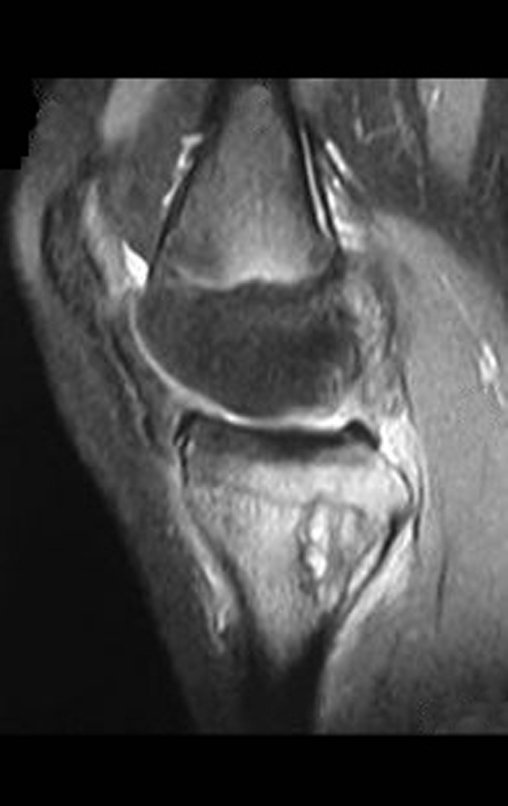
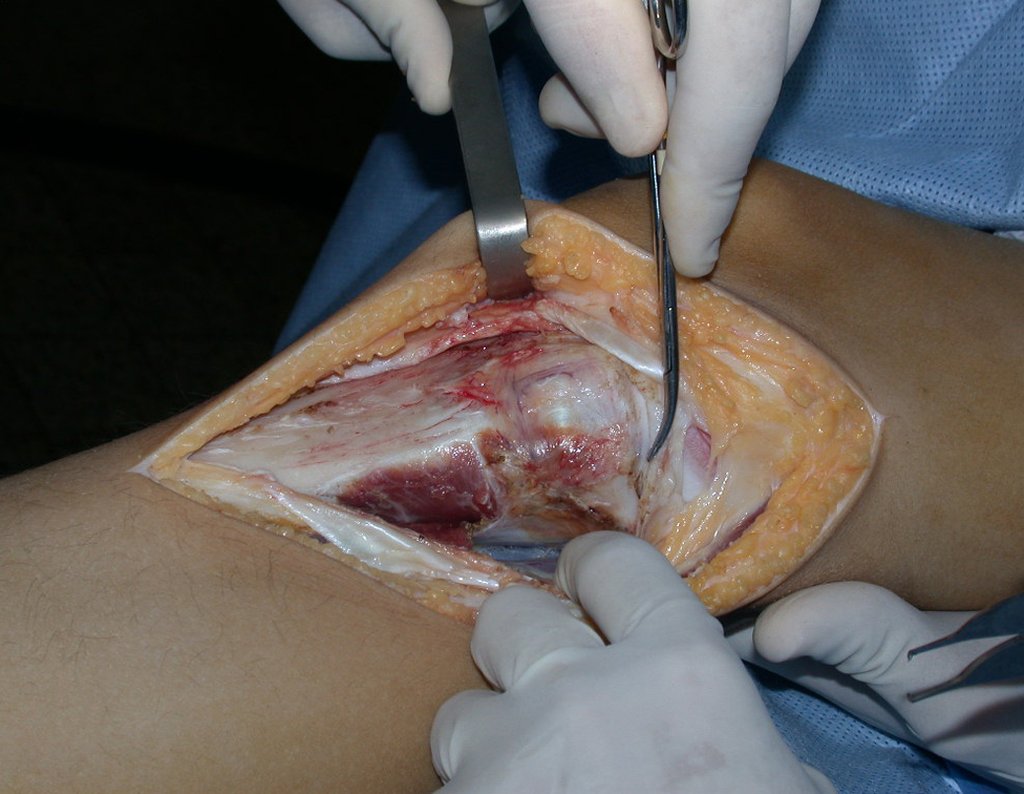
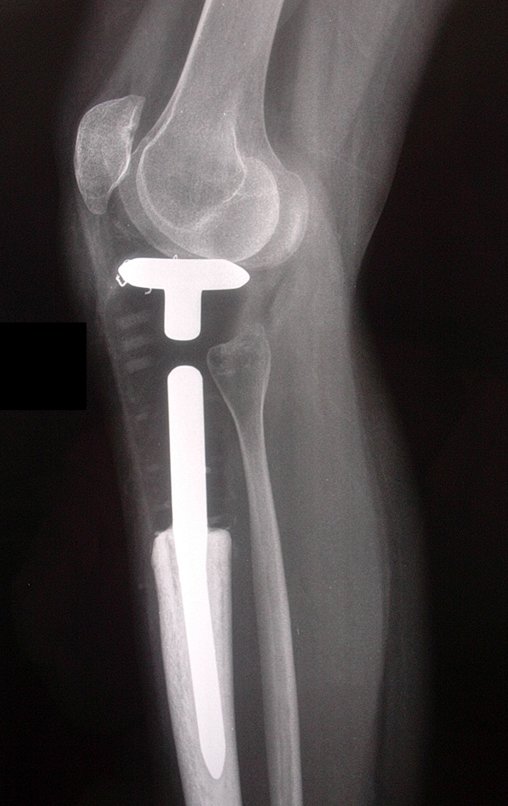
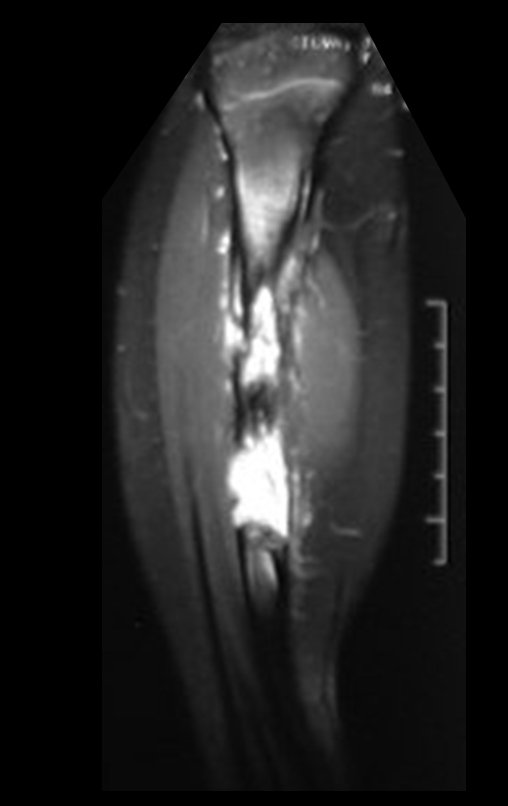
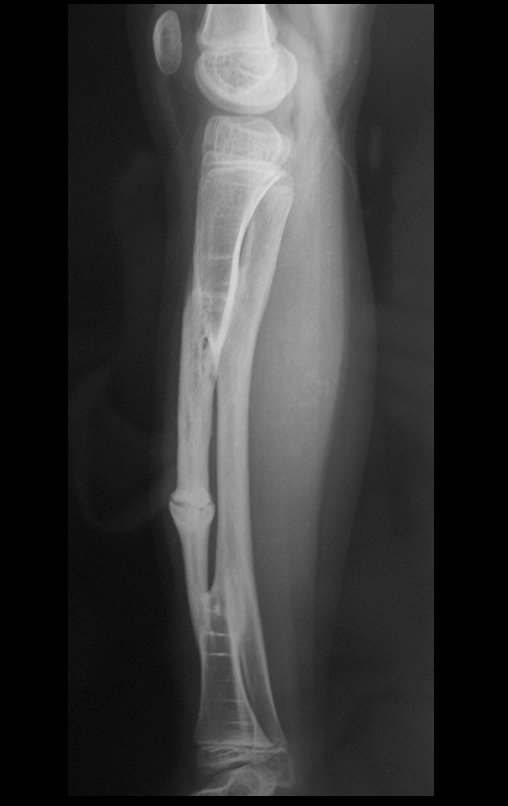
Se trata por tanto de una lesión benigna y según Enneking se puede clasificar en benigna activa o agresiva. La presencia de áreas de fibrosis y osificación reparadora se relaciona con la regresión del quiste o el resultado de una fractura previa (fig. 2).
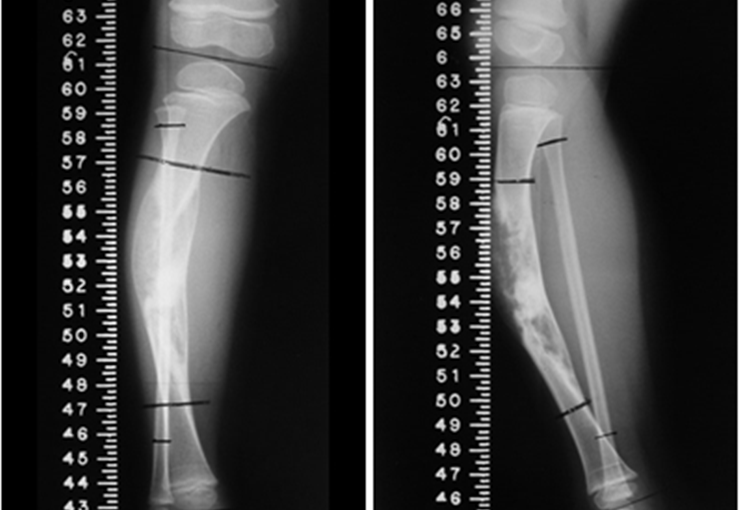
Los depósitos se presentan en distintos números y tamaños, agrupándose y provocando erosión de las trabéculas óseas, que expanden e inflan la corteza. Histológicamente se observan lagunas sanguíneas separadas entre sí por septos conectivos y células osteoclásticas, sin atipia.
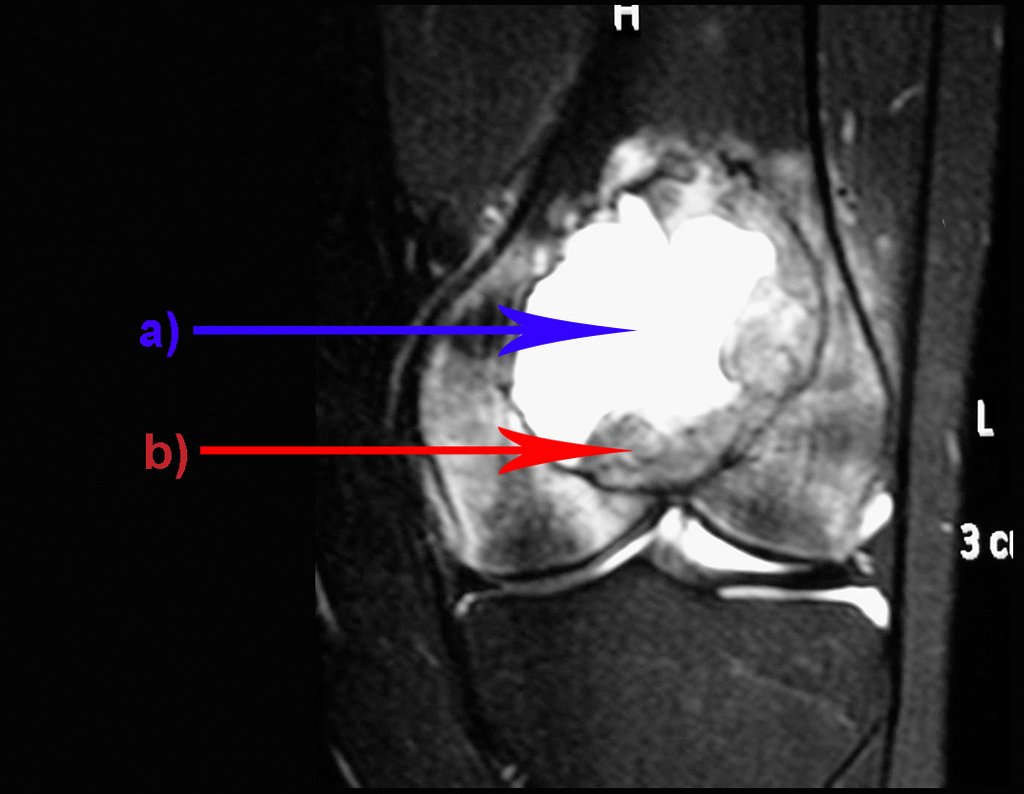
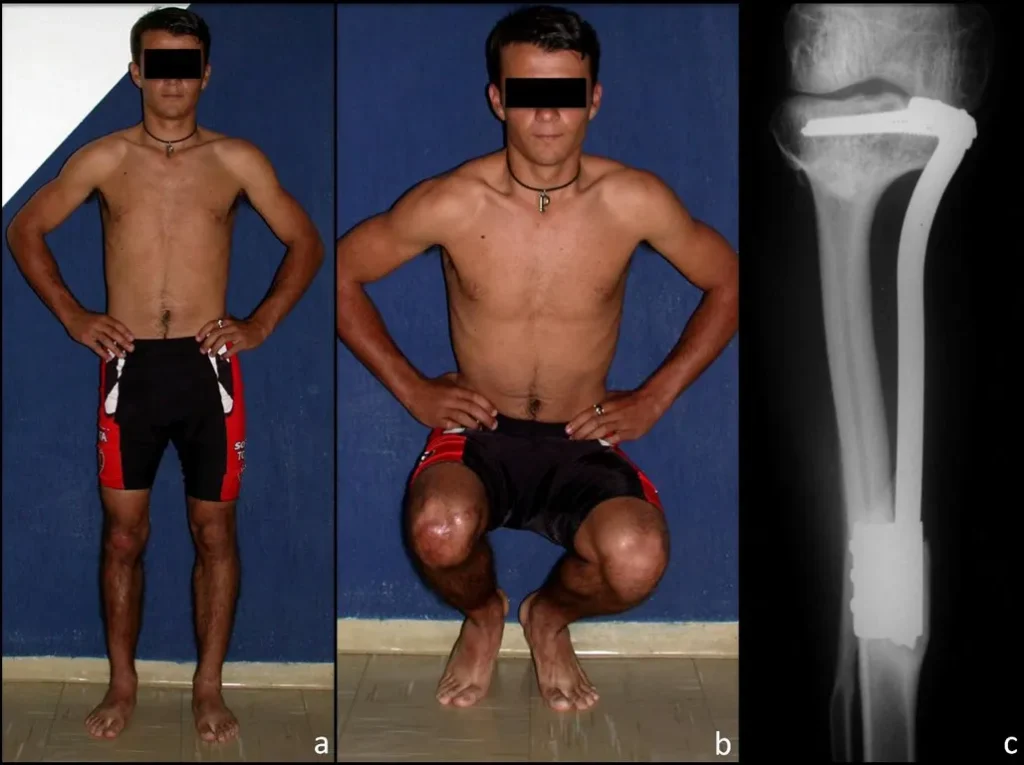
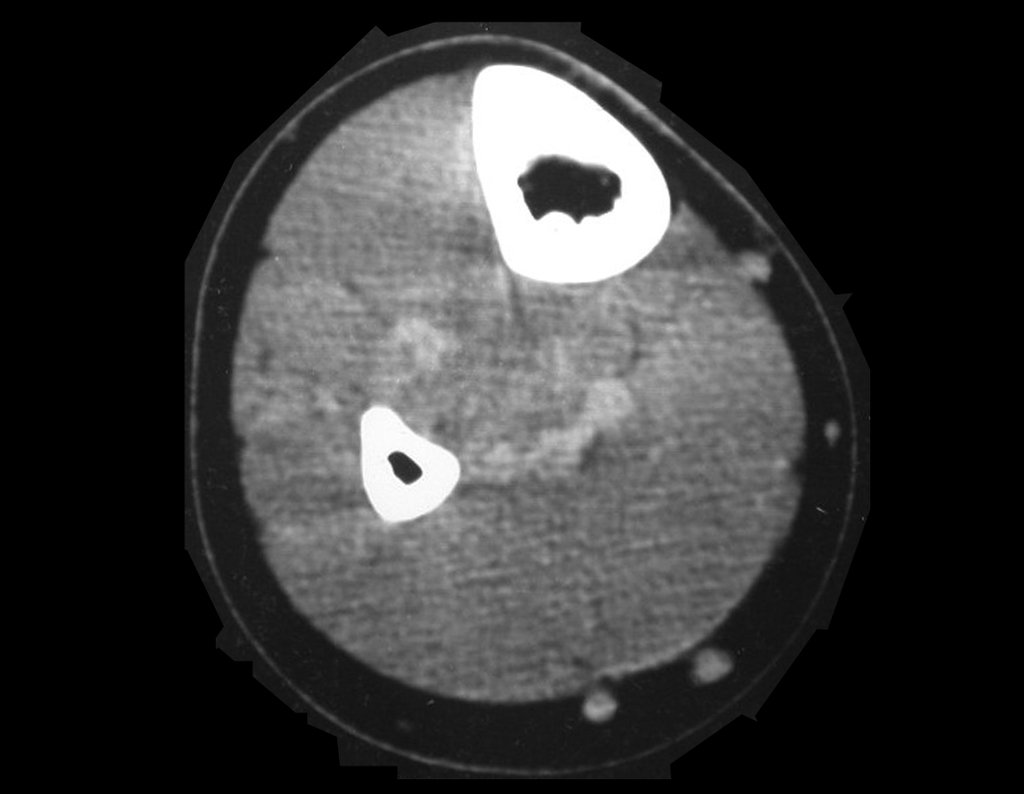
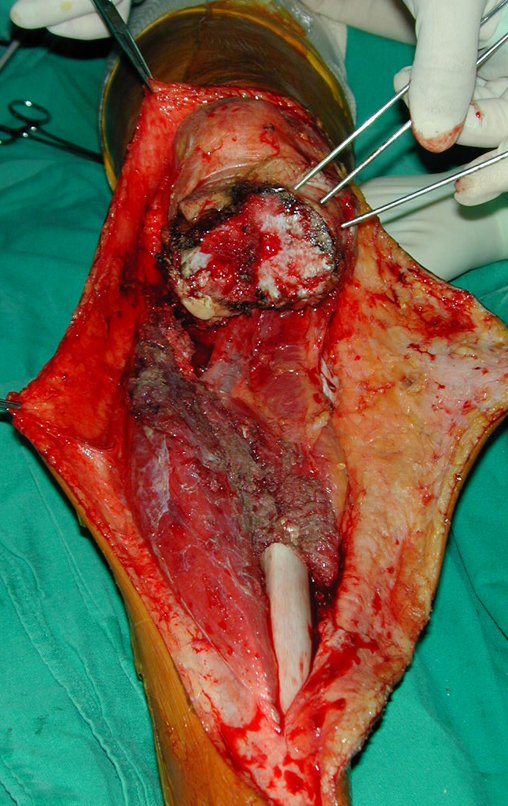
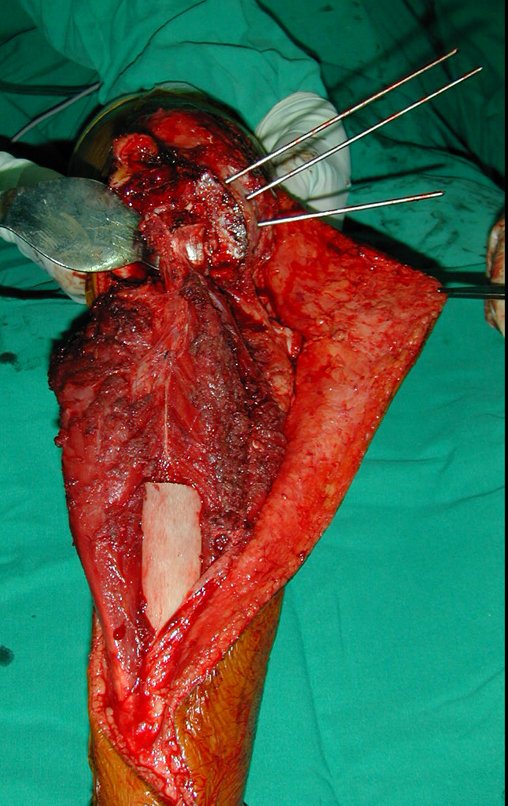
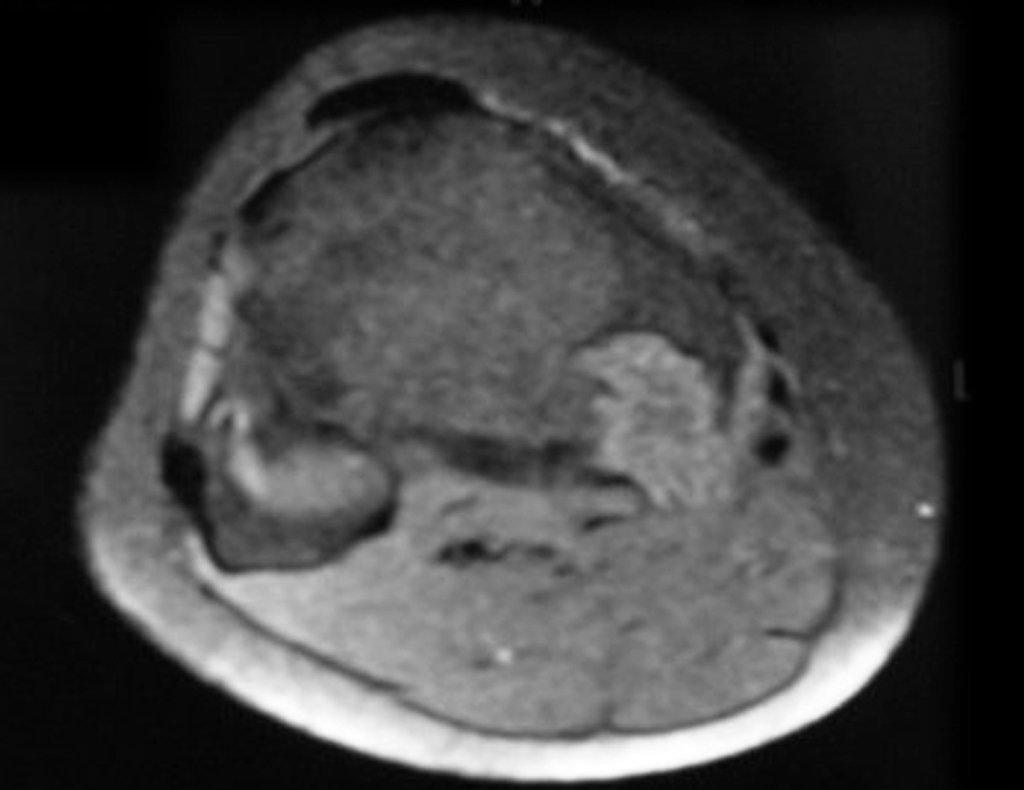
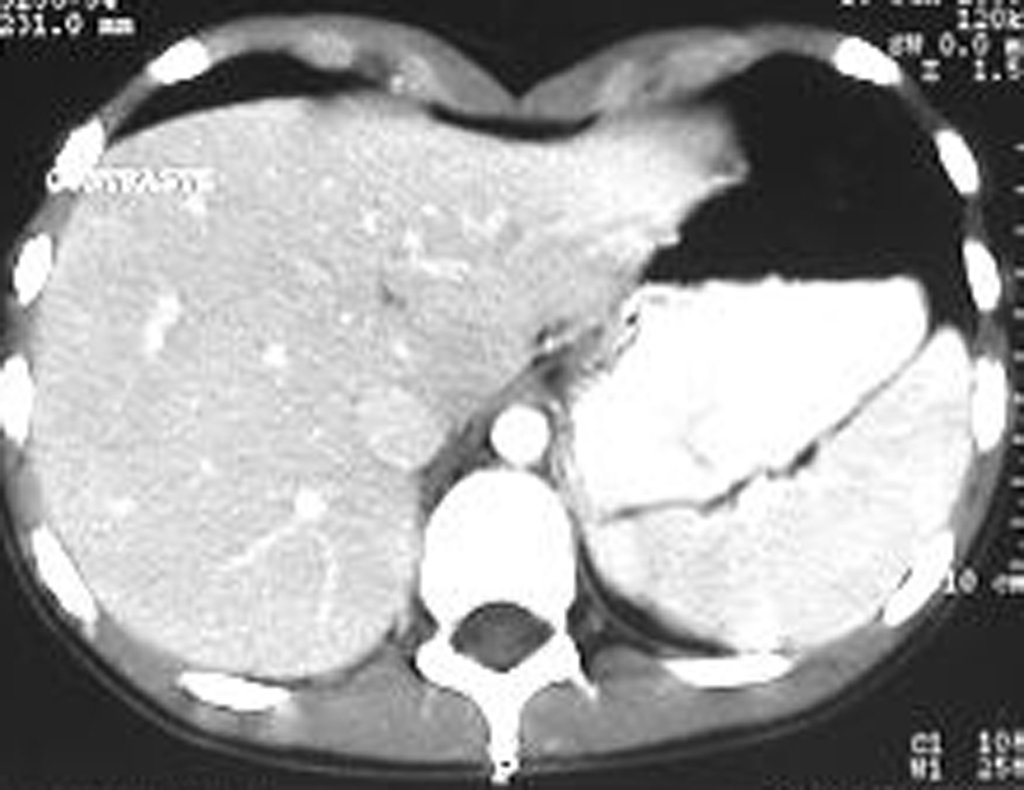
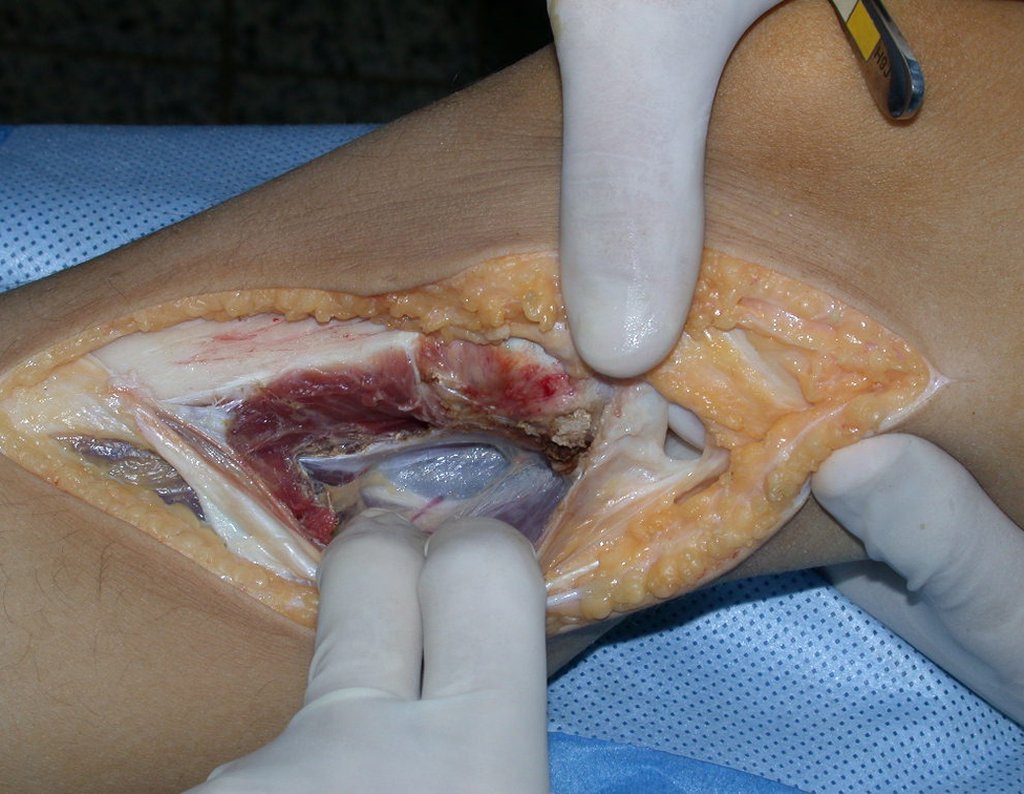
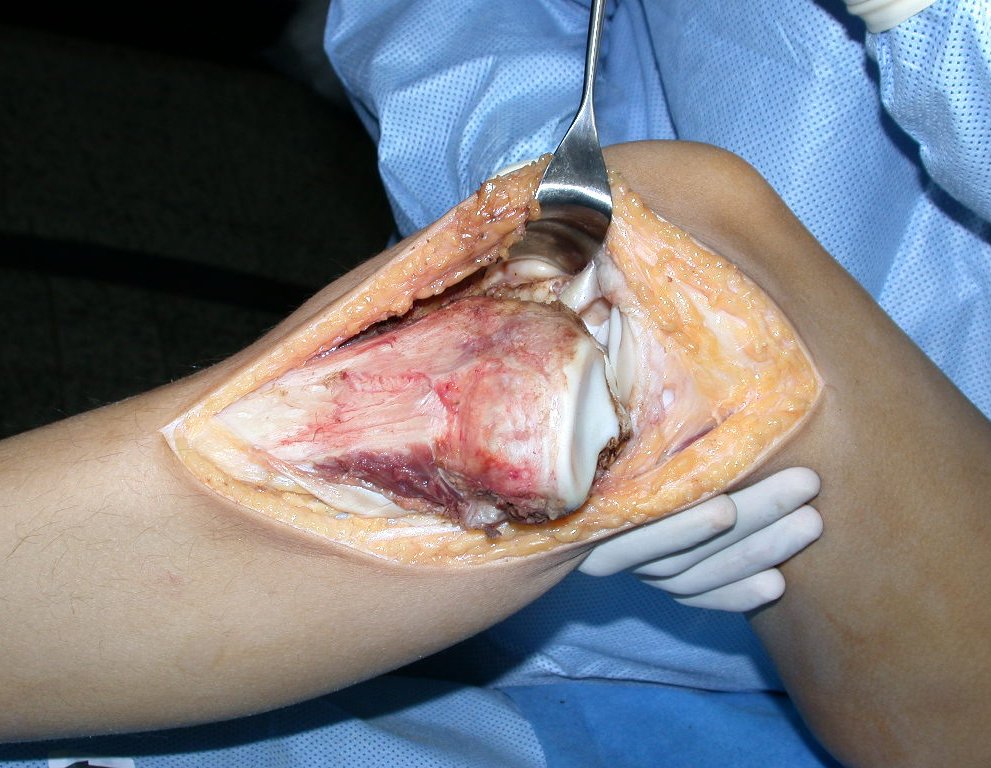
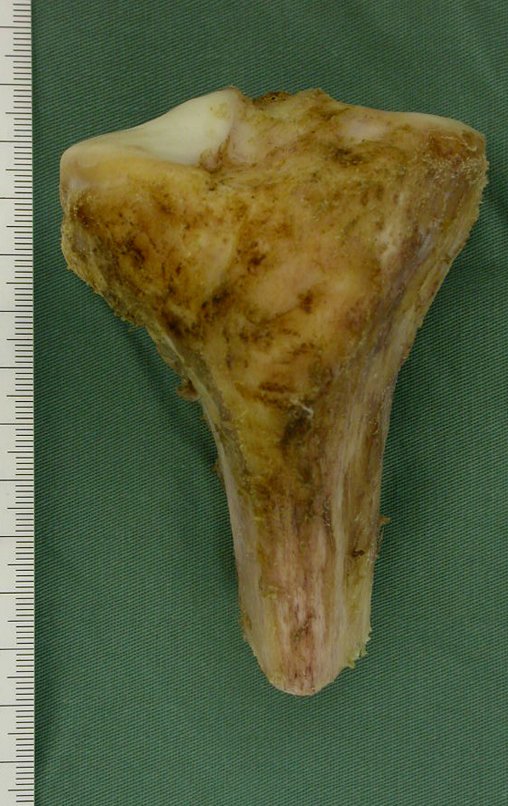
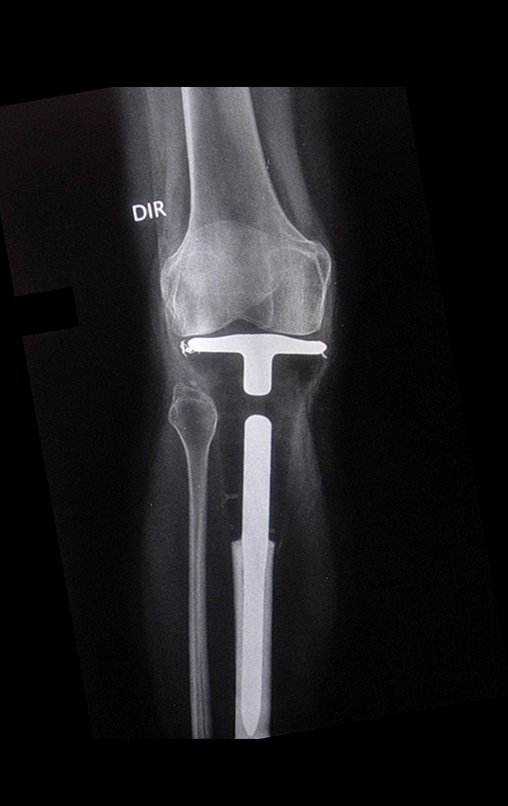
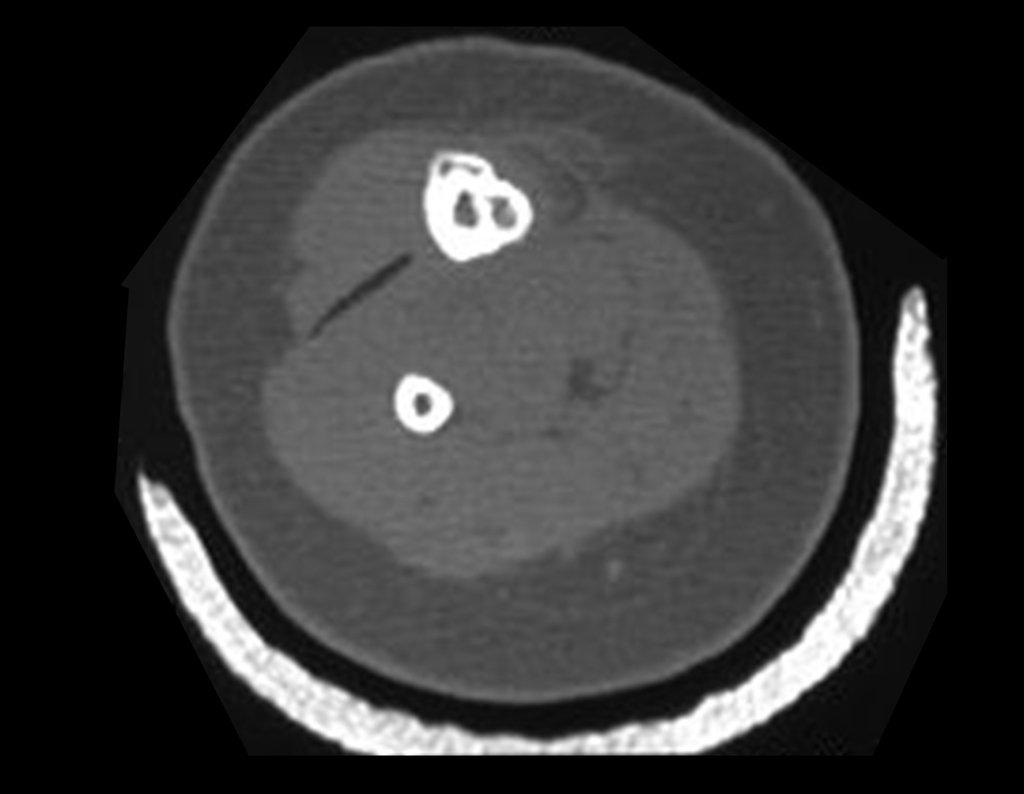
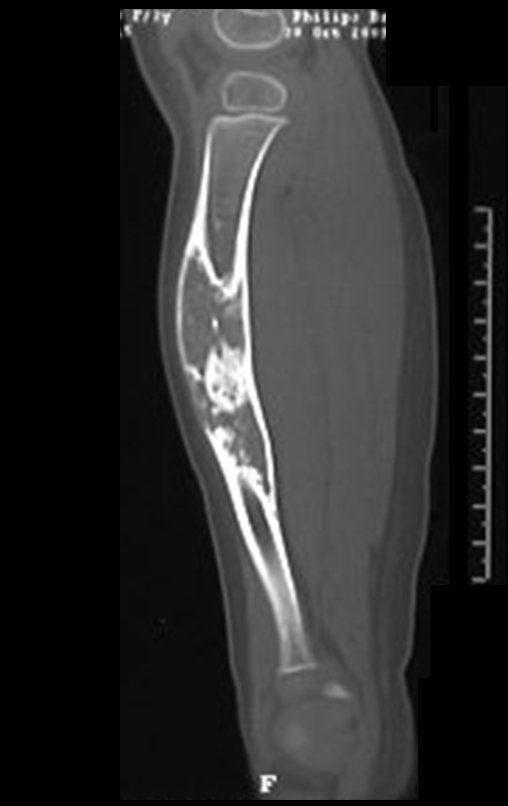
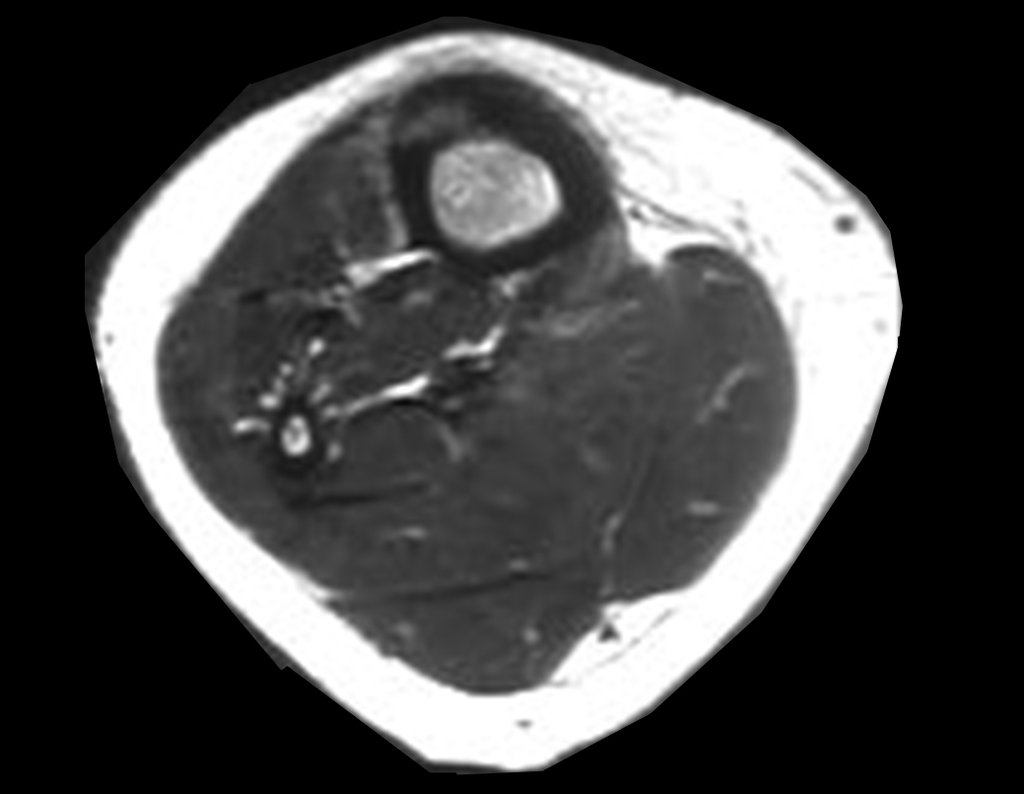
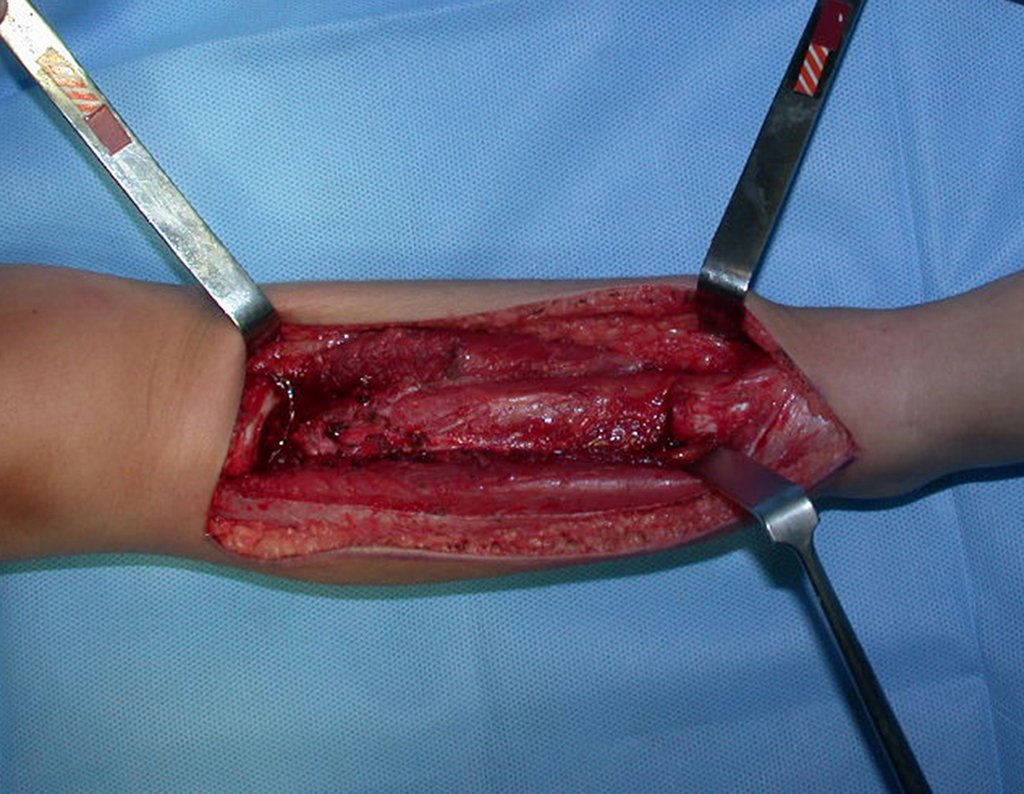
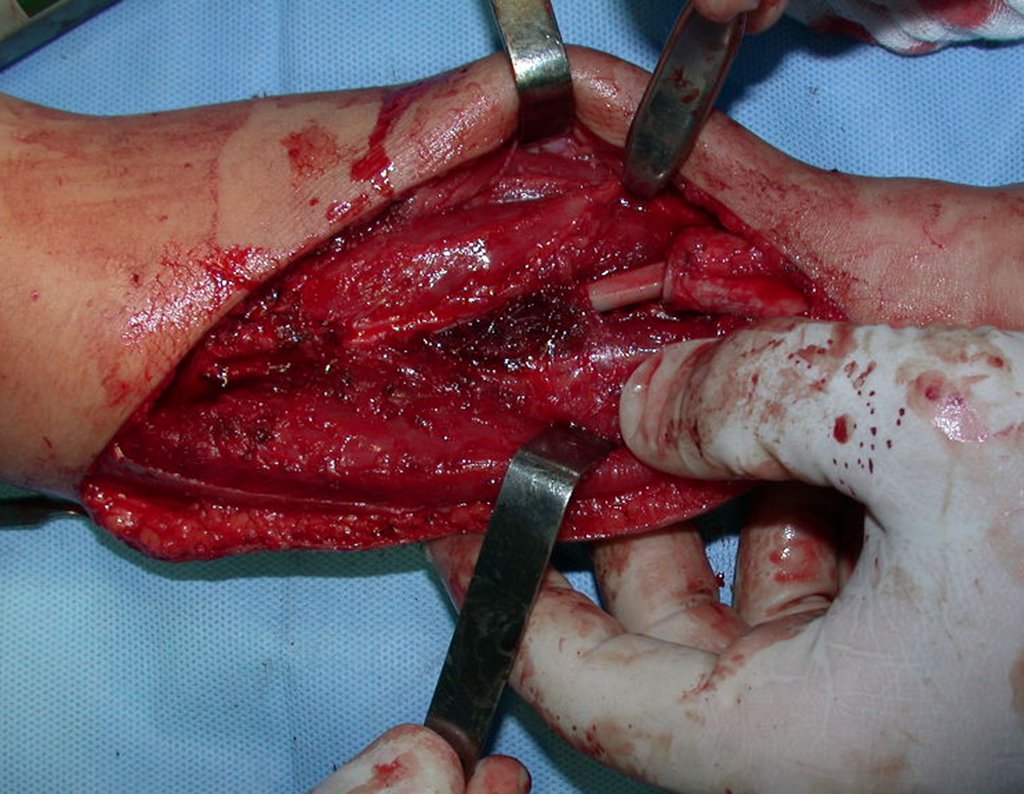
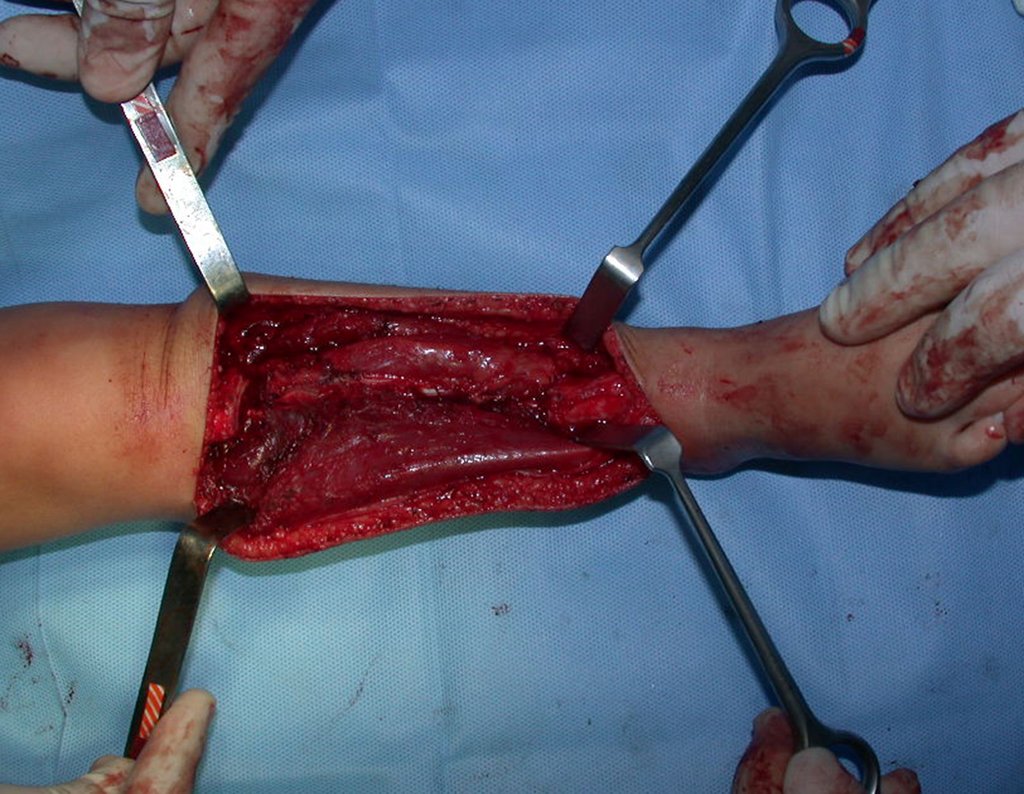
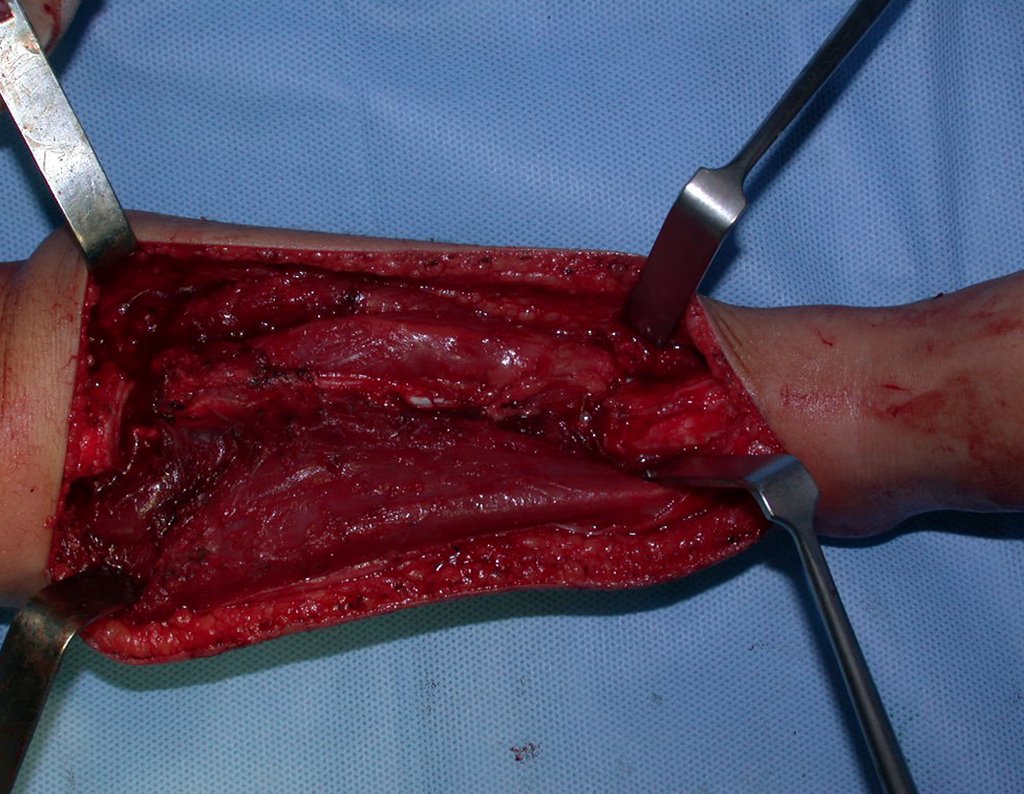
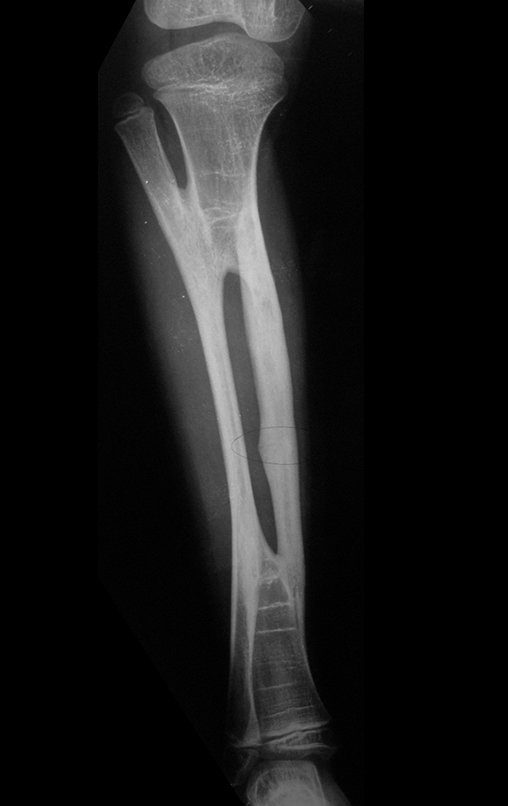
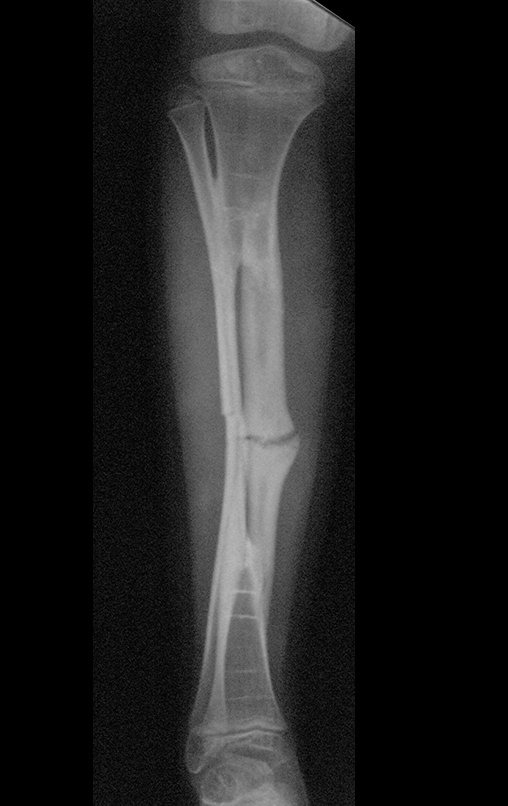
Sin embargo, este “fenómeno” de quiste óseo aneurismático puede aparecer junto a otras lesiones tumorales como osteoblastoma , condroblastoma , fibroma condromixoide, tumor de células gigantes , osteosarcoma teleangiectásico , displasia fibrosa y tumor pardo de hiperparatiroidismo , además de lesiones metastásicas secundarias a tiroides o neoplasia renal . Estos tumores con su histología característica pueden presentar áreas aisladas del clásico quiste óseo aneurismático. Por lo tanto, pequeños fragmentos de biopsia pueden dificultar un diagnóstico preciso (fig. 3).
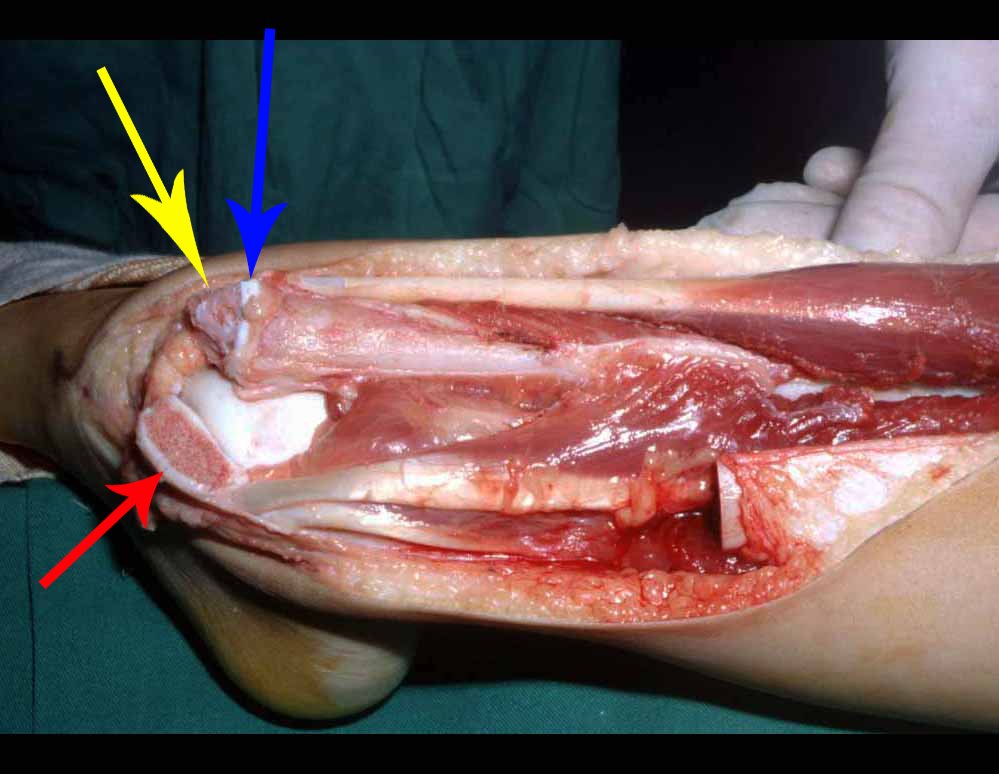
Se observa que la lesión presenta áreas de contenido líquido ( a-COA ) y áreas sólidas ( b-TGC ).
Se debe analizar cuidadosamente la anamnesis y las imágenes de la lesión, se debe elegir el sitio de la biopsia que permita tomar una muestra de las diferentes áreas que aparecen heterogéneas en la resonancia magnética, para permitir un diagnóstico certero.
El quiste óseo aneurismático clásico tiene un aspecto homogéneo, mientras que las lesiones tumorales antes mencionadas, cuando se acompañan de áreas de quiste óseo aneurismático, necesariamente se vuelven heterogéneas.
Es más frecuente en las tres primeras décadas de la vida, con su pico de incidencia entre los 5 y 20 años, con ligero predominio en el sexo femenino.
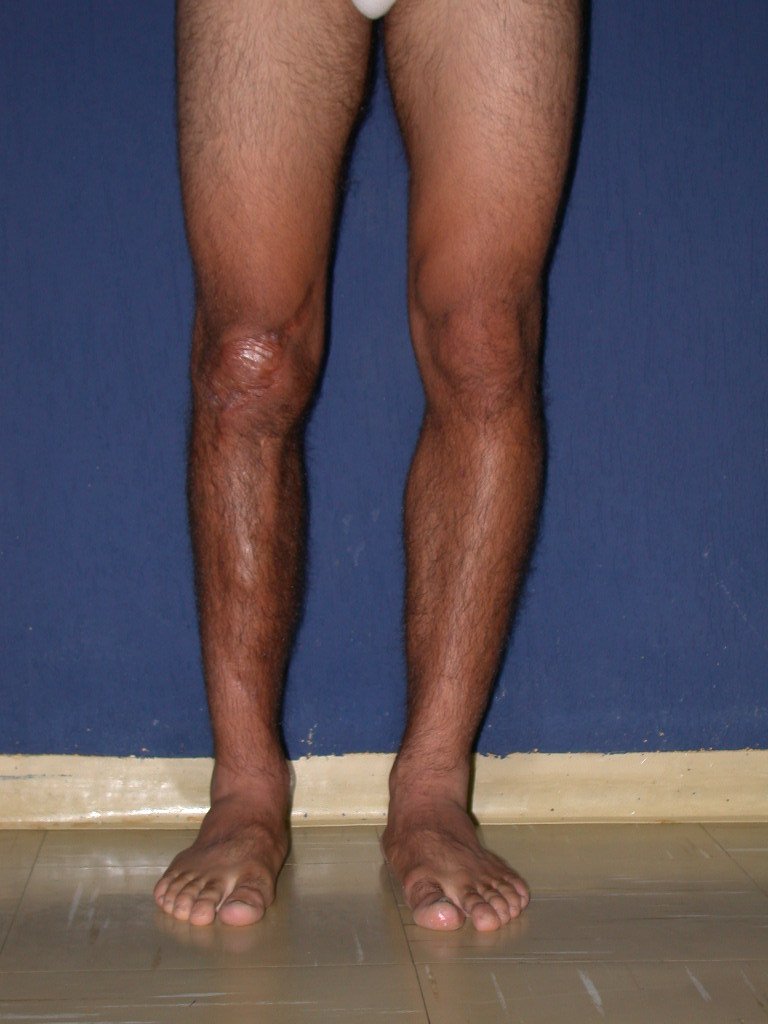
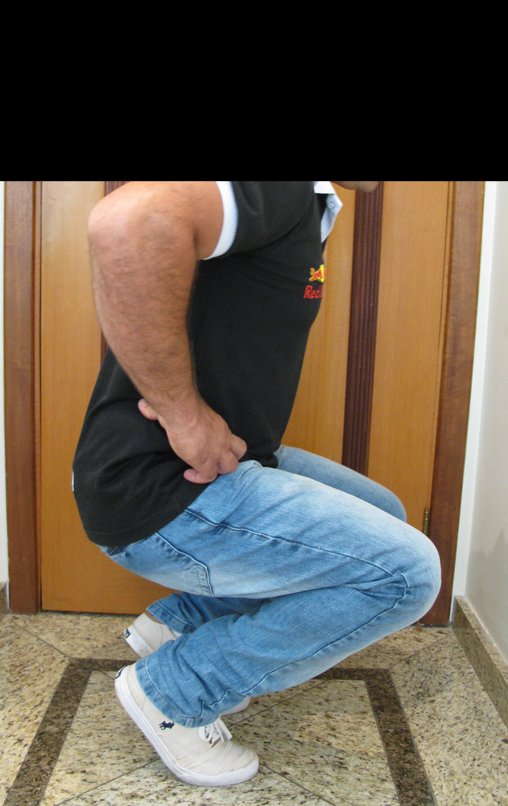
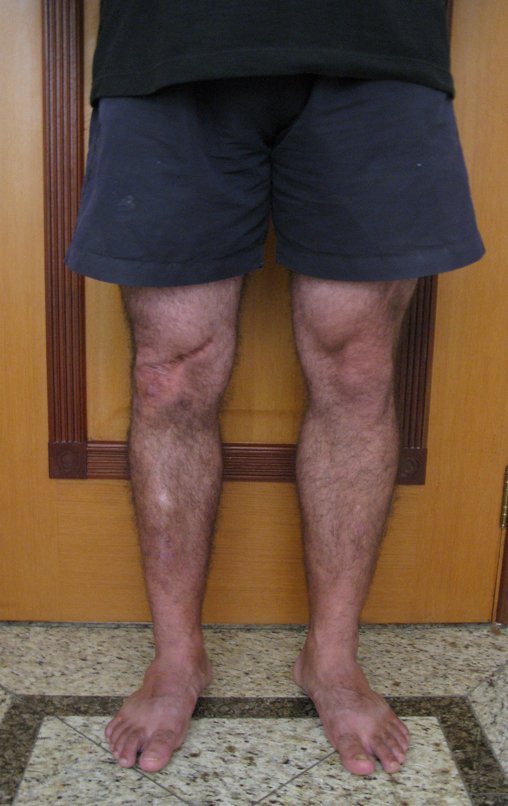
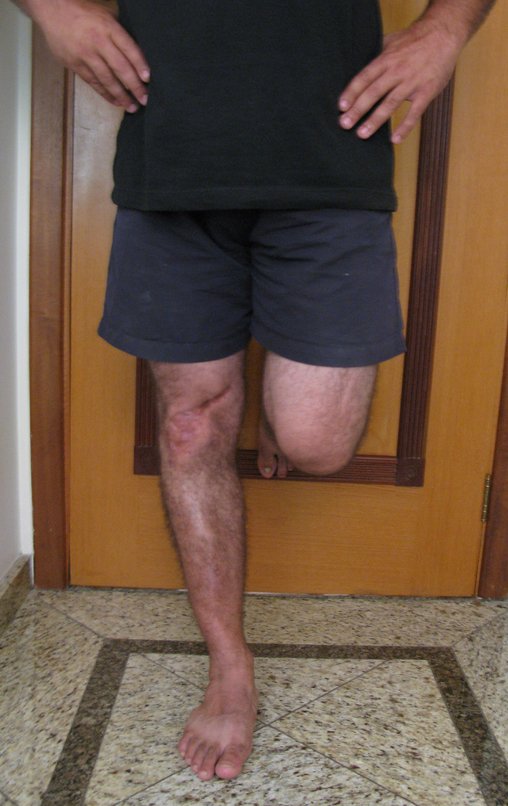
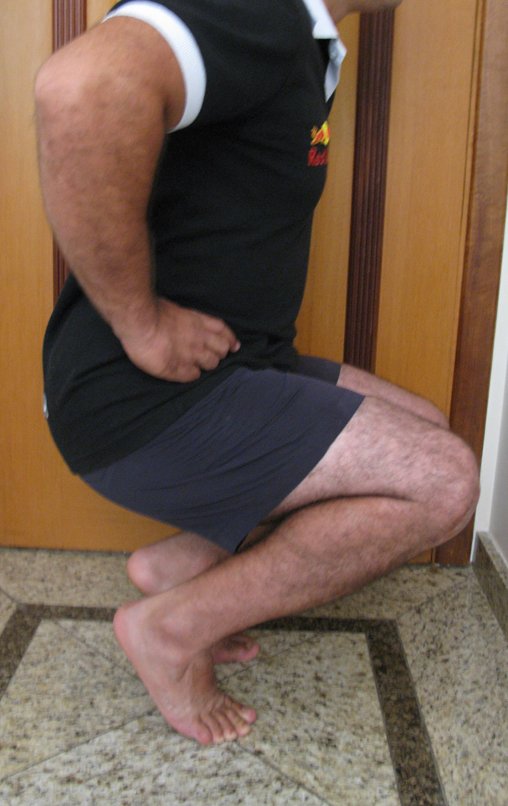
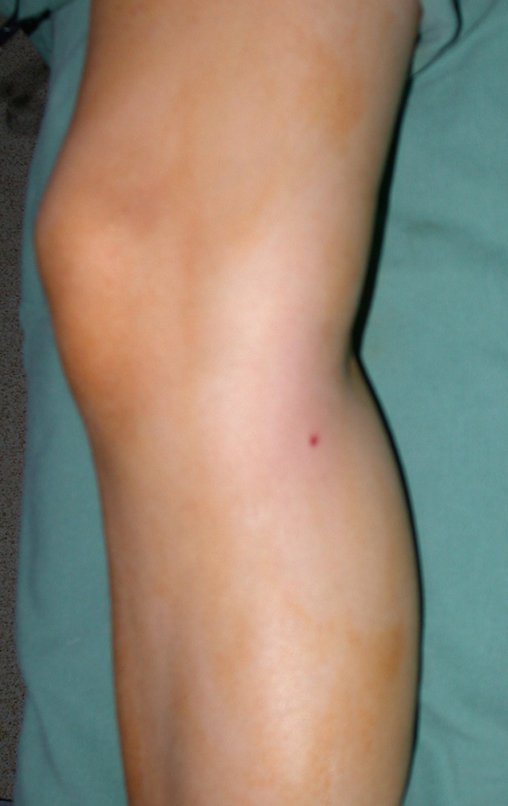
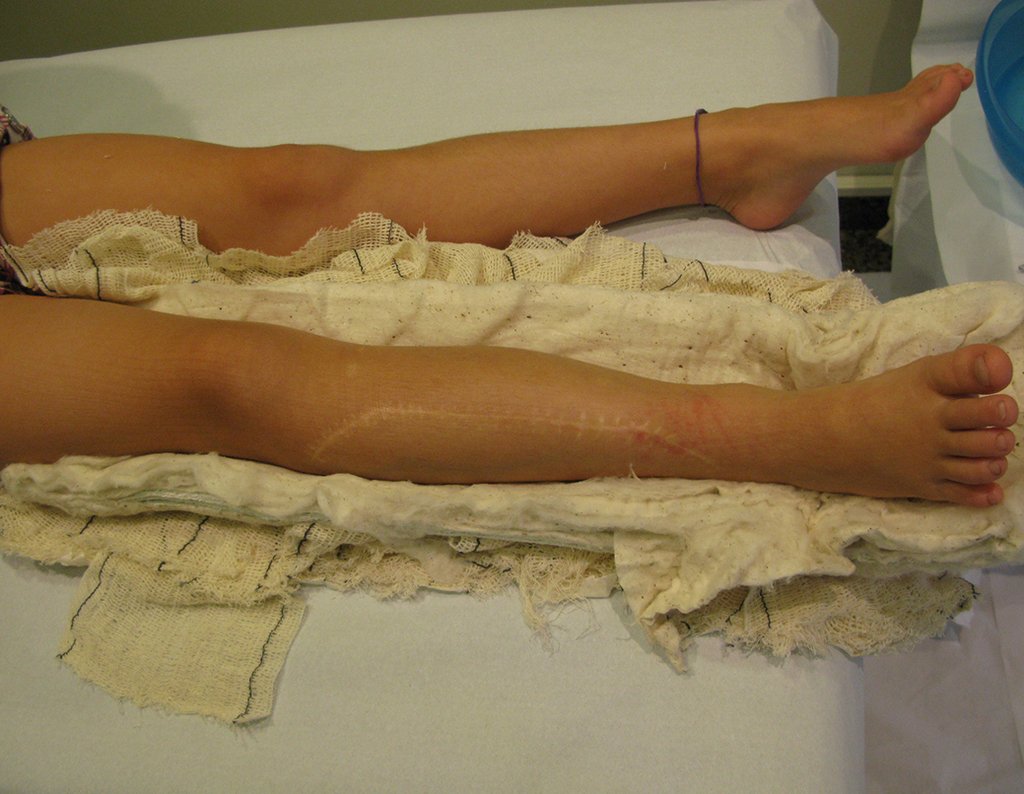
El paciente generalmente presenta dolor leve en el sitio de la lesión y cuando el hueso afectado es superficial se pueden observar signos inflamatorios como aumento de volumen y calor. Generalmente, el paciente correlaciona la aparición de los síntomas con algún trauma.
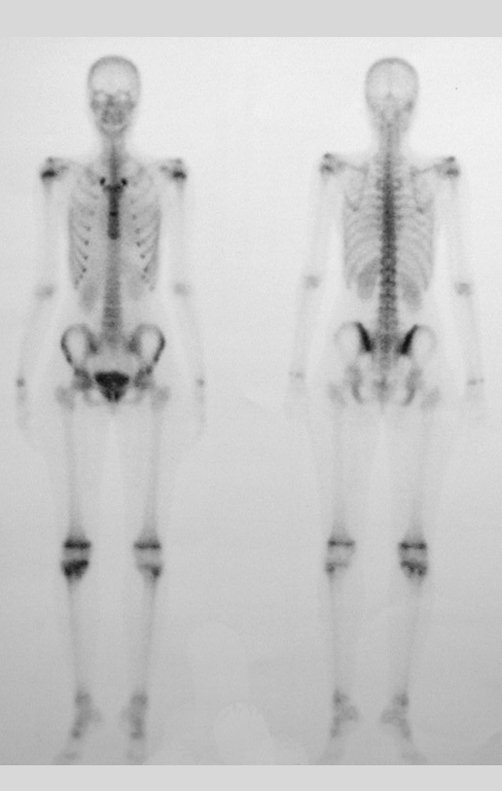
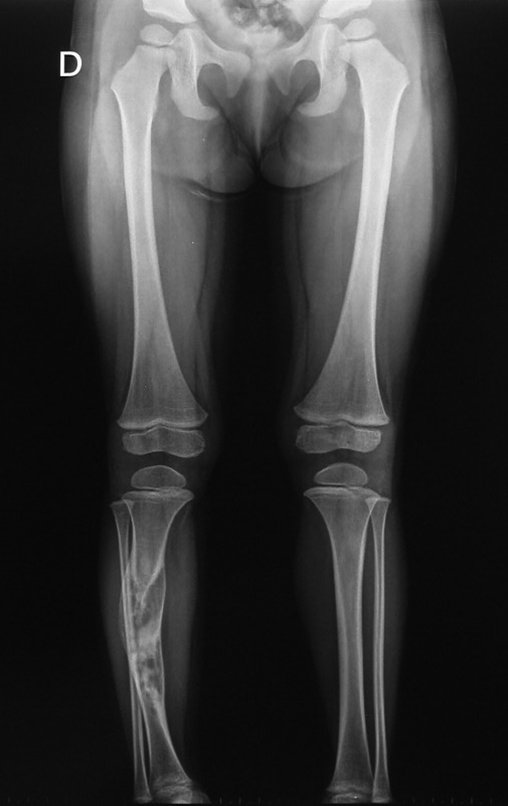
En la evolución puede haber un aumento lento, progresivo o rápidamente expansivo. Afecta a cualquier hueso, con mayor frecuencia a los miembros inferiores (tibia y fémur representan el 35% de los casos) y a las vértebras, incluido el sacro y en la pelvis principalmente a la rama iliopúbica. Pueden imitar síntomas articulares cuando se ubican en la epífisis. El compromiso en la columna puede provocar síntomas neurológicos compresivos, aunque en la mayoría de los casos afecta a las estructuras posteriores.
OBJETIVOS
Al final de la lectura de este capítulo, el lector podrá:
- conocer el grupo de lesiones pseudotumorales;
- caracterizar el típico quiste óseo aneurismático;
- determinar las pruebas de imagen necesarias para aclarar la lesión;
- hacer el diagnóstico diferencial;
- Elige el mejor tratamiento para cada situación.
ESQUEMA CONCEPTUAL: COA
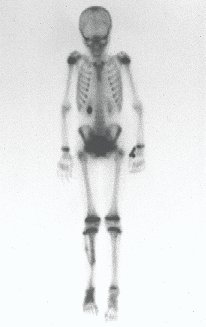
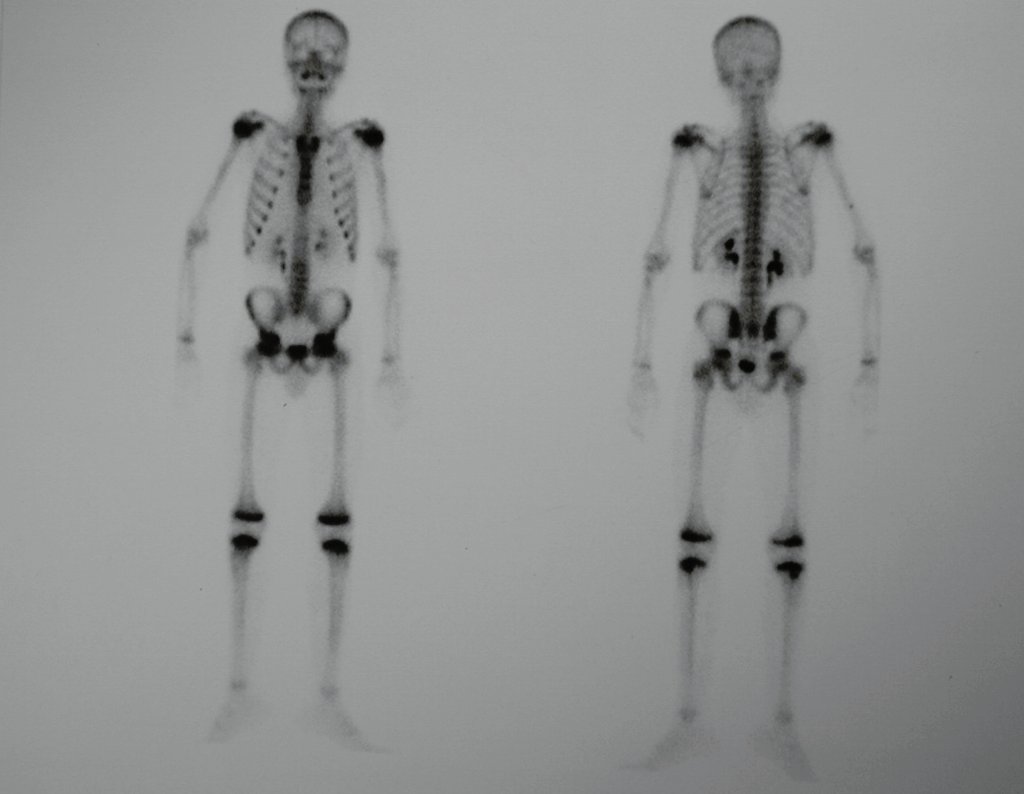
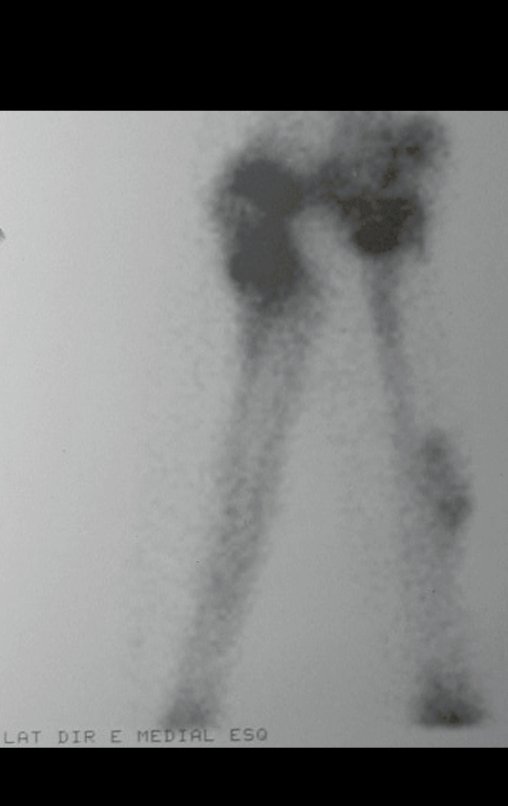
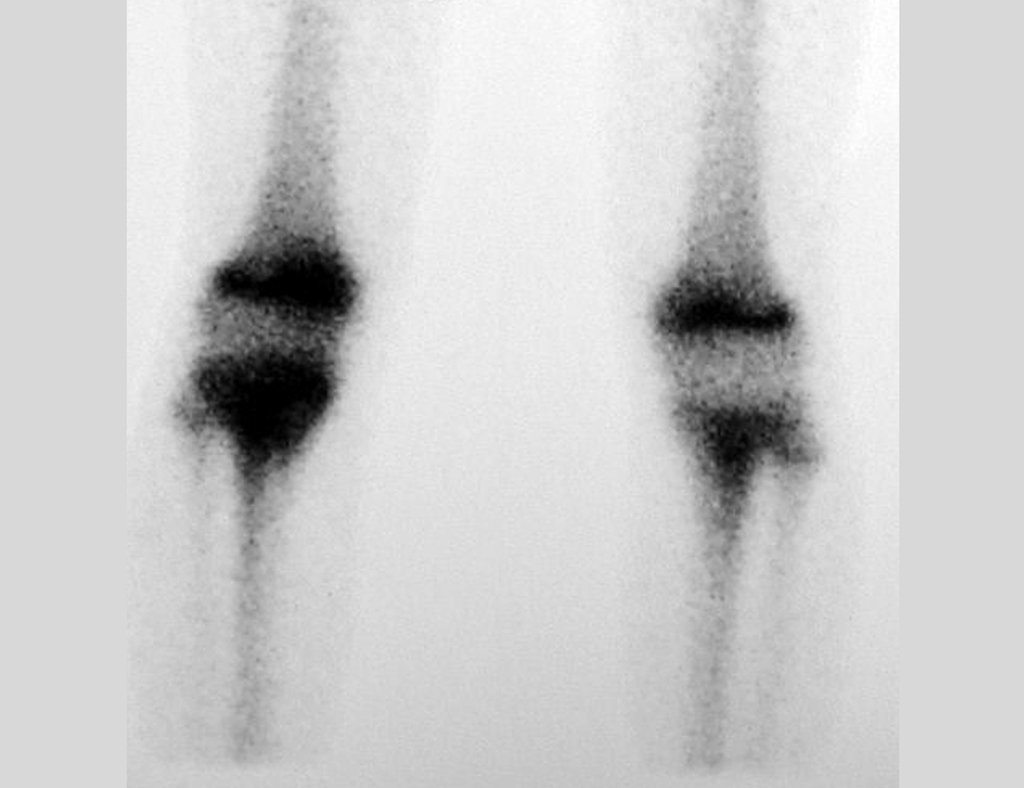
En la estadificación ósea realizada con gammagrafía encontramos una lesión única con discreta captación en la periferia de la lesión.
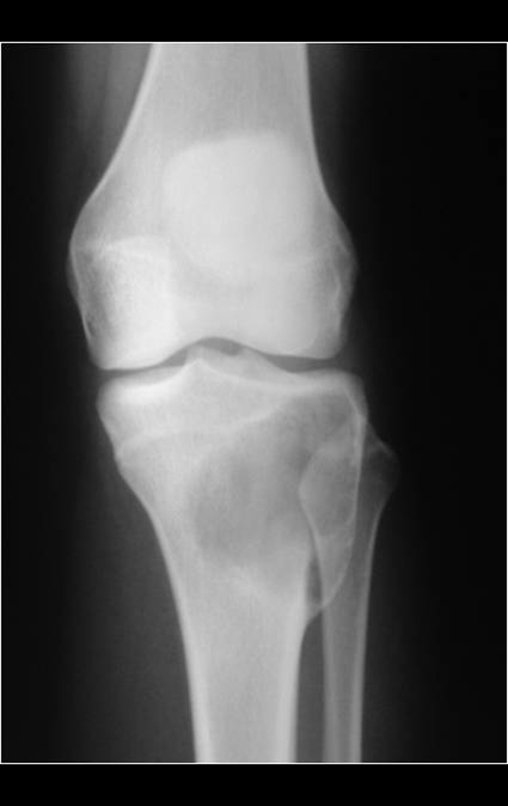
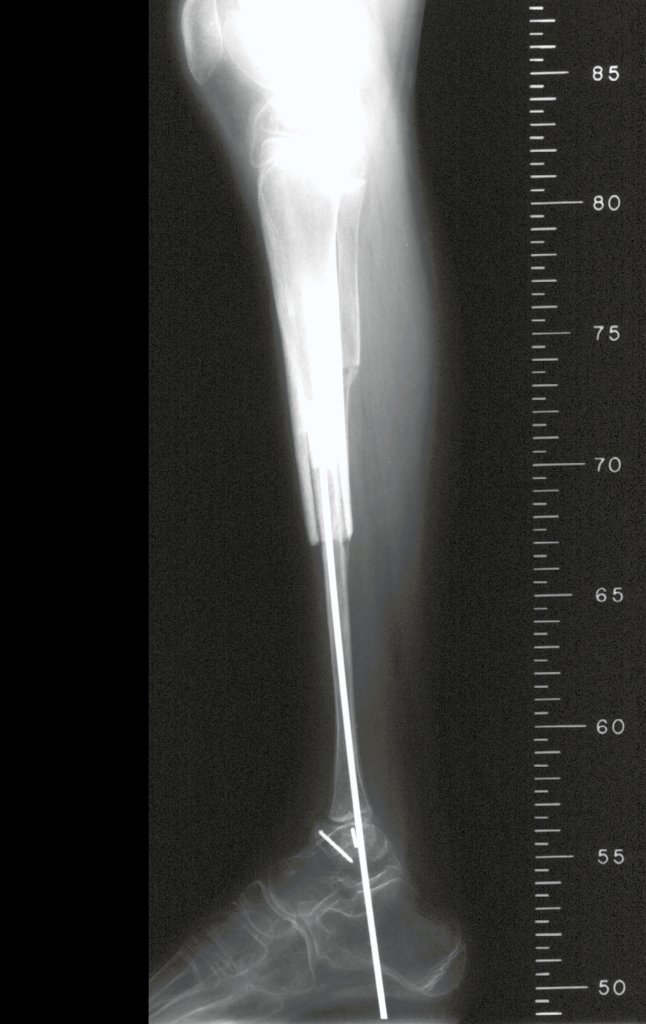
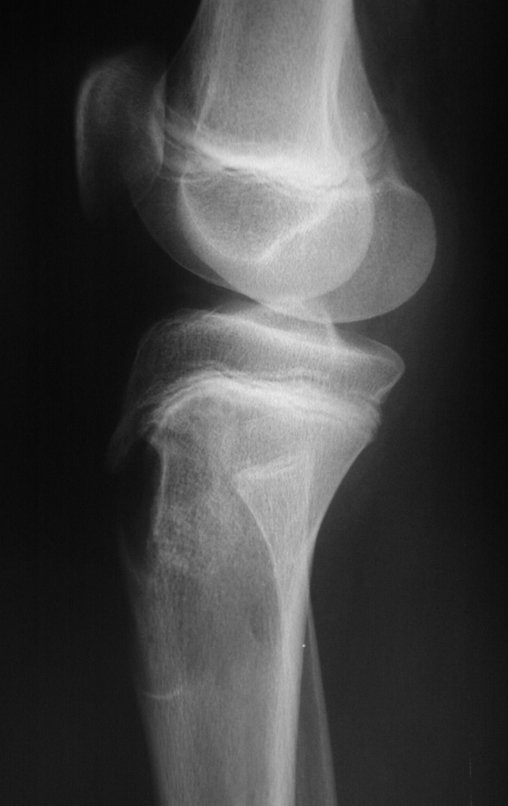
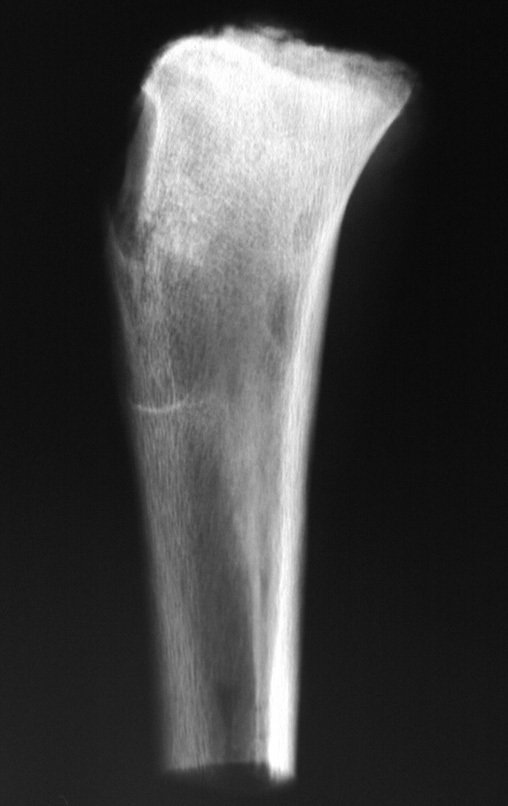
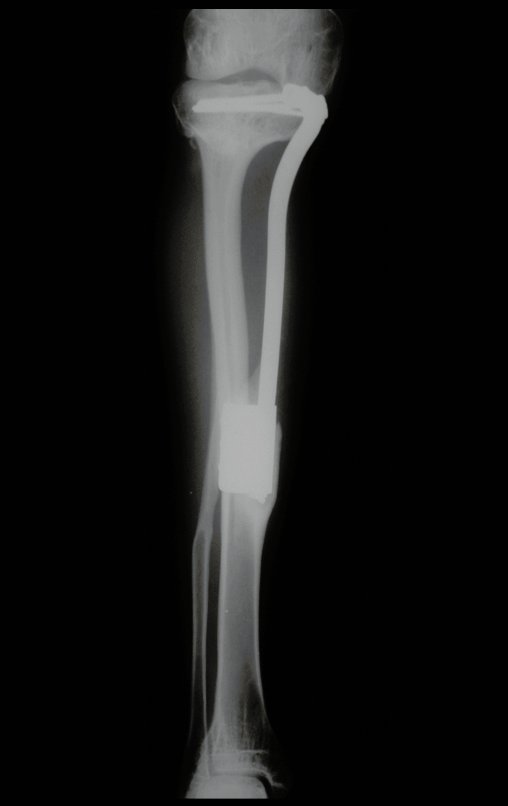
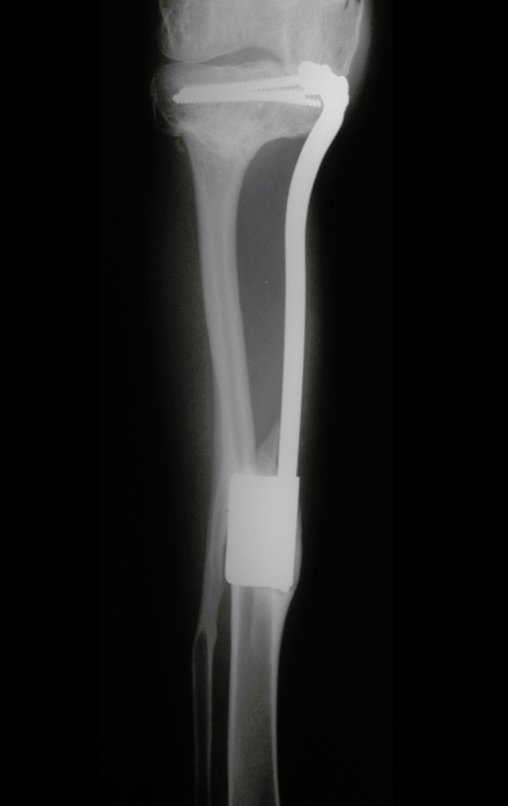
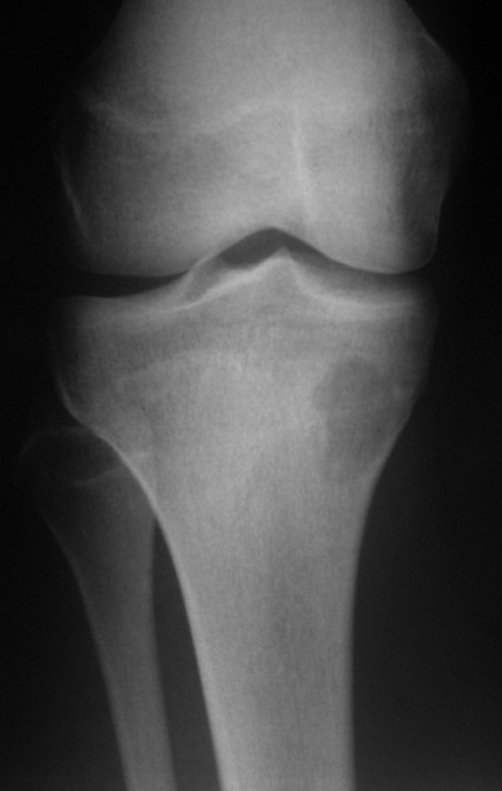
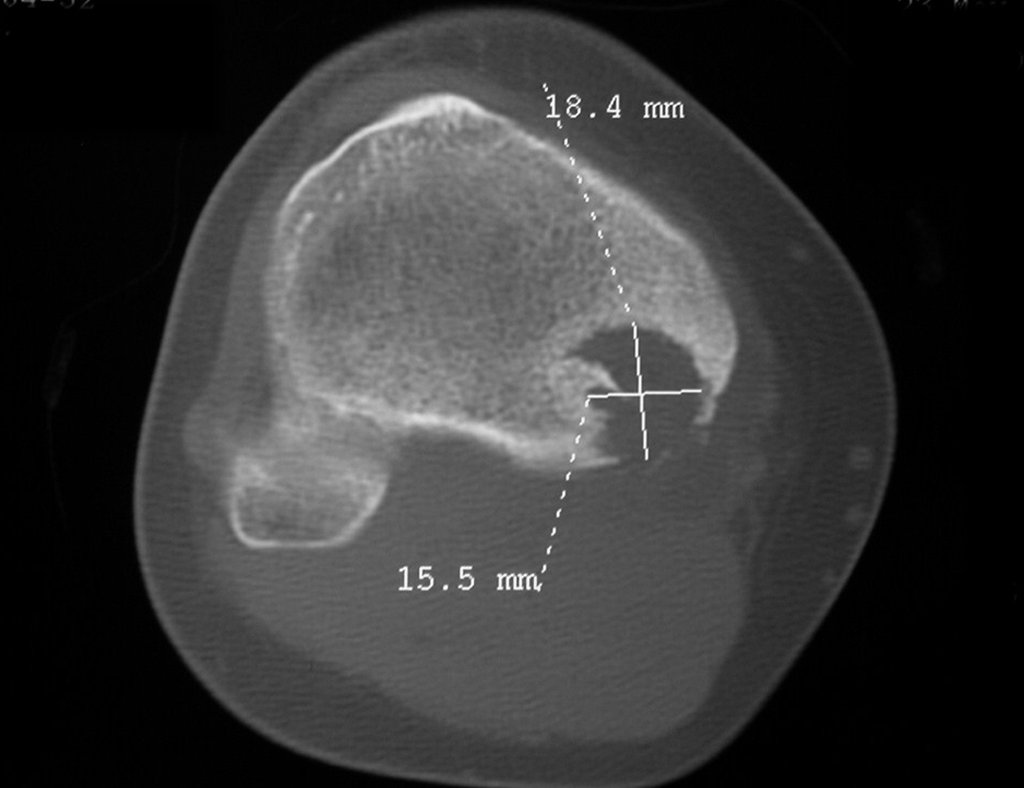
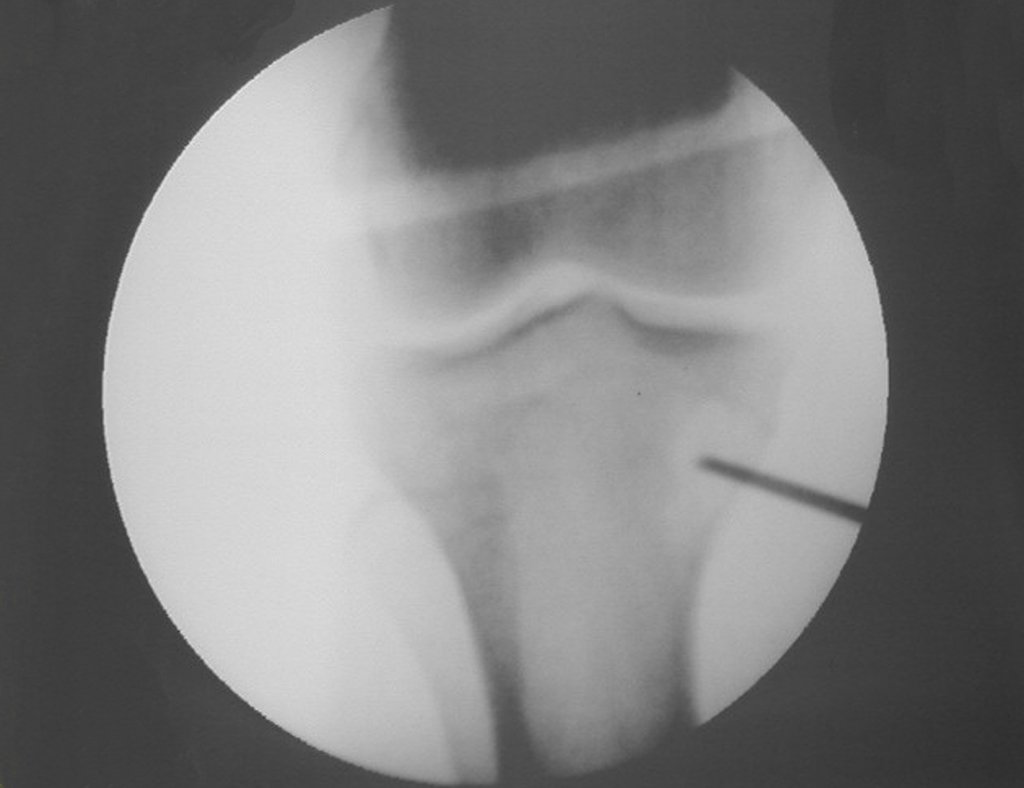
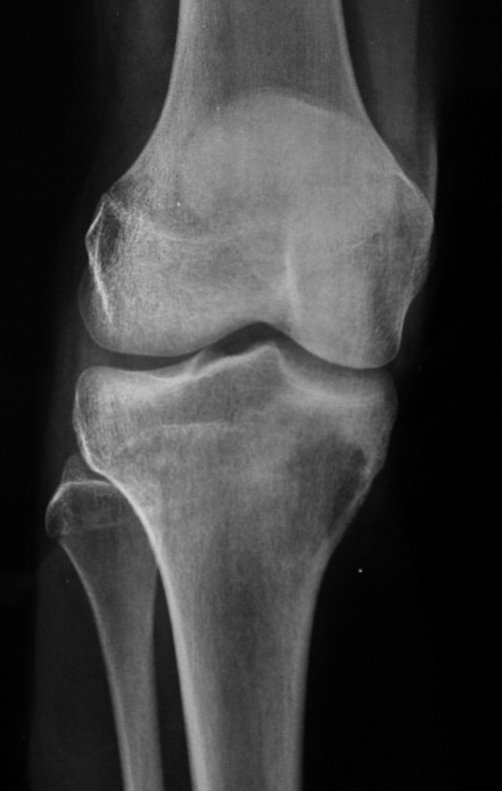
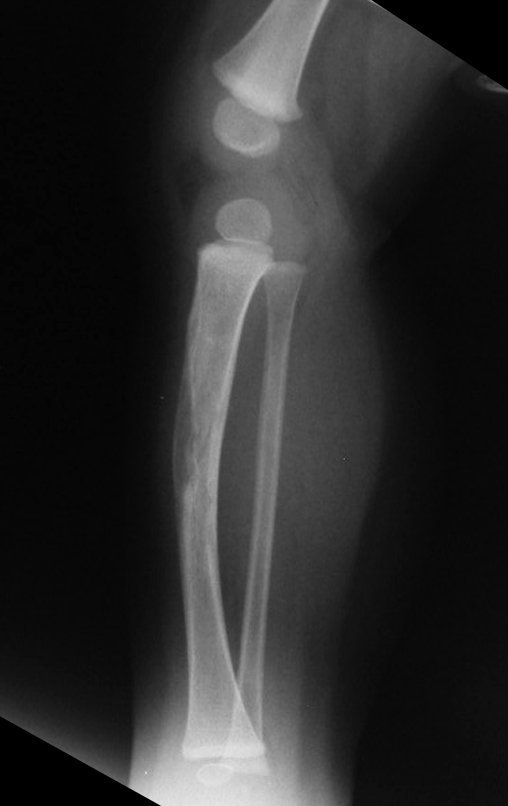
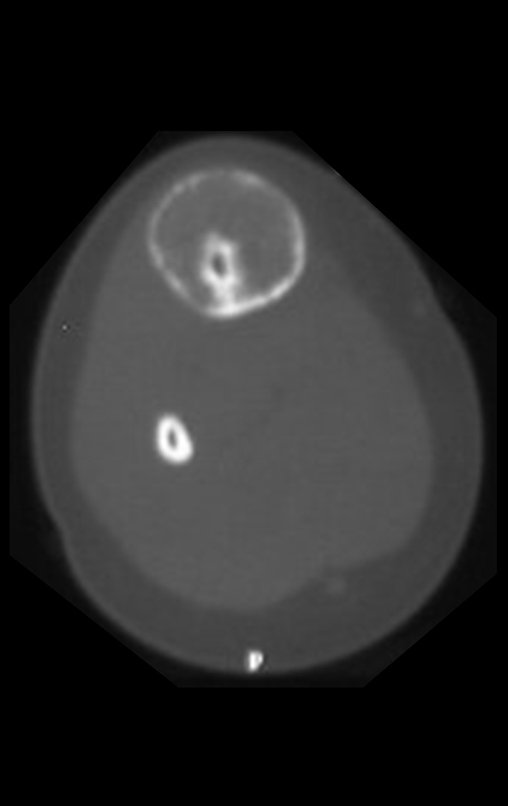
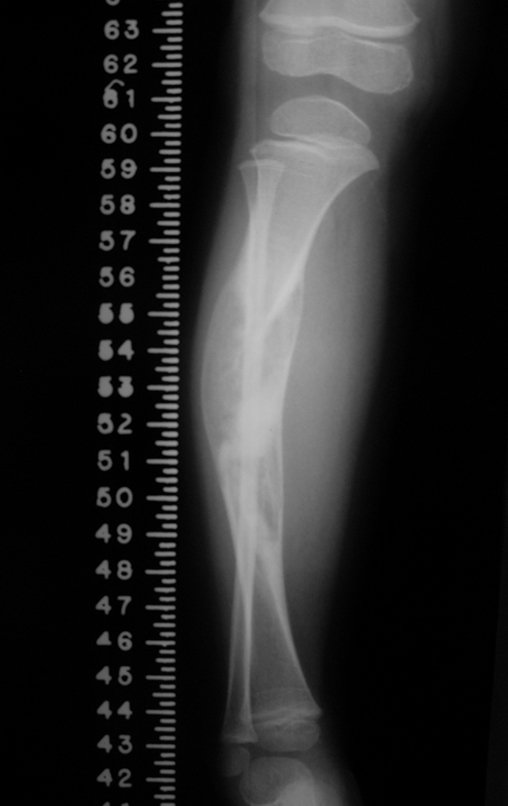
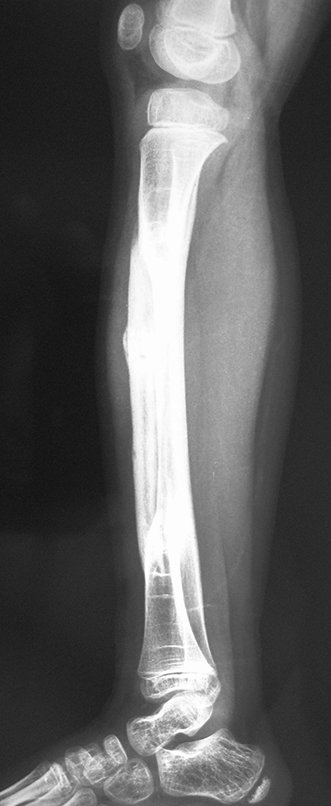
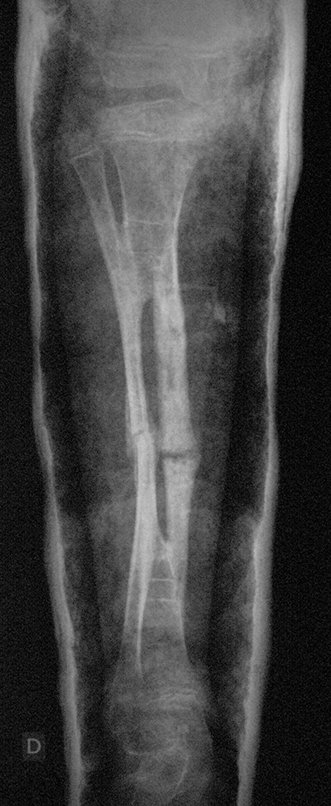
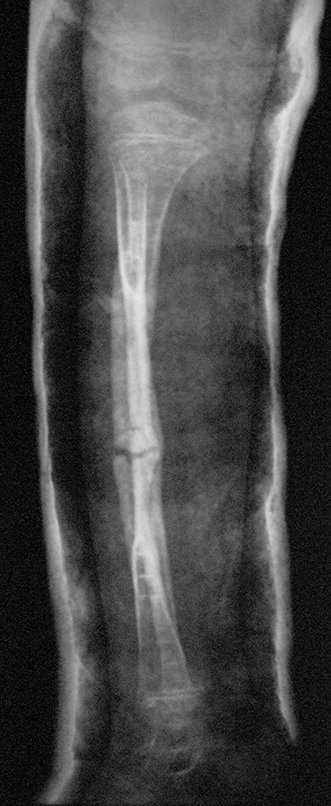
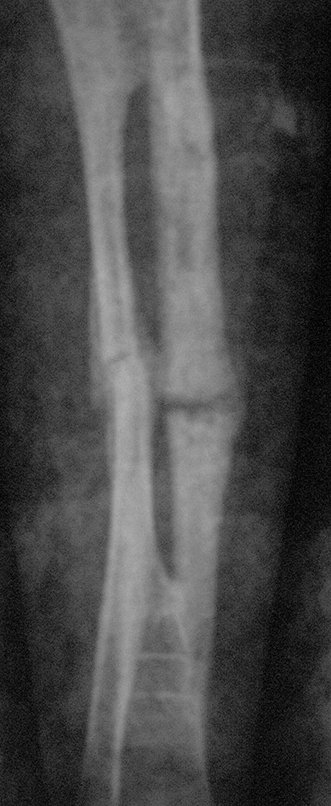
Radiográficamente se presenta como una lesión de insuflación radiolúcida, preferentemente en la región metafisaria de los huesos largos (también puede presentarse en epífisis y diáfisis), con presencia de septos dispersos por todo su contenido, de aspecto “ampolloso” (o en panal). , con adelgazamiento y expansión de la corteza, excéntrica en el 50% de los casos o de localización central. También pueden ocurrir centralmente en el hueso cortical y en menos del 8% de los casos en la superficie.
El aspecto radiológico, sin embargo, es homogéneo. A medida que avanza la lesión se puede formar un triángulo de Codman, dando una falsa impresión de invasión de tejidos blandos, lo cual no ocurre porque la lesión siempre tiene una superficie de tejido conectivo que la circunscribe (pseudocápsula que delimita el área de lesión de la zona comprometida). hueso y tejidos adyacentes).
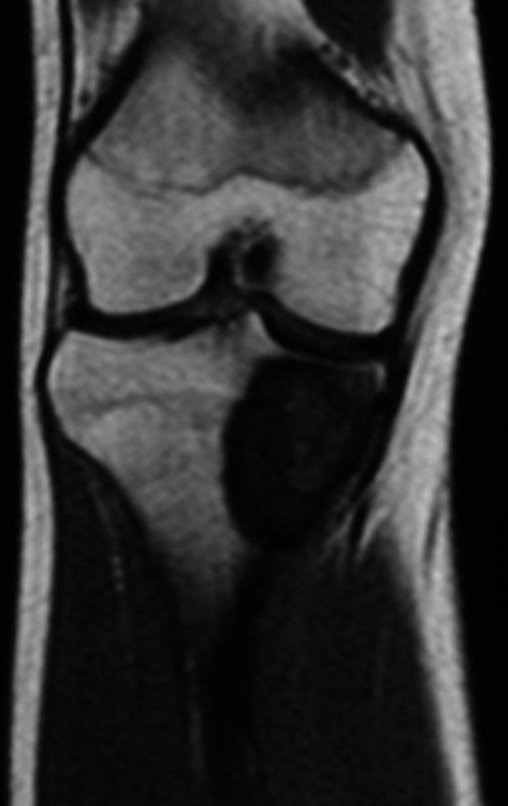
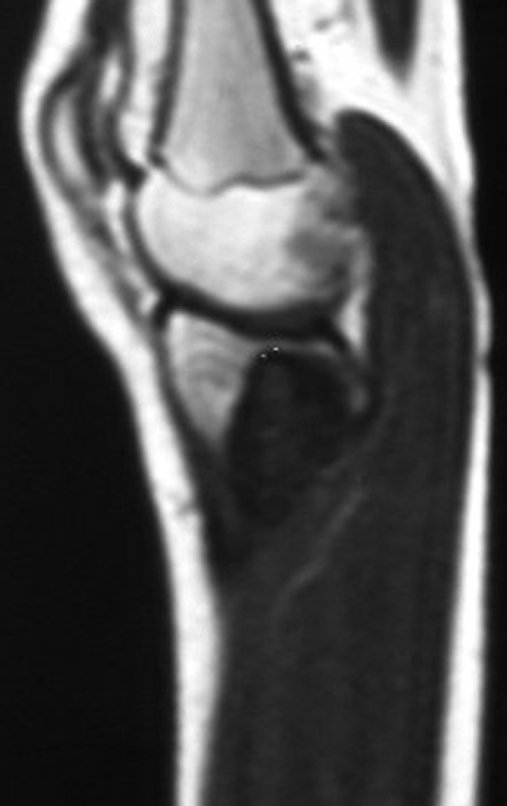
La resonancia magnética, al realizar cortes en diferentes planos, suele mostrar la presencia de niveles de líquido, destacando las numerosas bolsas separadas por los tabiques conectivos. El diagnóstico de quiste óseo aneurismático mediante biopsia se acepta con mayor facilidad cuando el análisis por resonancia magnética de toda la lesión no revela ningún aspecto heterogéneo. La presencia de una estructura heterogénea en la resonancia magnética, en la que la zona sólida presenta impregnación de contraste, implica la necesidad de obtener una muestra de esta zona para el diagnóstico, ya que debe tratarse de un caso de asociación de un quiste óseo aneurismático con uno de los lesiones antes mencionadas.
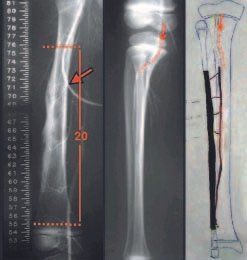
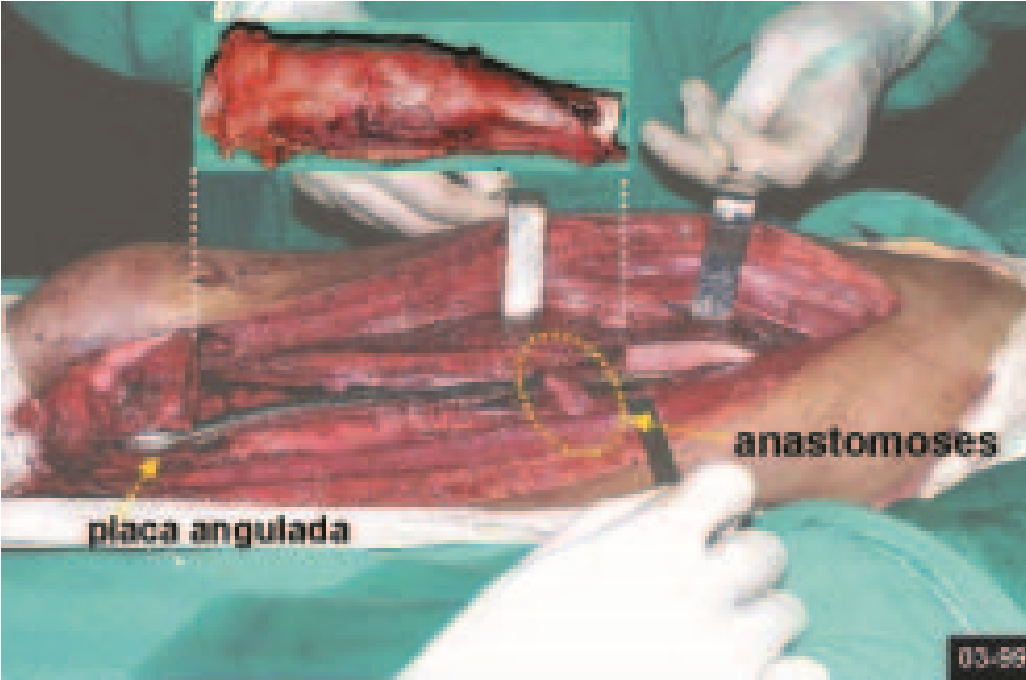
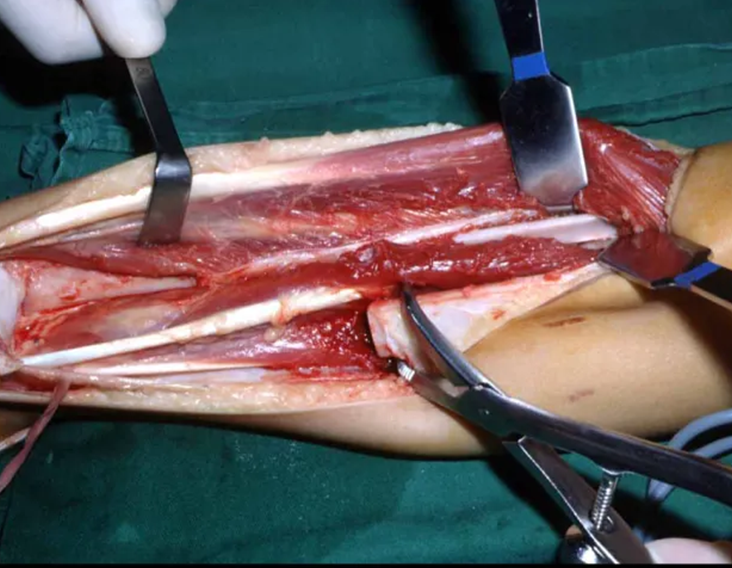
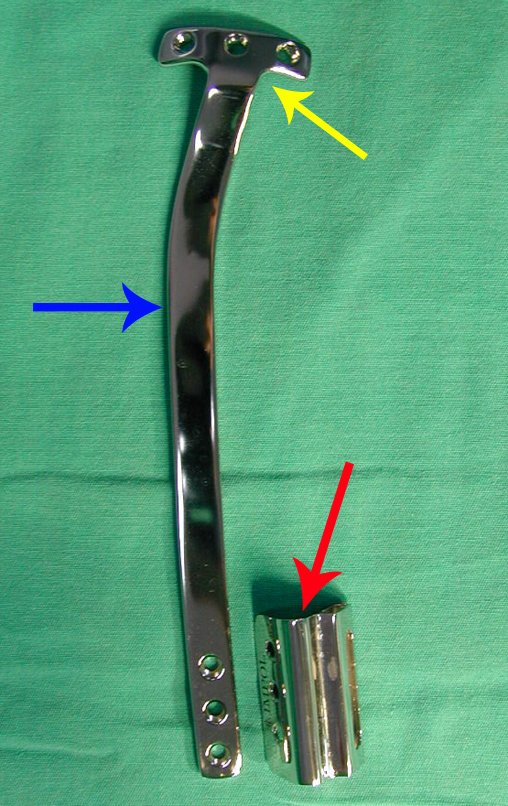
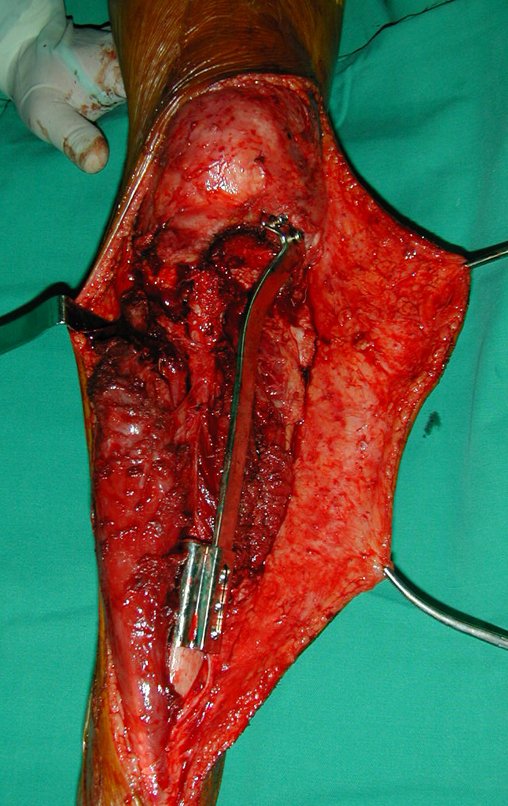
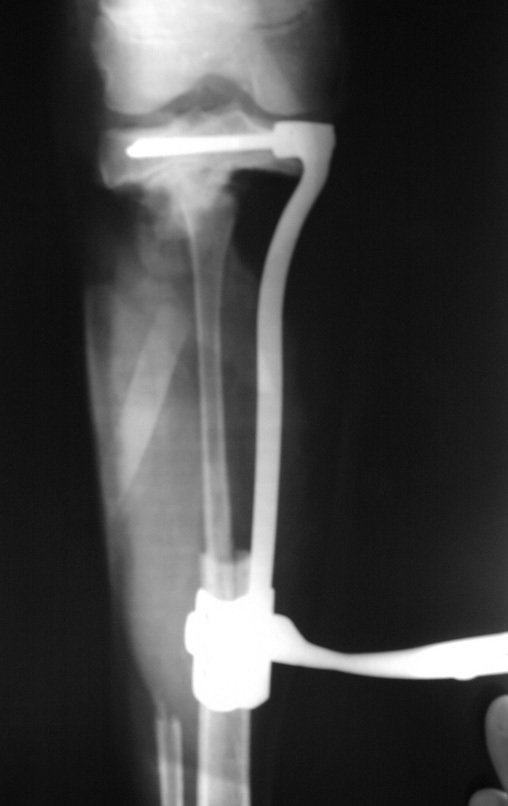
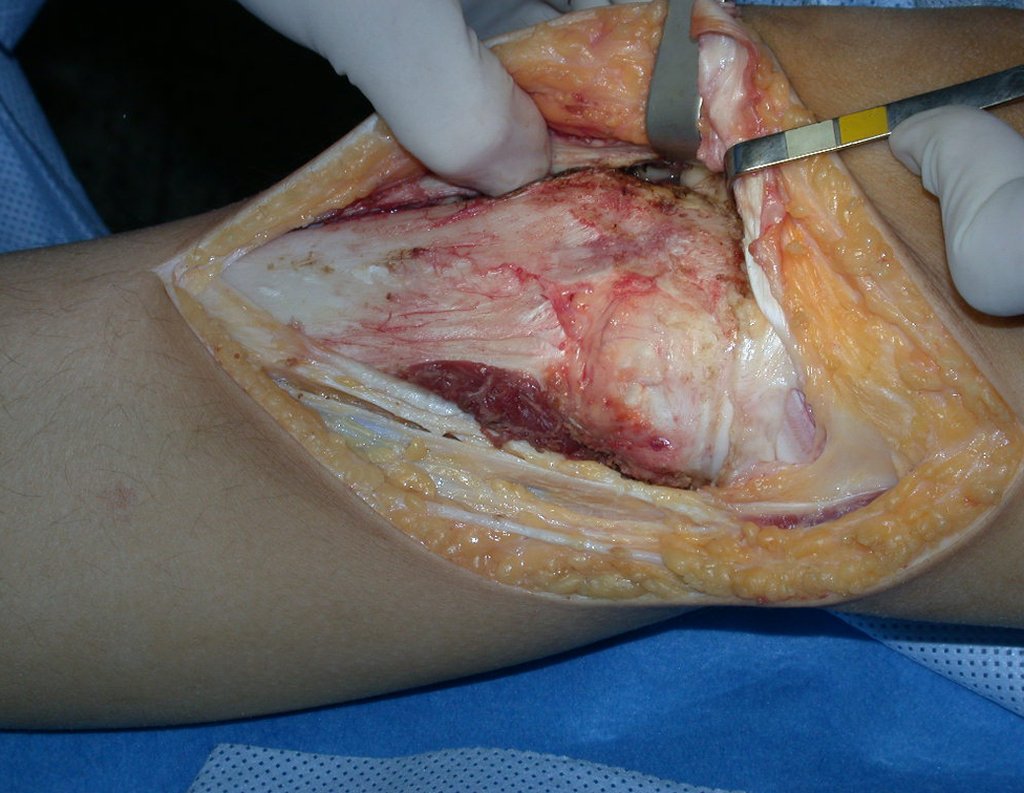
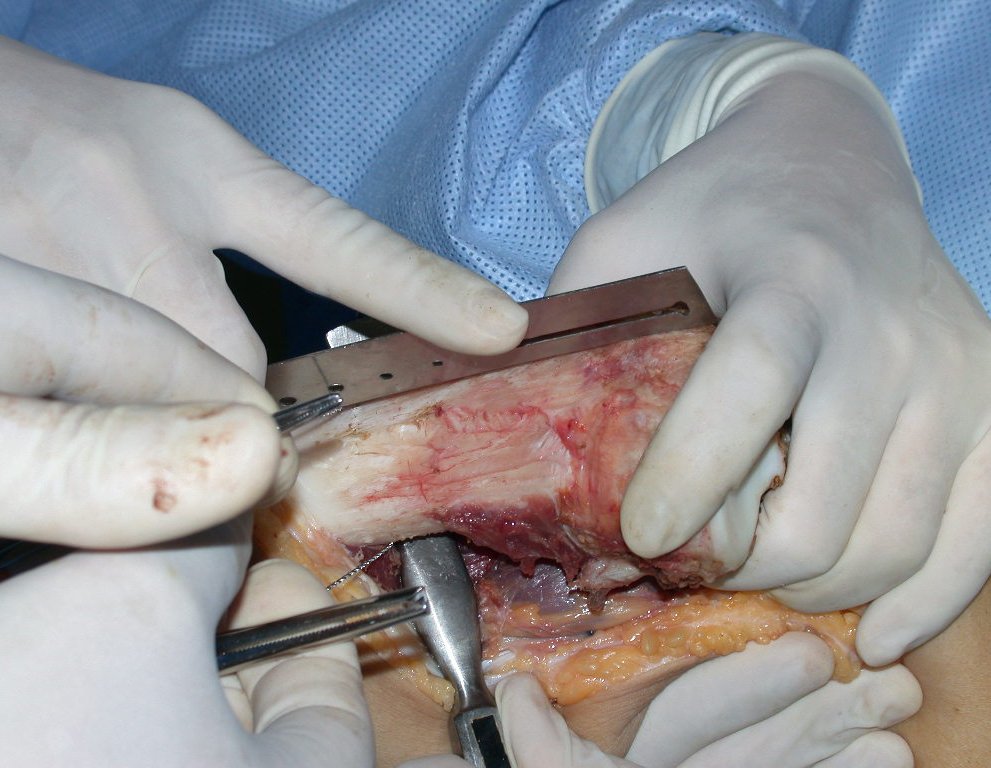
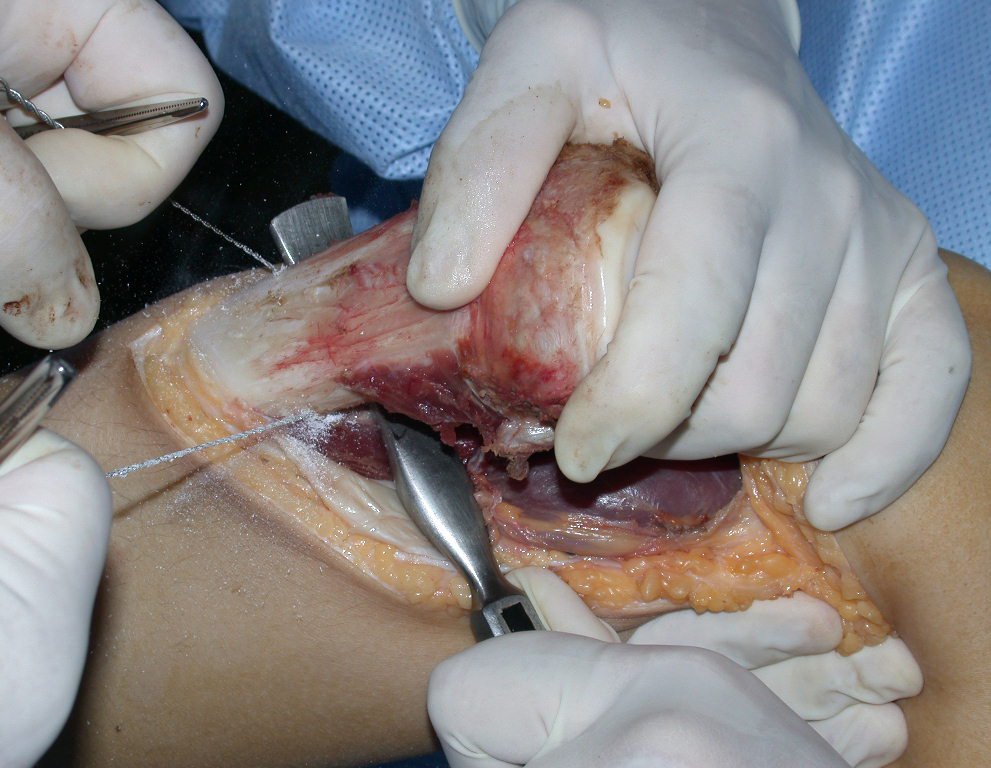
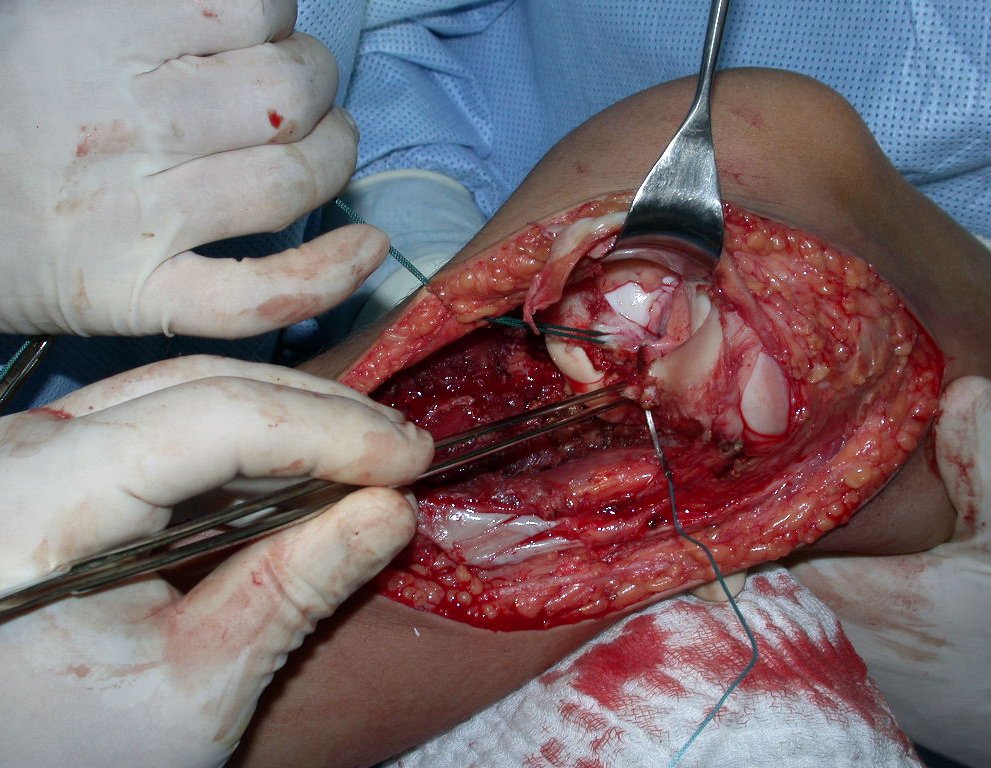
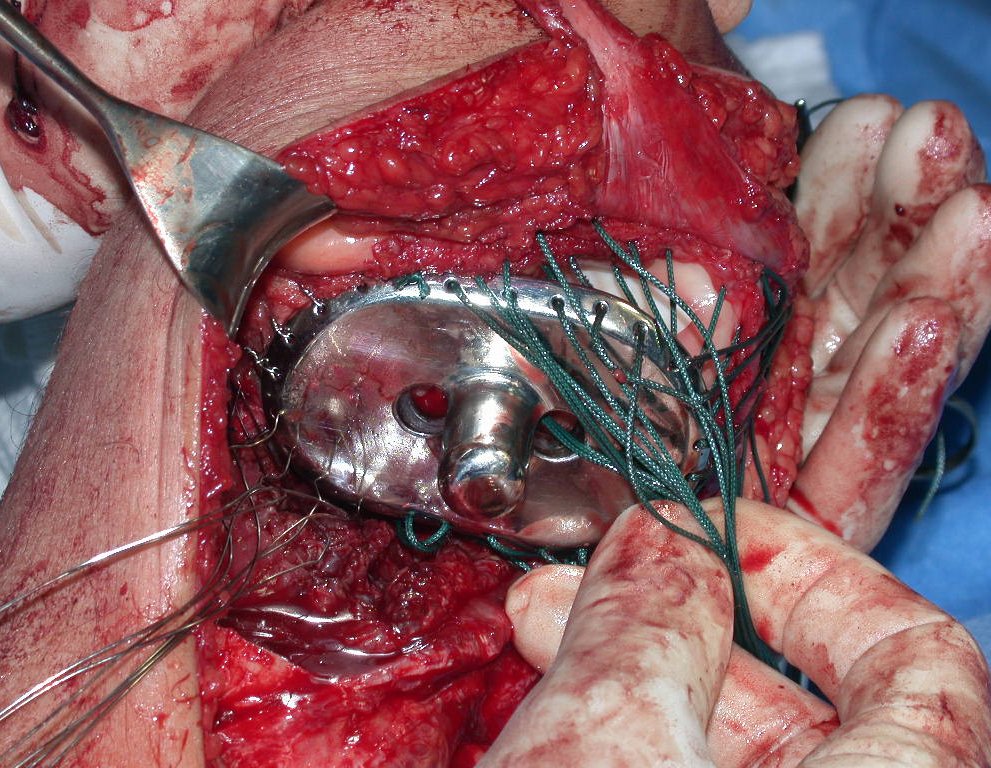
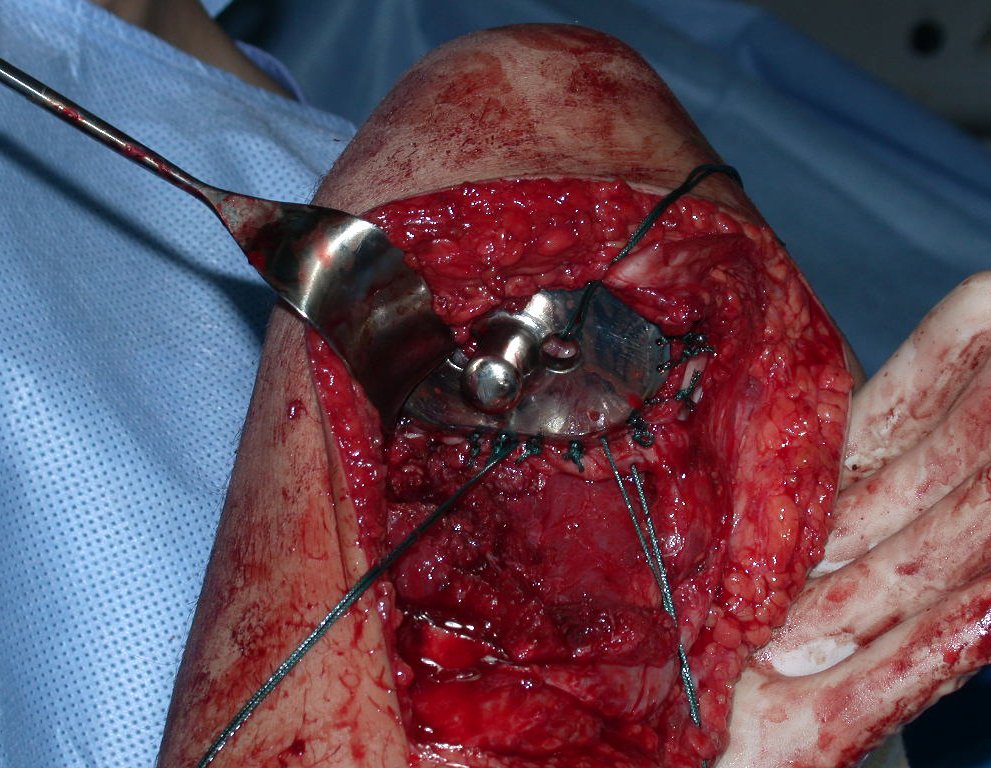
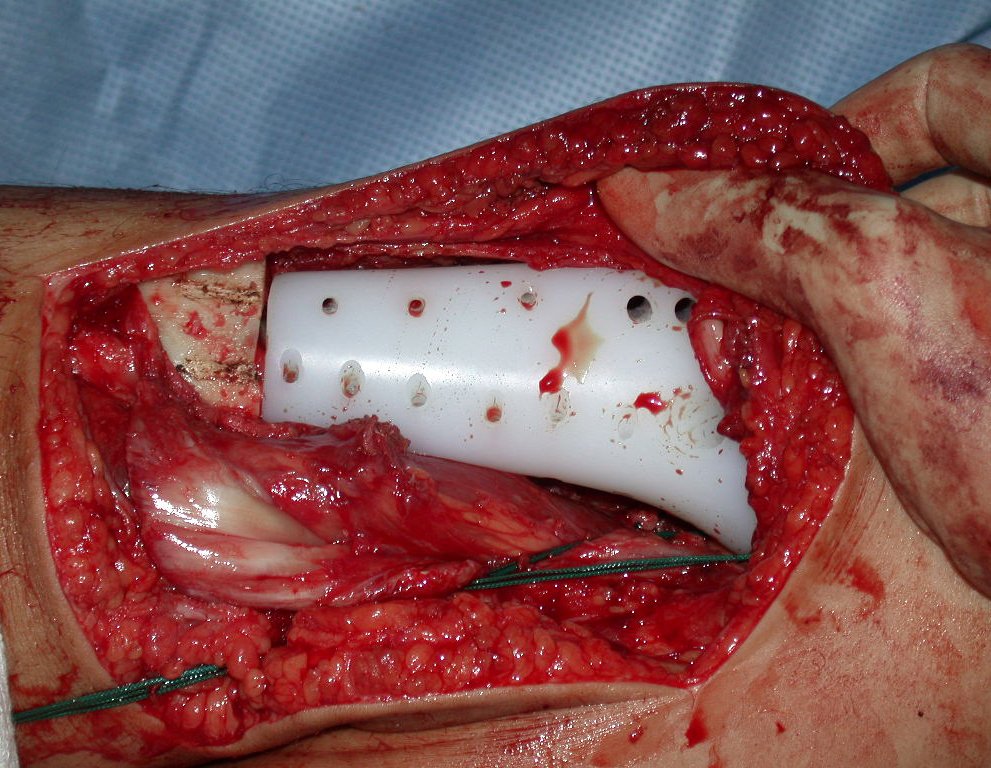
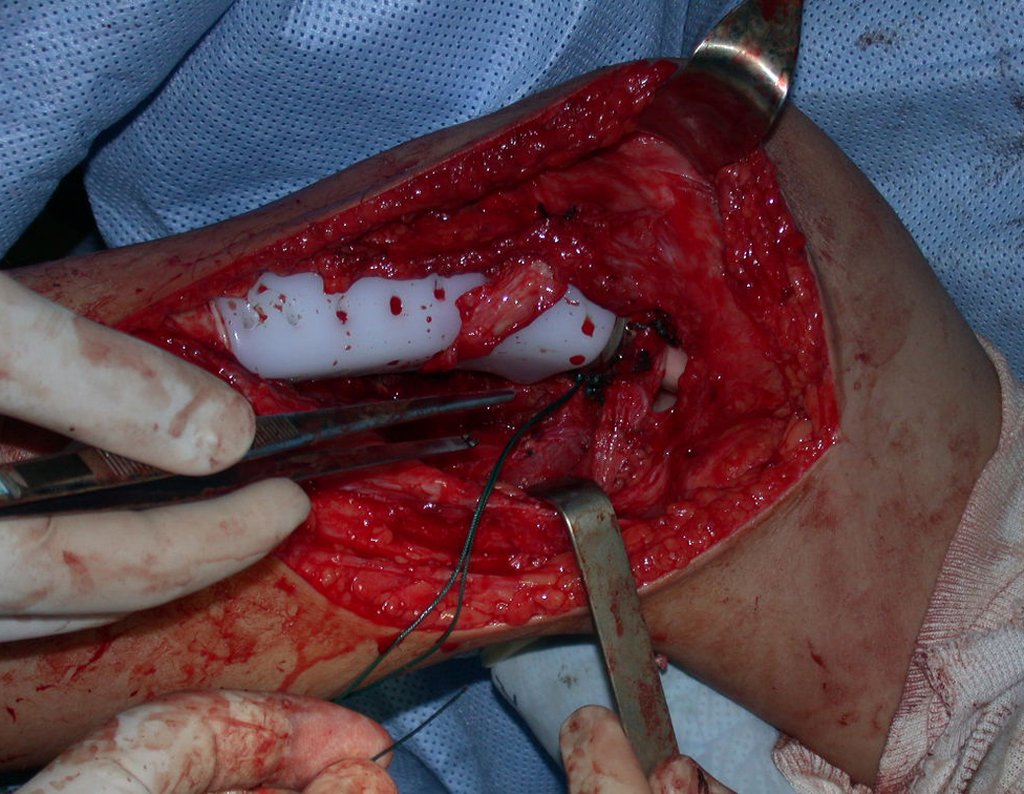
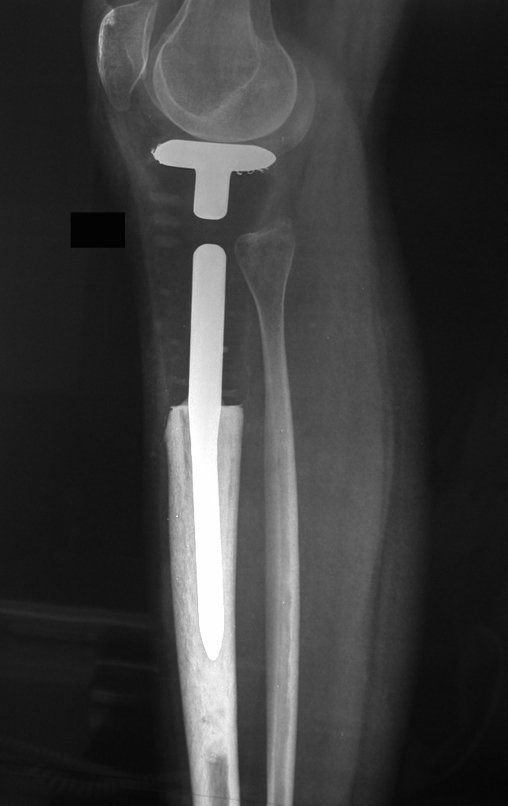
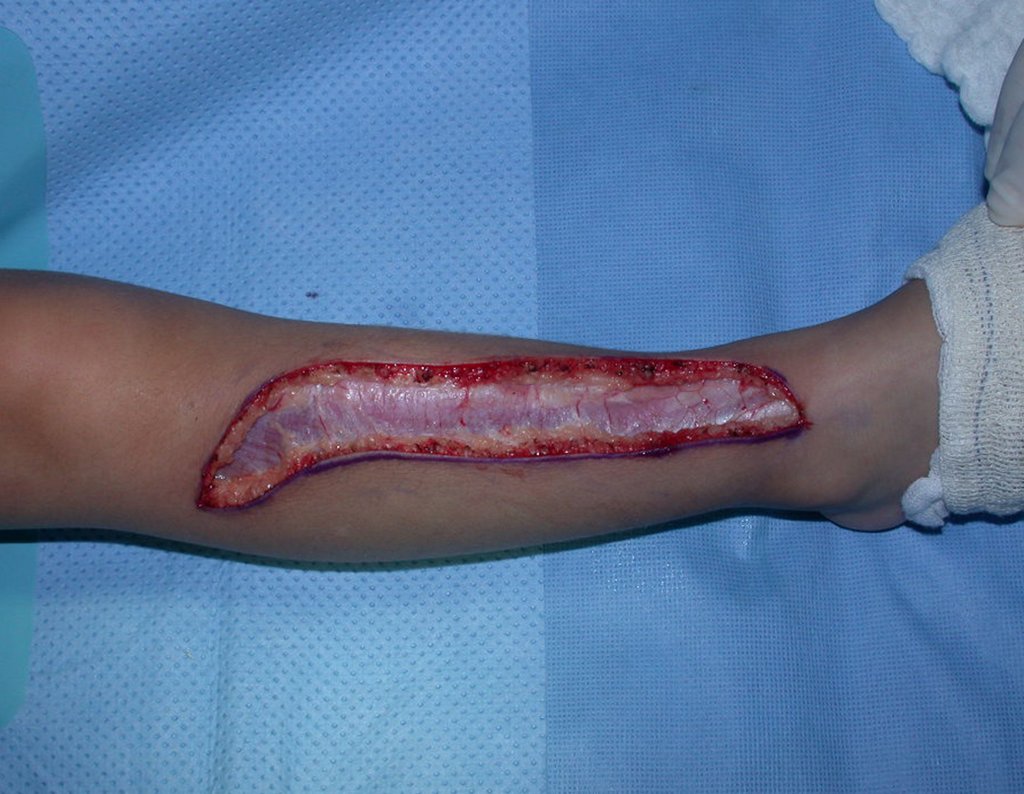
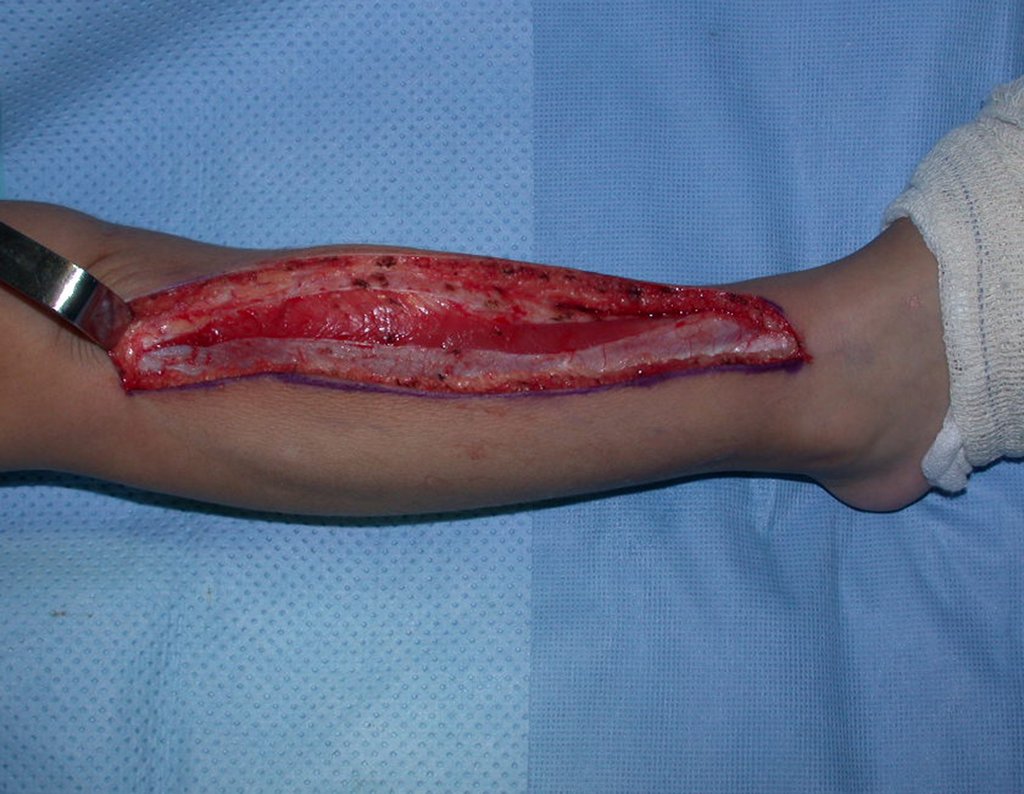
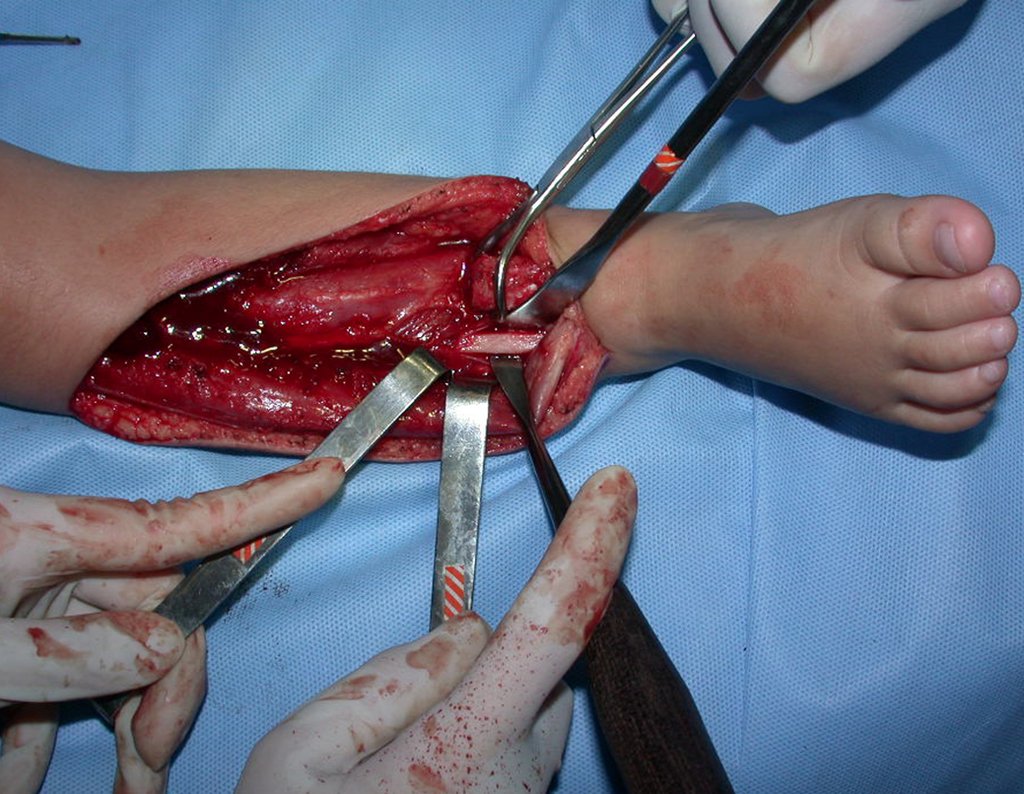
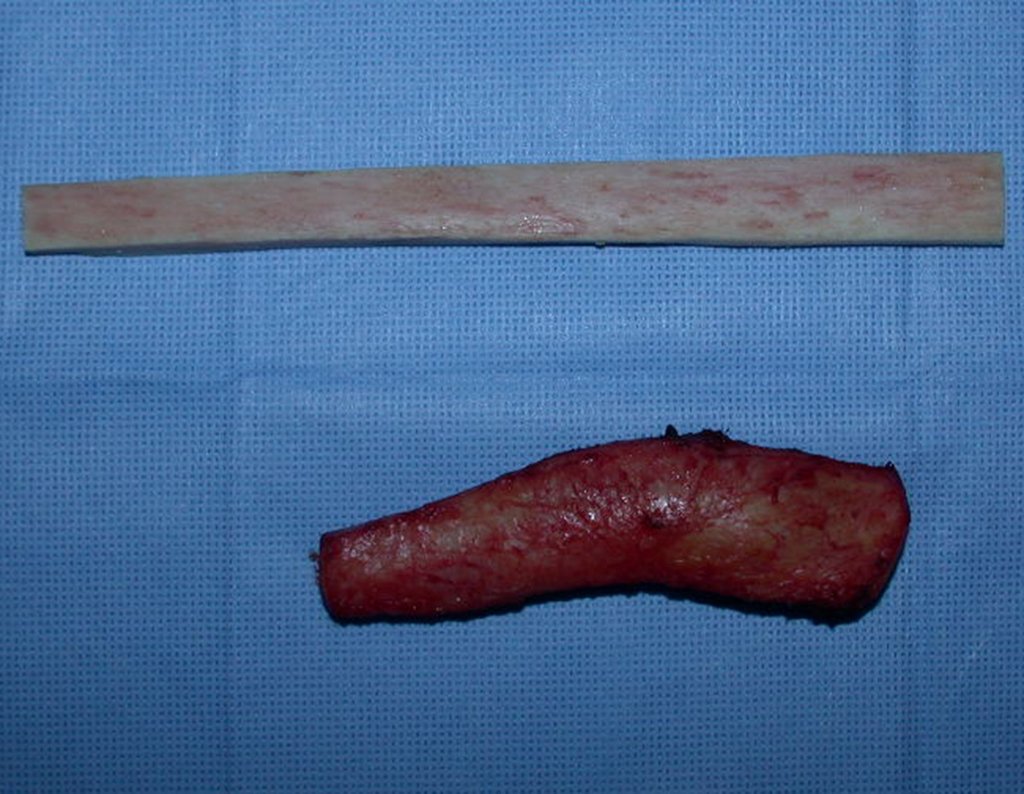
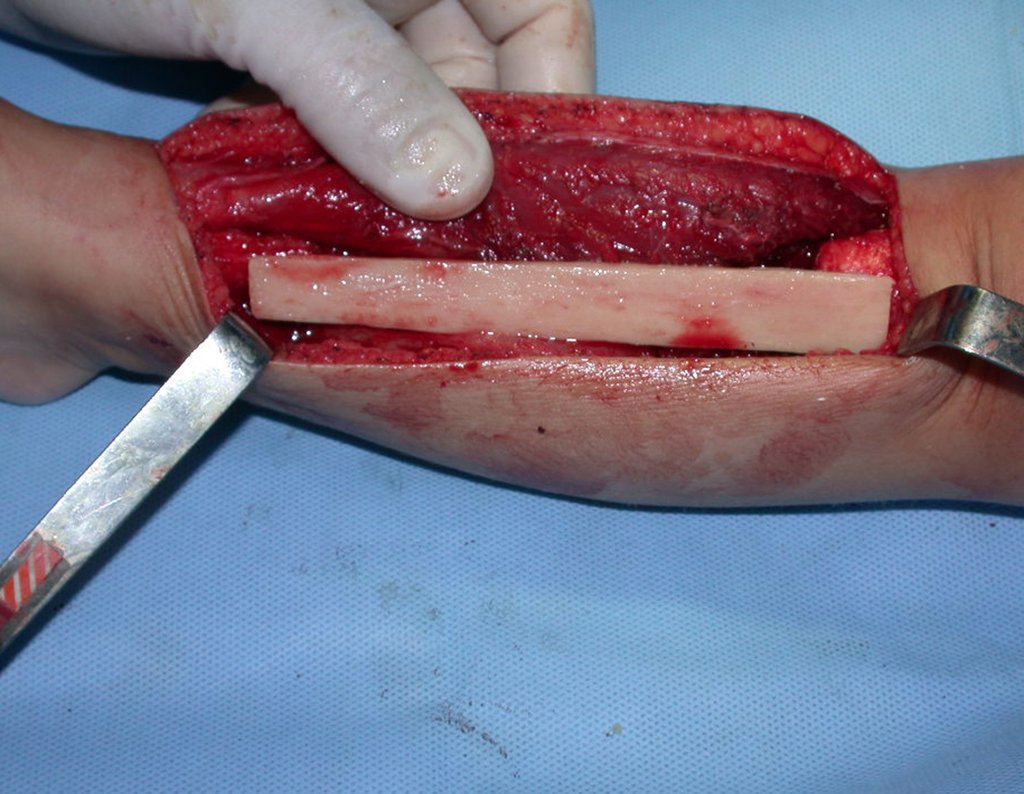
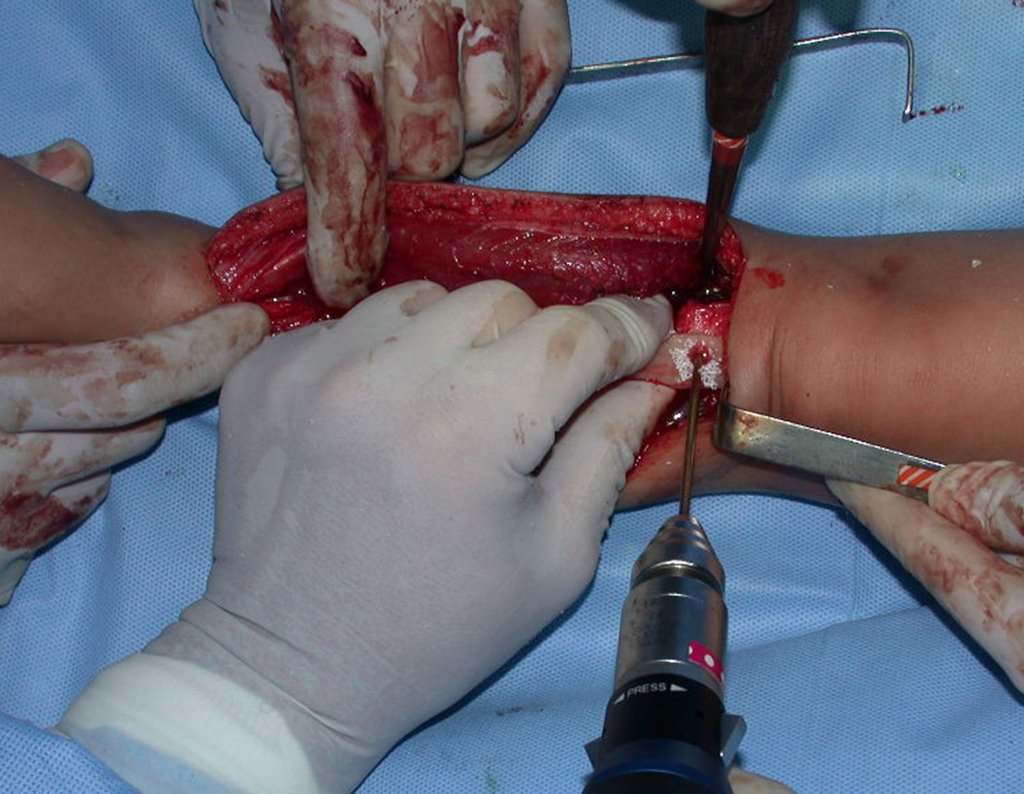
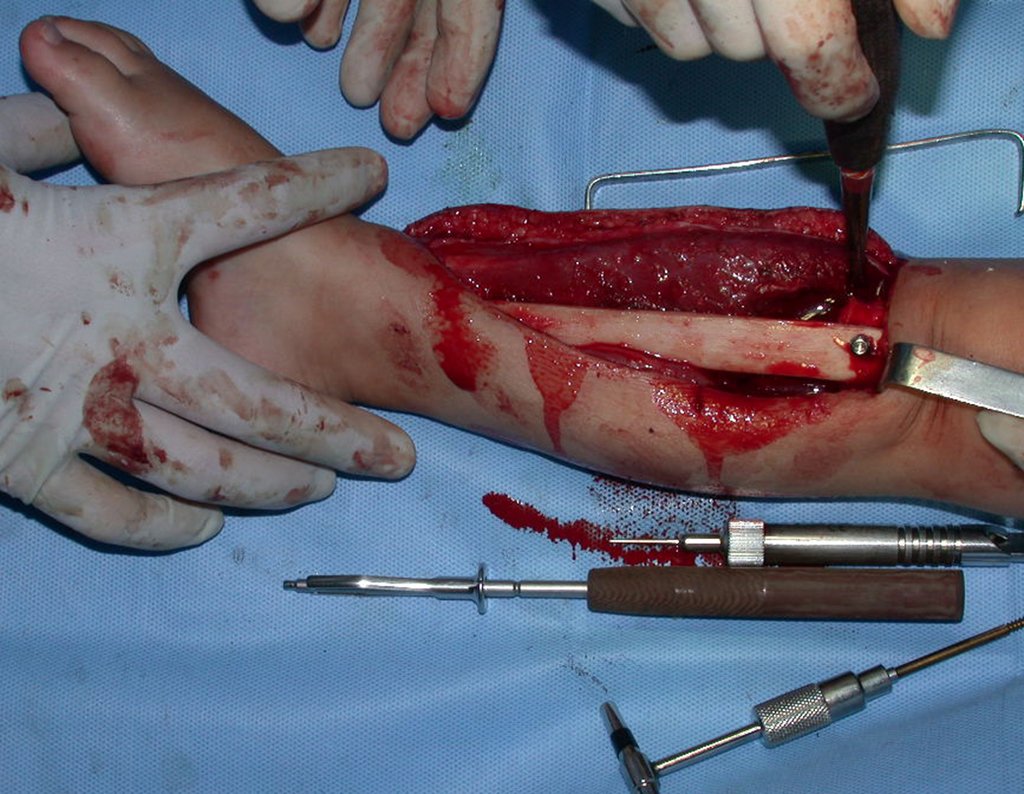
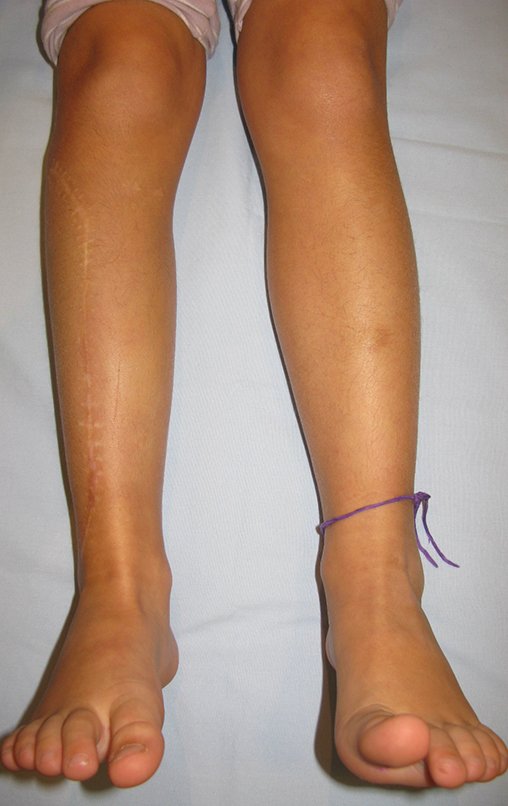
Algunos segmentos óseos como los extremos del peroné, clavícula, costilla, tercio distal del cúbito, radio proximal, etc. se pueden resecar, sin necesidad de reconstrucción.
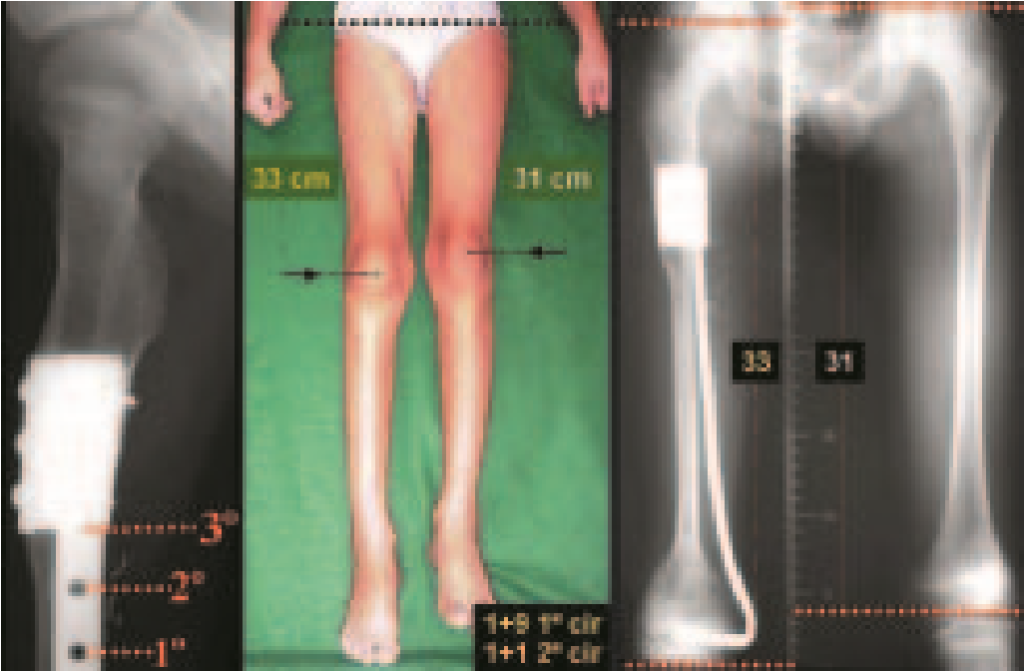
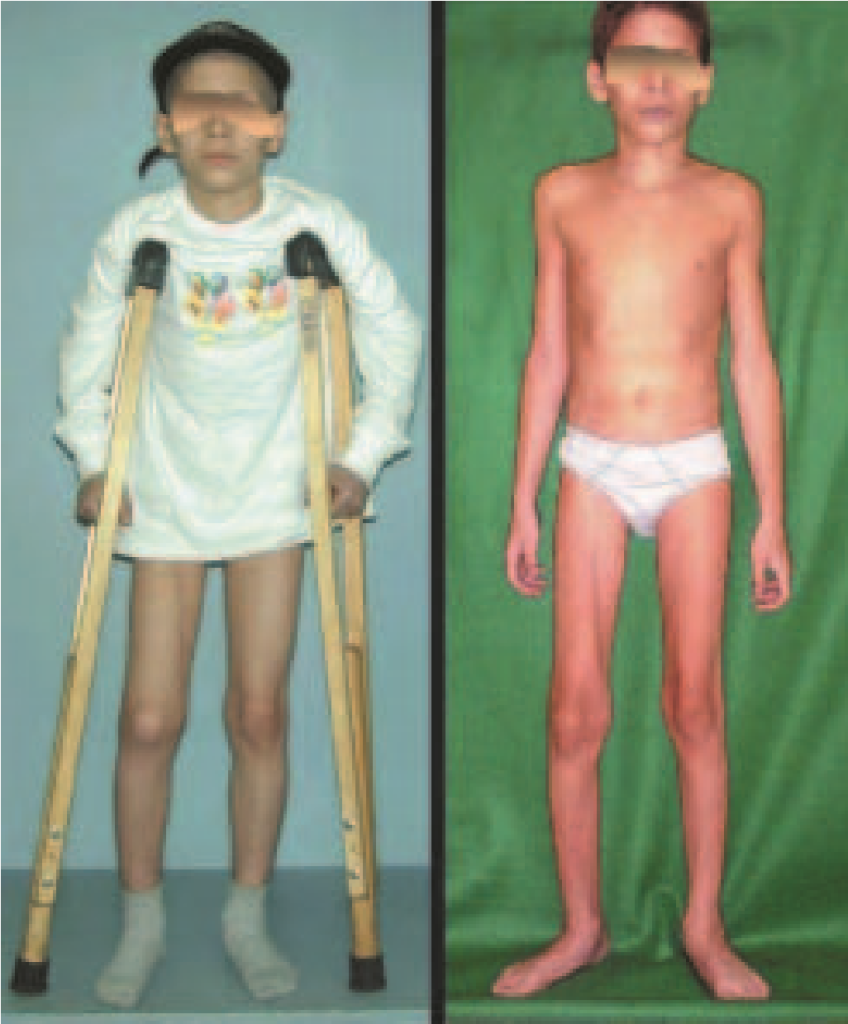
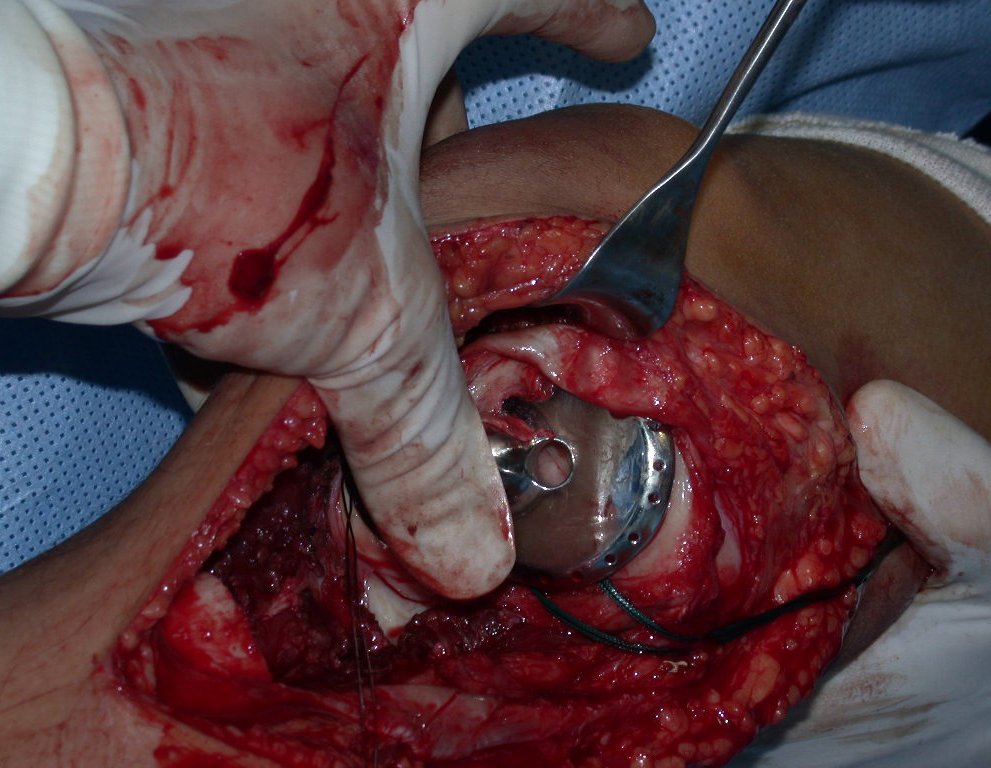
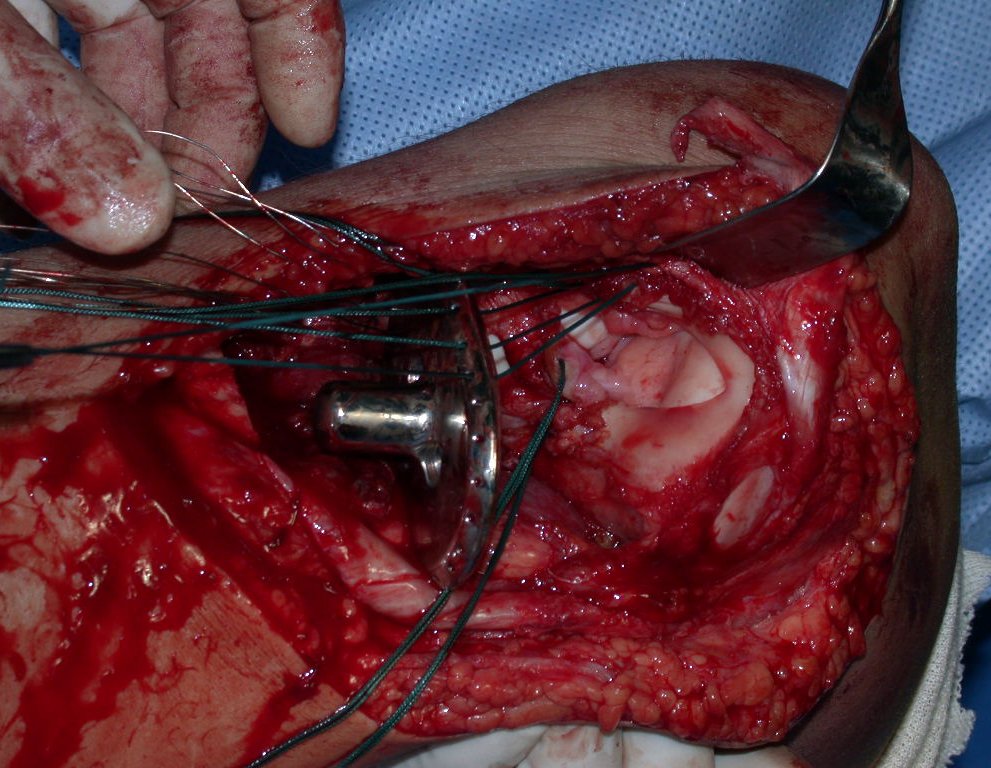
En otras situaciones podemos necesitar reconstrucciones segmentarias con injertos óseos libres o incluso vascularizados o reconstrucciones articulares con prótesis en casos avanzados con afectación articular importante. En la columna, tras la resección de la lesión, puede ser necesaria una artrodesis para evitar la inestabilidad.
La radioterapia debe evitarse por el riesgo de malignidad, sin embargo se reserva para el control evolutivo de lesiones de difícil acceso, como la columna cervical, por ejemplo, u otras situaciones en las que no se recomienda la reintervención quirúrgica.
La embolización como terapia aislada es controvertida. Sin embargo, se puede utilizar antes de la operación para minimizar el sangrado durante la cirugía. Esta práctica es más utilizada en casos de difícil acceso, aunque no siempre se consigue su eficacia. En casos aislados se ha descrito infiltración con calcitonina con resultados satisfactorios.
Puede ocurrir una recurrencia, ya que se desconoce el fenómeno que causó el quiste y no podemos garantizar que la cirugía lo haya reparado. La tasa de recurrencia puede alcanzar el treinta por ciento de los casos.
Preguntas:
1- El quiste óseo aneurismático:
a- es una lesión tumoral
b- es una lesión metastásica
c- ocurre solo o acompaña a otras lesiones óseas
d- es un pseudoaneurisma
2- El diagnóstico diferencial de COA incluye:
a- Condrosarcoma
b-TGC
c-sarcoma de Ewing
d- defecto fibroso cortical
3- Según la clasificación de Enneking, el COA es:
a- lesión benigna activa
b- lesión benigna latente
c- lesión maligna de bajo grado
d-lesión maligna de alto grado
4- En relación al COA, es correcto afirmar:
a- ocurre con mayor frecuencia en pacientes de edad avanzada
b- presenta células gigantes tipo osteoclastos
c- debe tratarse preferentemente con resección amplia
d- presenta focos de calcificación
5- El aspecto radiológico del COA es:
a- lesión ósea por condensación
b- lesión ósea heterogénea
c- lesión de rarefacción ósea homogénea
d- lesión ósea sin límites precisos.
6- El trato preferencial del COA es:
a- legrado intralesional
b- resección segmentaria
c- resección segmentaria + endoprótesis
d- Artrodesis
7- Las lesiones tumorales que con mayor frecuencia presentan áreas de quiste óseo aneurismático son:
a-tgc; condrosarcoma; osteosarcoma y sarcoma de Ewing
b- defecto fibroso; tgc; adamantinoma y cordoma
c-osteoblastoma; condroblastoma; fibroma condromixoide y tgc;
d-osteosarcoma; condroblastoma; Granuloma y lipoma eosinofílico.
Bibliografía
- ALEOTTI, A.; CERVELLATTI, AA;BOVOLENTA, SR;ZAGOS,S. Et al Gránulos de Birbeck: contribución a la comprensión de la evolución intracitoplasmática. L.Submicrosc. Citol. Pathol., 30(2):295, 1998.
- AVANZI, O.; JOILDA. FG;SALOMÃO, JC;PROSPERO, JD Quiste óseo aneurismático en la columna. Rev. Brás. Ortop., 31:103,1996
- AVANZI, O.; JOILDA. FG;PROSPERO, JD;CARVALHO PIN TO, W. Tumores benignos y lesiones pseudotumorales en el cerro vertebral. Rev. Brás. Ortop., 31:131,1996.
- BIESECKER, JL;HUVOS,AG.;MIKÉ. V. Quistes de la tapa del aneurisma. Un estudio clínico-patológico de 66 casos, Cancer, 26:615,1970.
- BURACZEWSKI, J.;M Patogénesis del quiste de la cápsula aneurismática. Relación entre el quiste del casquete aneurismático y la displasia fibrosa del casquete. Cáncer, 28:116,1971.
- MDL Fletcher…[et al] . Clasificación del tumor. Patología y genética de tumores de tejido solar y óseo. Organización Mundial de la Salud
- DABSKA, M,;BURACZEWSKI, J.- Quiste del casquete aneurismático. Patología, evolución clínica y aspecto radiológico. Cáncer . 23:371,1969.
- DAHLIN, DC,;IVINS, JC- Condroblastoma benigno de cap. Un estudio de clínicopatología y microscopía electrónica. Cáncer .29:760,1972.
- DAILY, R.; GILLILAUD, C.;McCOY, GB Quiste de la cápsula aneurismática orbitaria en un paciente con carcinoma renal. Am.J. Oftalm., 117:643, 1944.
- DORFMAN ,HD;CZERBIAK,B.Tumores óseos. San Luis, CVMosby Co., 1997. P855.
- DORFMAN ,HD; STEINER, GC; JAFFE, HL Tumores vasculares de la tapa. Hum. Pathol., 2:349, 1971.
- JAFFE, HL; LICHTENSTEIN, L. Quiste de la tapa aneurismática: observación de cincuenta casos. J.Bone Join Surg., 39 A: 873, 1957.
- JAFFE, HL; LICHTENSTEIN, L .Condroblastoma benigno de cap. Una reinterpretación del llamado tumor calcificante o condrón de células gigantes. Am J. ., 18:969, 1942.
- JAFFE, H. L. Quiste aneurismático. Tapa de toro. Hosp. J. Dis., 11:3, 1950.
- LICHTENSTEIN, L Quiste de la tapa aneurismática. Entidad patológica que comúnmente se confunde con un tumor de células gigantes y ocasionalmente con un sarcoma de hemangioma. Cáncer, 3:279,1954.
- MARTINEZ, V.;SISSONS.HA Quiste del casquete aneurismático. Revisión de 123 casos que incluyen lesiones primarias y secundarias a otras patologías del casquete. Cáncer, 61:2291, 1988.
- PROSPERO, JD;RIBEIRO BAPTISTA, PP;de Lima Jr., H. Enfermedades óseas con células gigantes multinucleadas. Diagnóstico diferencial. Rev. Brás. Ortop., 34:214,1999.
- RIUTTER,DJ,;VAN RUSSEL, THG;VANder VELDE, EA Quiste de la tapa aneuryamal. Estudio clínico-patológico de 105 casos. Cáncer. 39:2231,1977.
- SCHAJOWICZ, F. Tumores de células gigantes, quiste de la tapa aneurismática de la columna. J.Bone Joint Surg., 47B:699, 1965.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com