Tibialización del peroné distal con preservación de la placa epifisaria
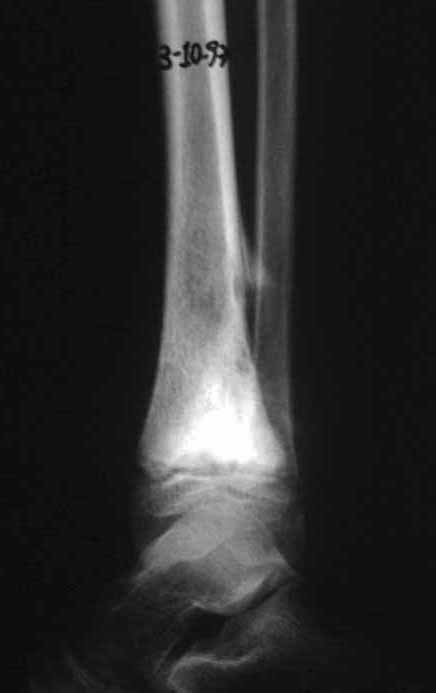
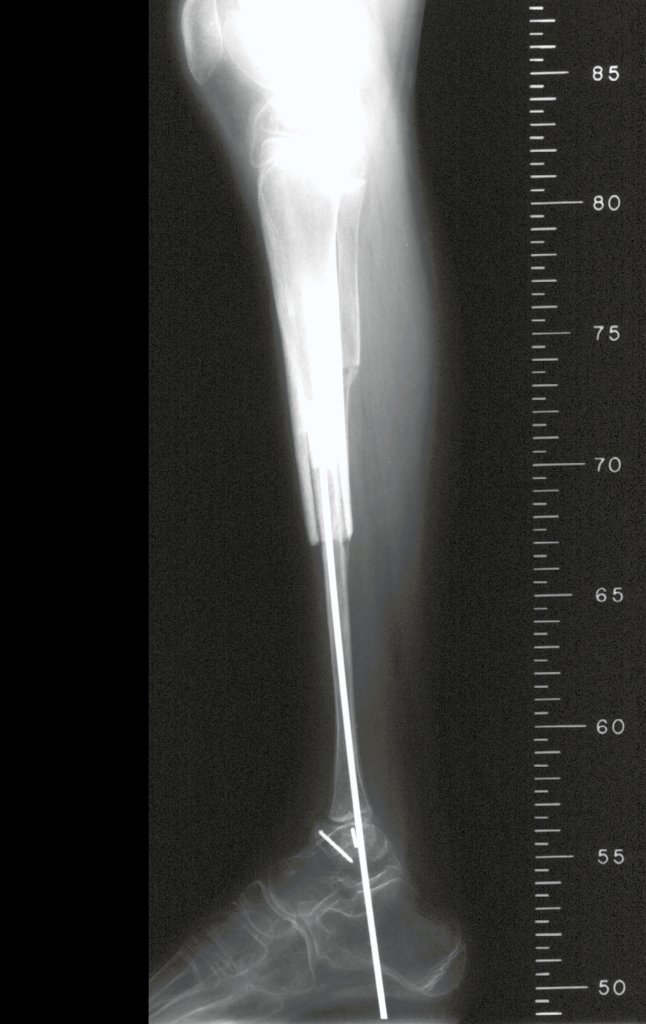
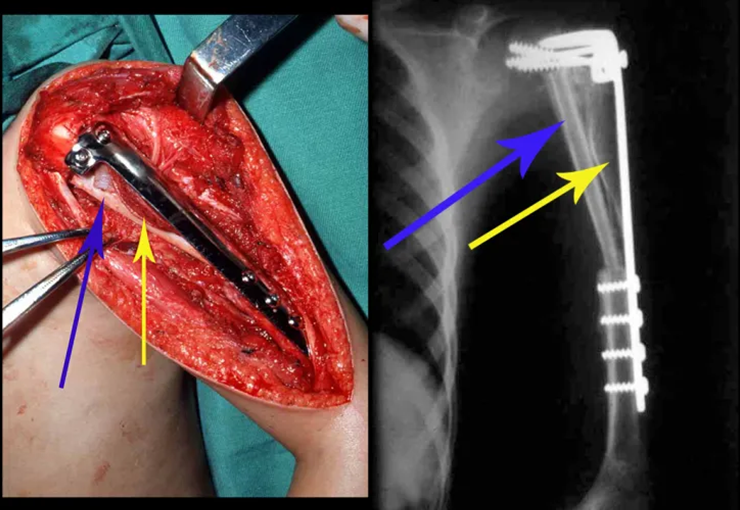
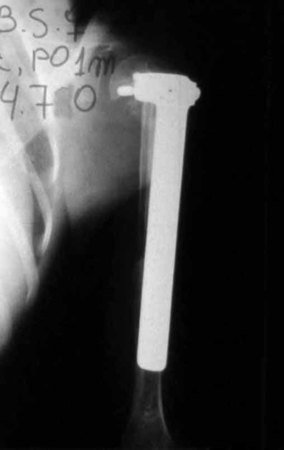
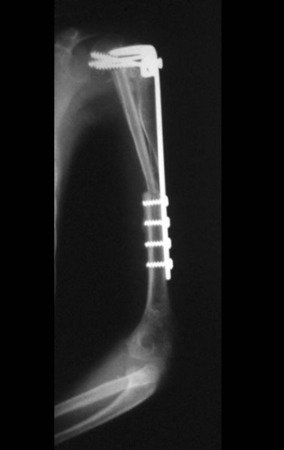
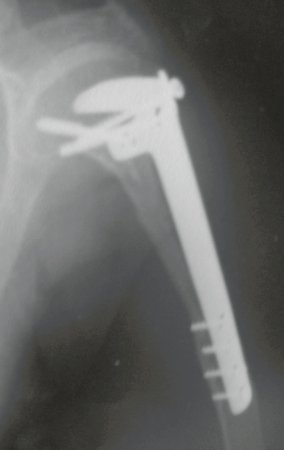
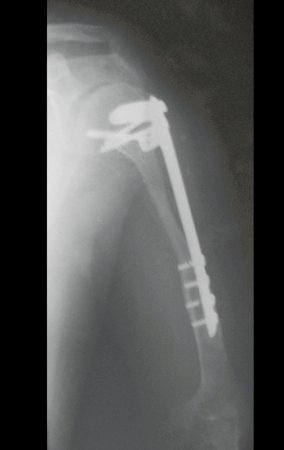
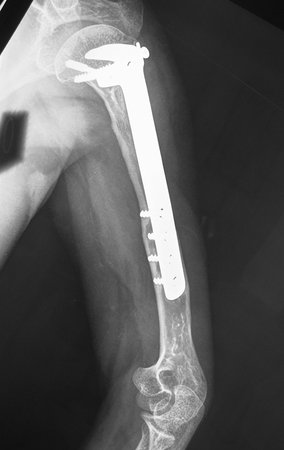
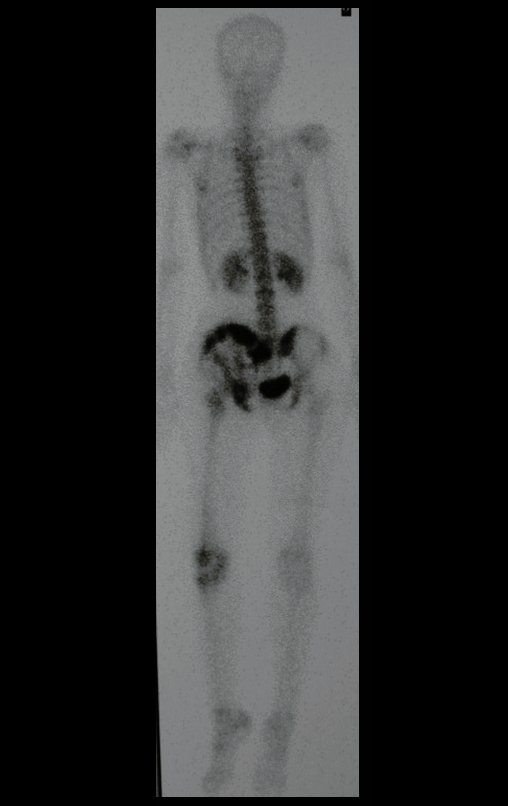
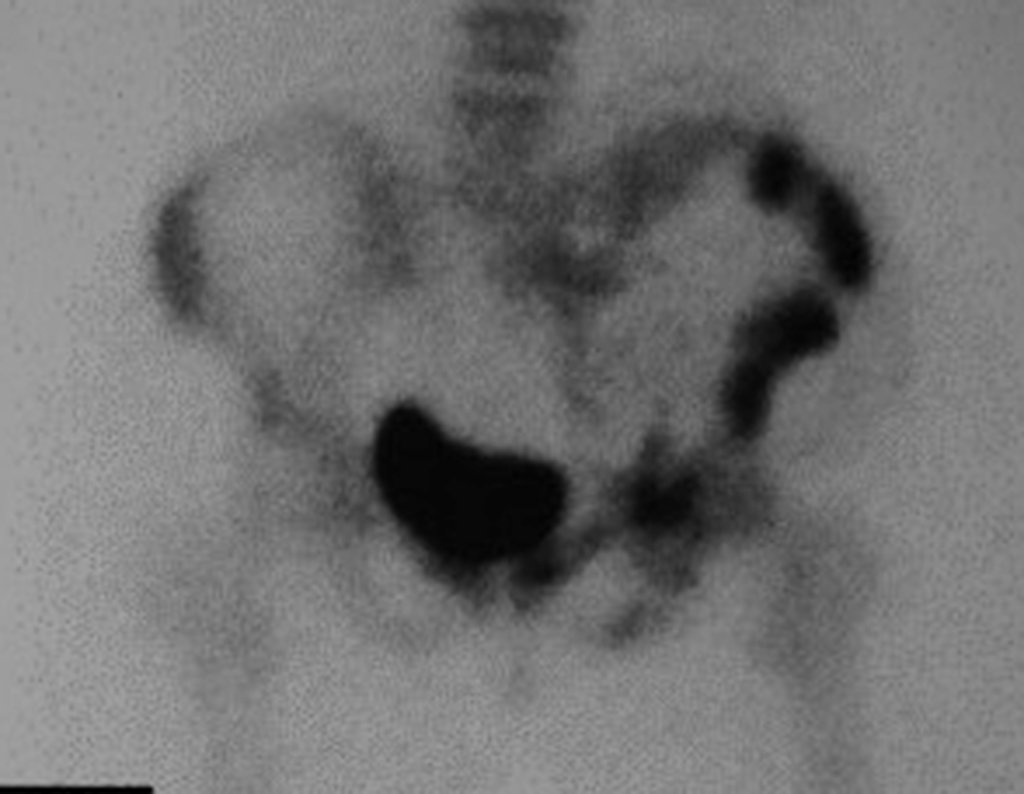
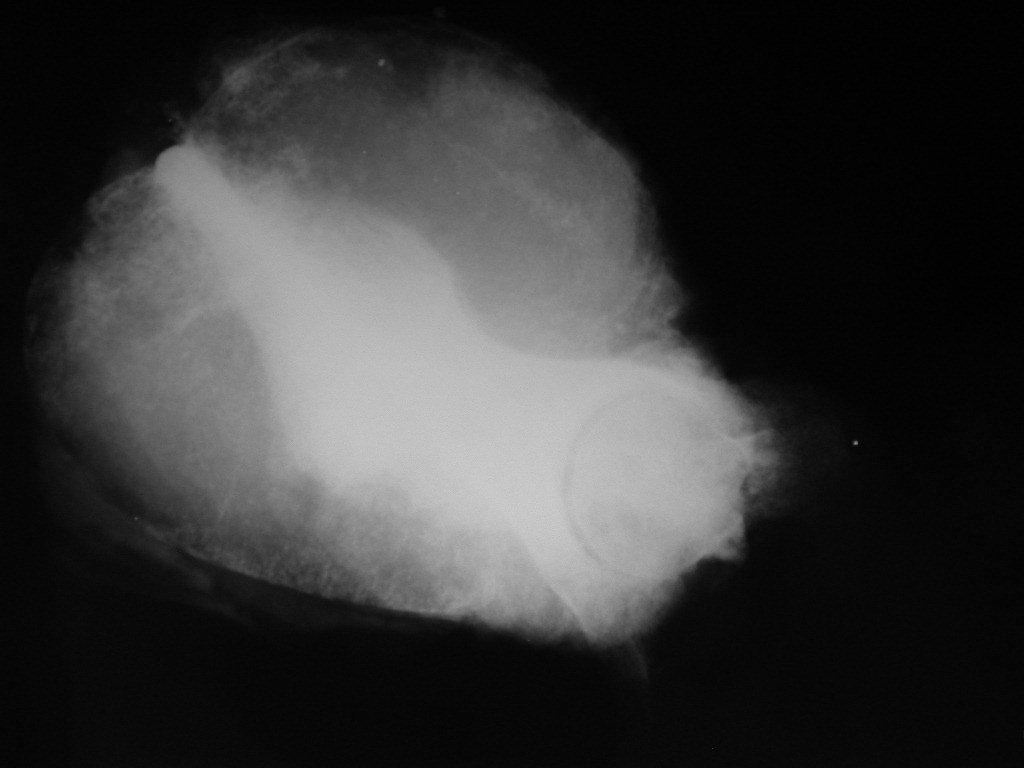
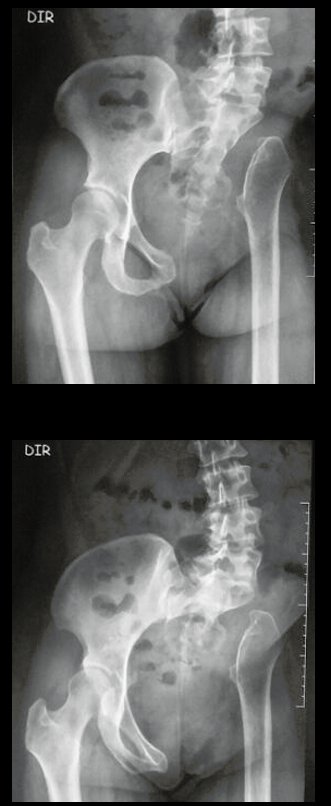
La reconstrucción se realizó artrodesando la epífisis distal del peroné ipsilateral con el astrágalo, preservando la placa epifisaria del peroné. La evaluación postoperatoria preliminar mediante gammagrafía de corte axial demostró signos de captura del peroné en toda la extensión transpuesta y al nivel de la proyección de la placa de crecimiento del peroné distal. Aún no es posible distinguir la hipercaptura de la placa fisaria del proceso reparador de artrodesis a nivel del astrágalo. Los controles radiológicos de septiembre/98, nueve meses después de la cirugía, muestran la integración completa del peroné transpuesto, tanto proximal como distalmente. El engrosamiento del peroné ya es evidente y la placa de crecimiento del peroné se puede distinguir fácilmente.
INTRODUCCIÓN: Osteosarcoma de tibia en un niño
El osteosarcoma es el tumor óseo maligno primario más frecuente entre la primera y segunda década de la vida(21). Generalmente afecta a las metáfisis de los huesos largos, siendo las localizaciones más habituales el tercio distal del fémur y el tercio proximal de la tibia. La localización en el tercio distal de la tibia representa aproximadamente el 3% de los casos.
Con la evolución del tratamiento de quimioterapia, hubo nuevos estímulos en el abordaje de esta condición, ya que proporcionó un aumento en la tasa promedio de supervivencia(2,7,19,21,22). Este hecho propició mayores mejoras en las técnicas quirúrgicas utilizadas hasta entonces. Las neoplasias malignas previamente tratadas con cirugía radical, actualmente, cuando responden favorablemente a la quimioterapia neoadyuvante, se abordan con el objetivo de preservar la extremidad involucrada, con o sin solución biológica(1,2,4,8,13,14, 22). Este concepto se ha ampliado, elevando las expectativas del cirujano que busca combinar la preservación del segmento corporal afectado con el mantenimiento de la máxima función(4,8,13).
REPORTE DE UN CASO
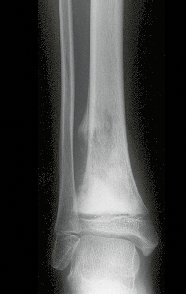
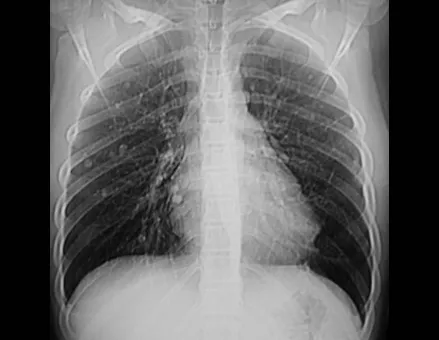
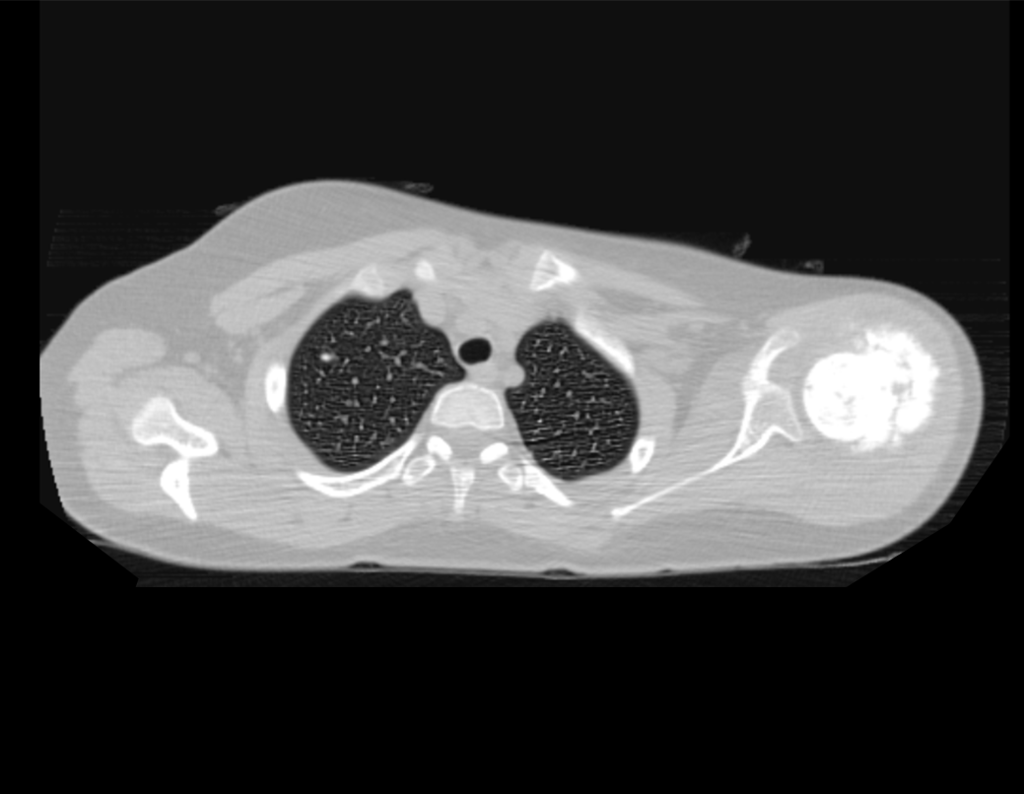
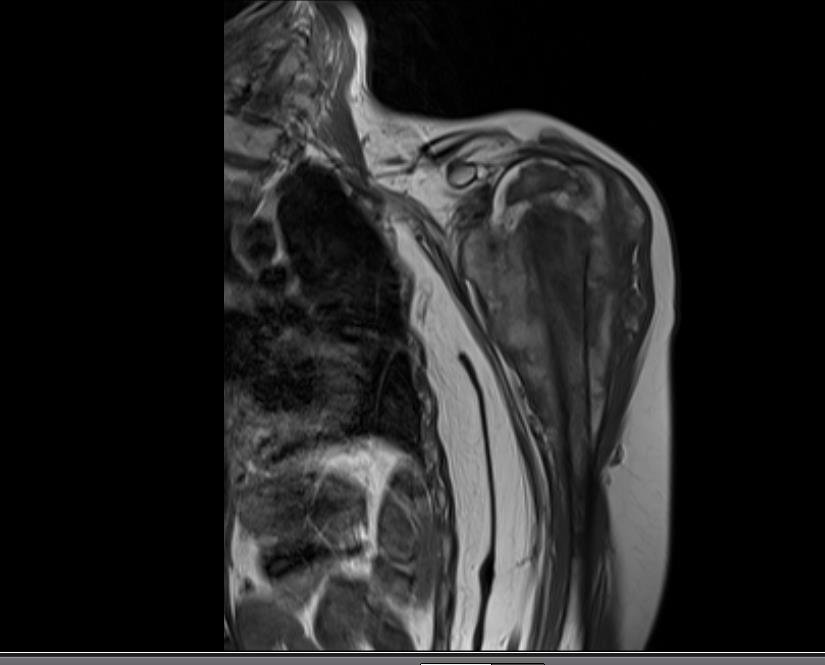
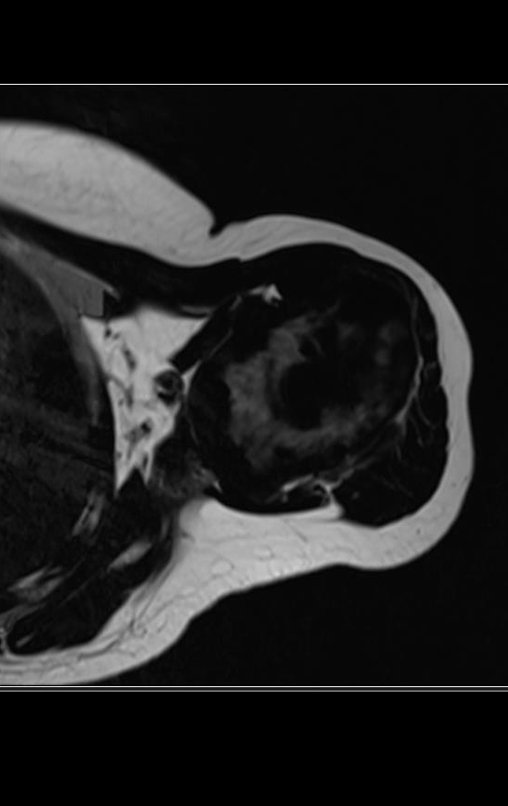
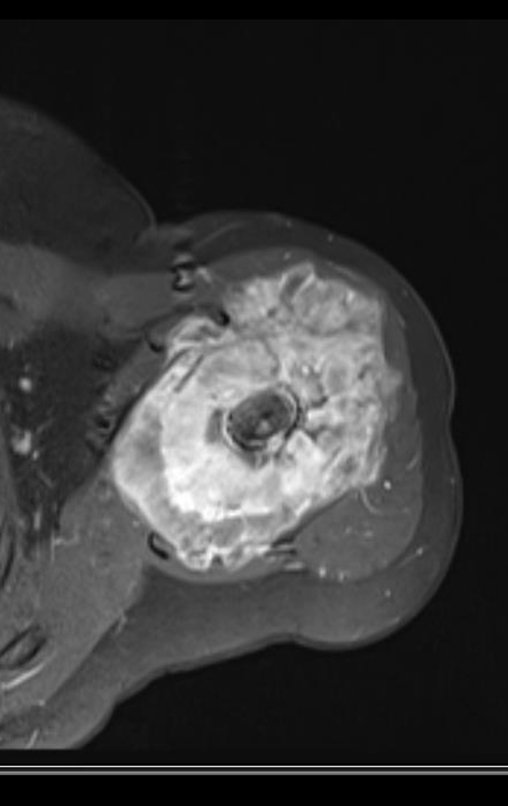
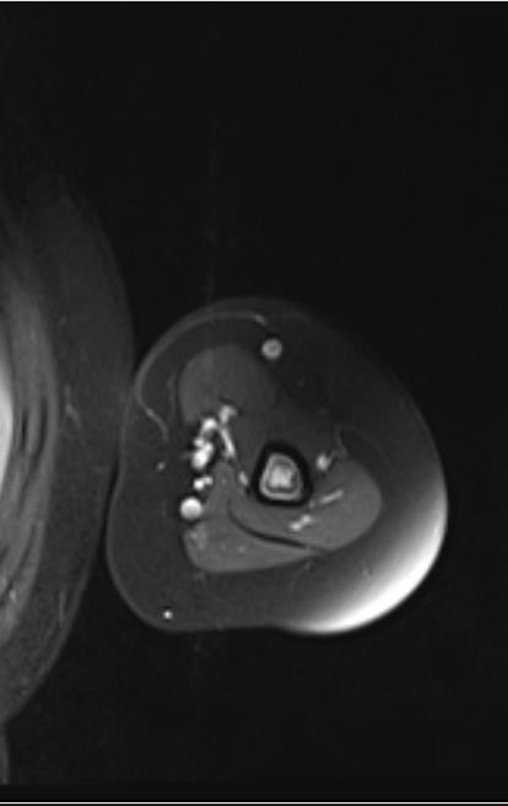
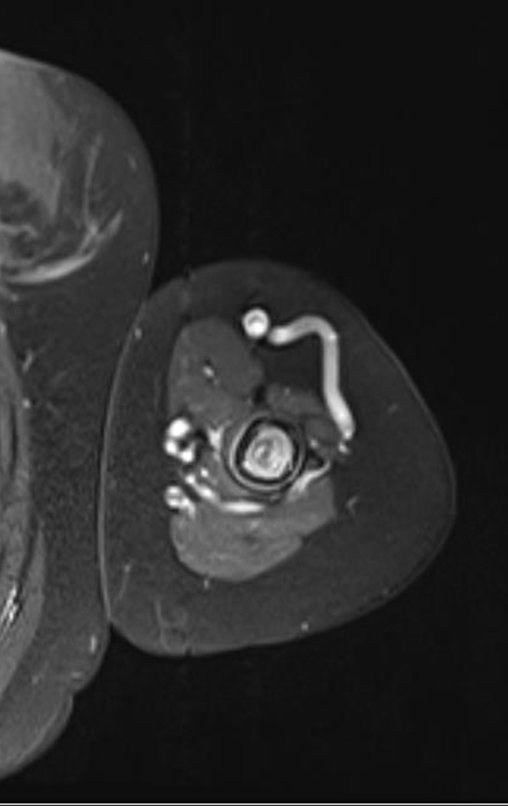
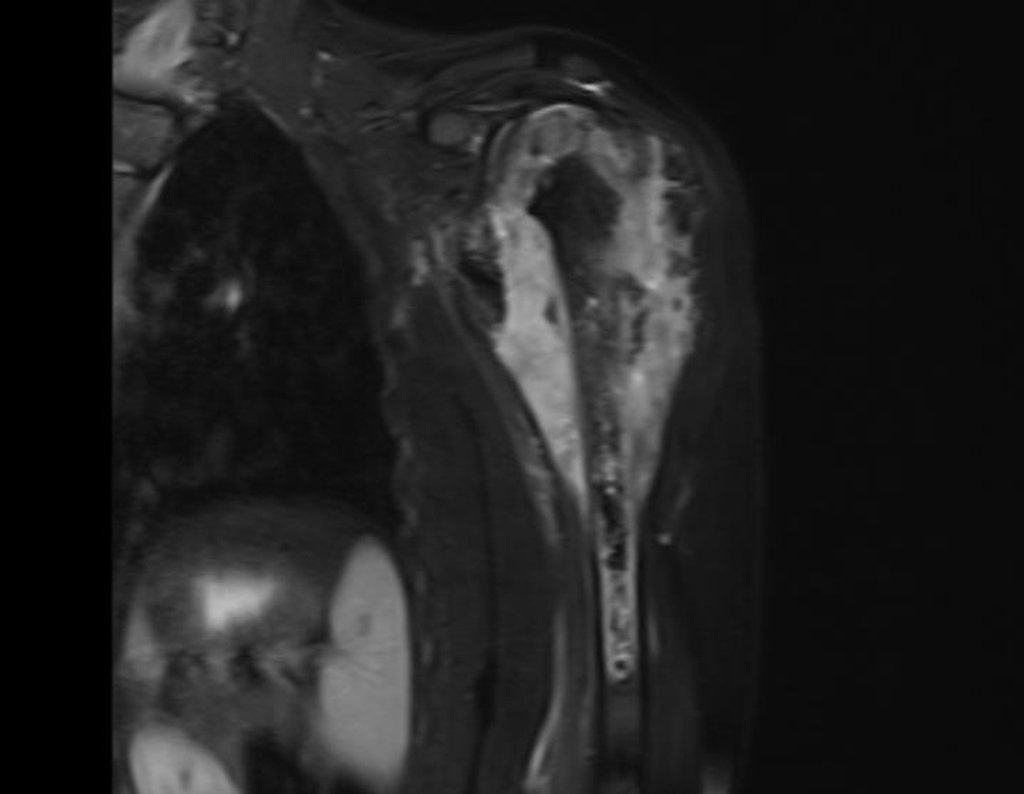
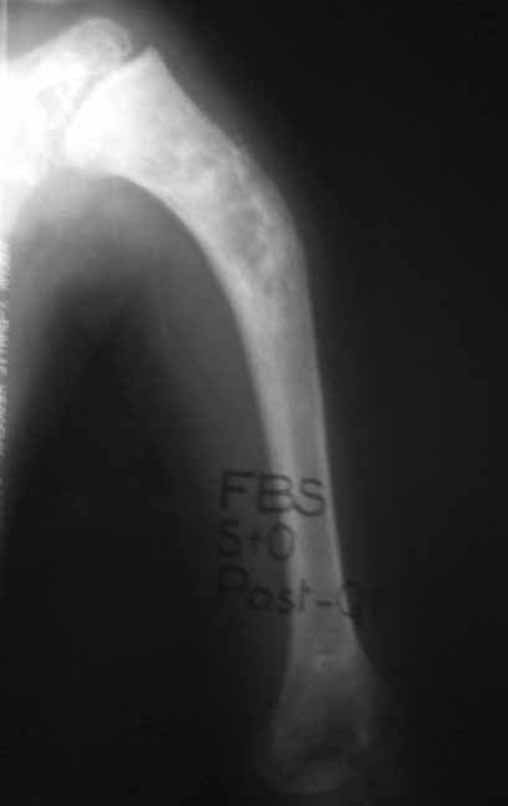
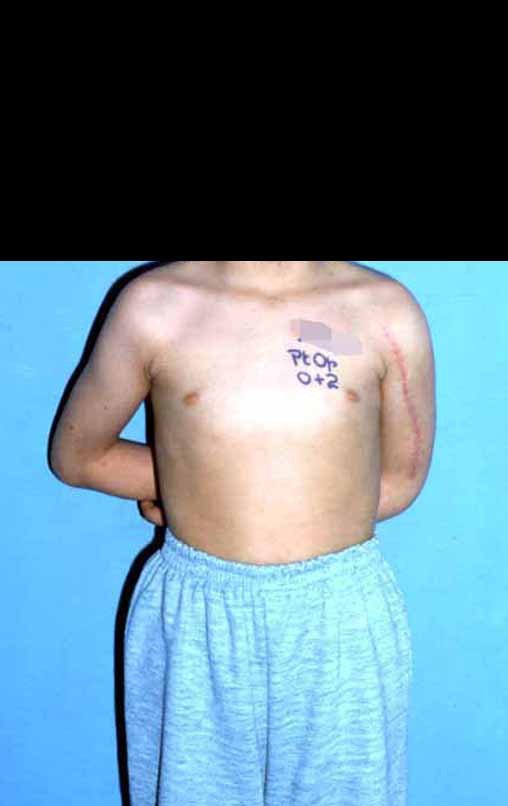
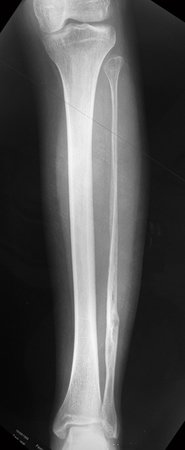
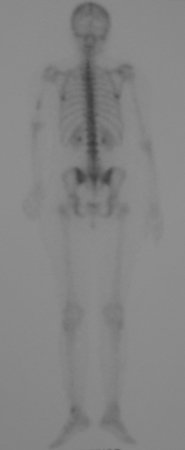
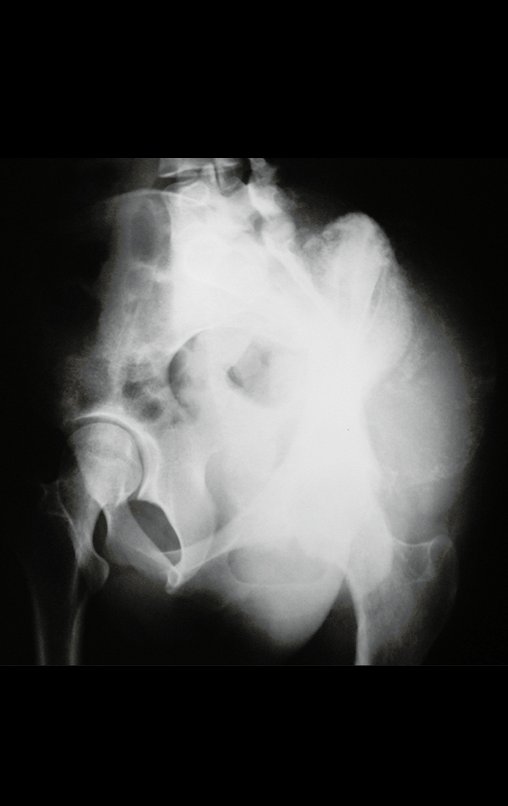
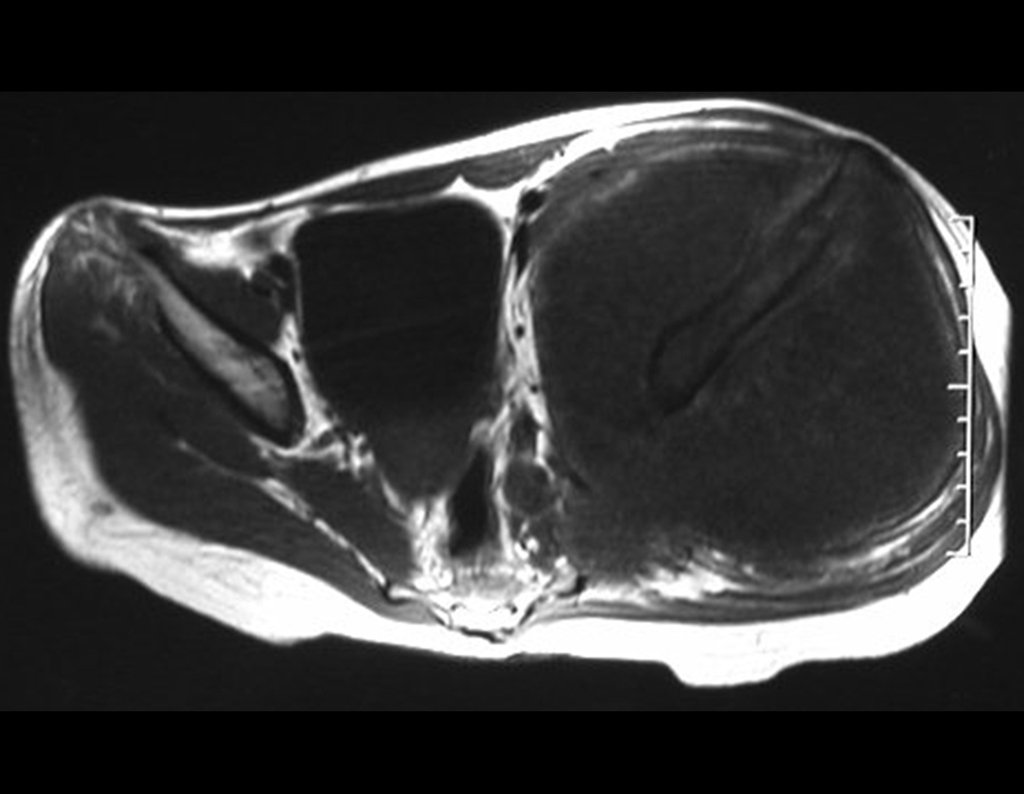
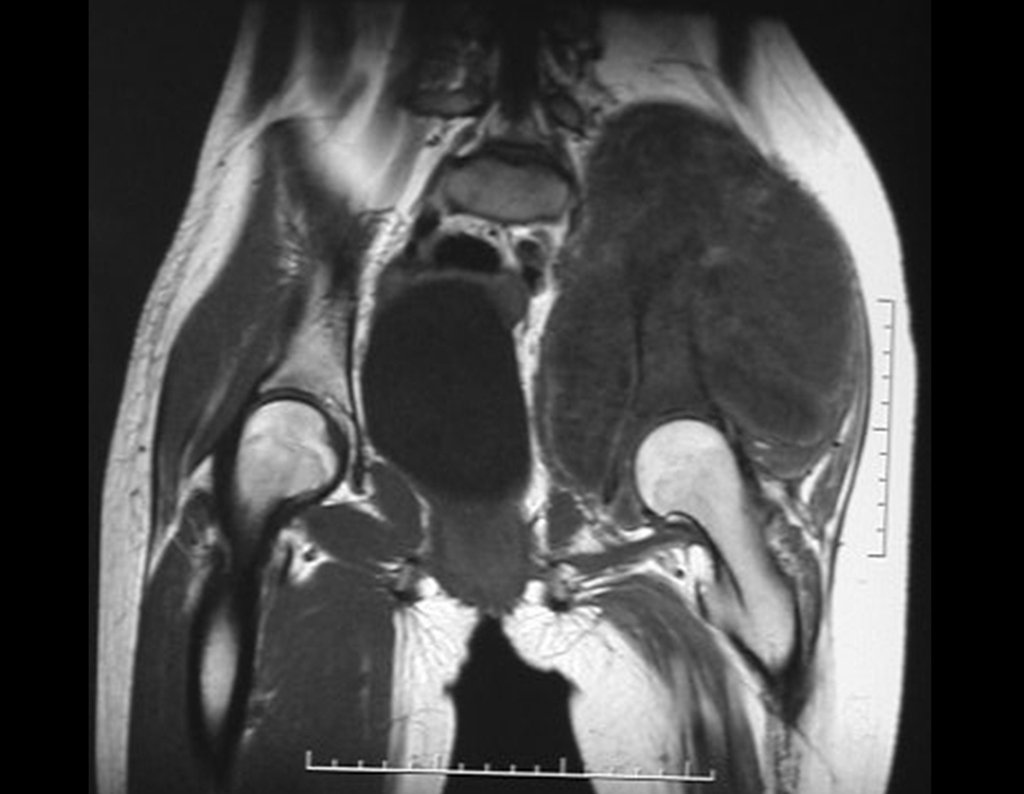
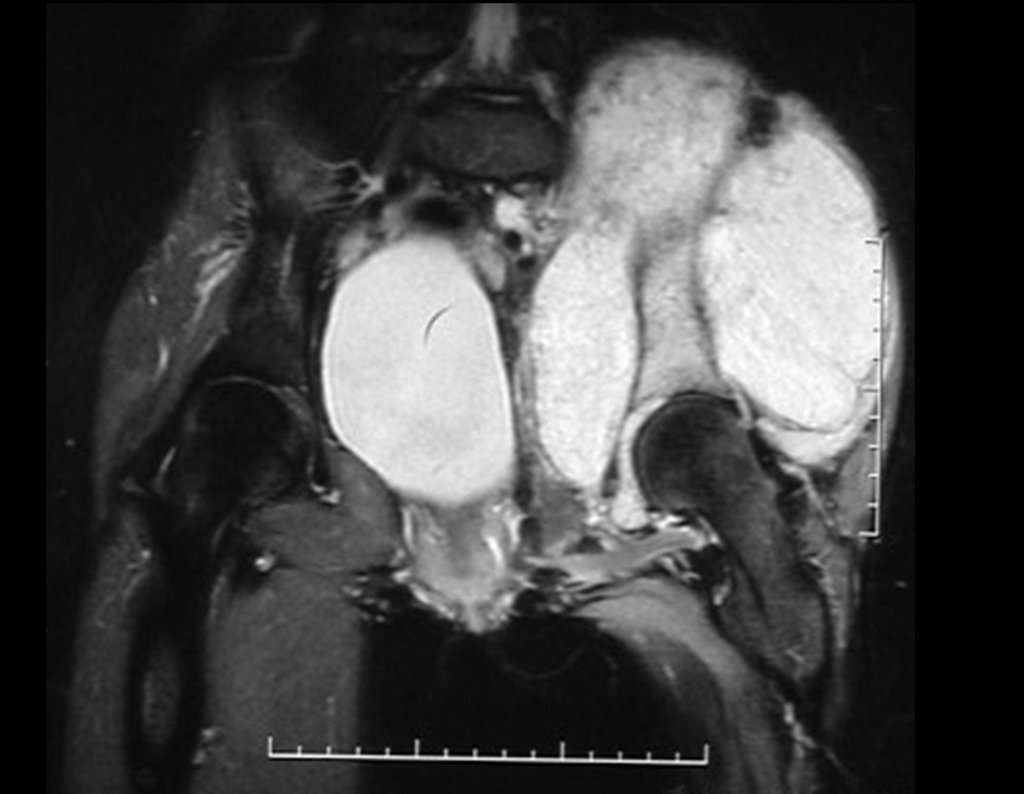
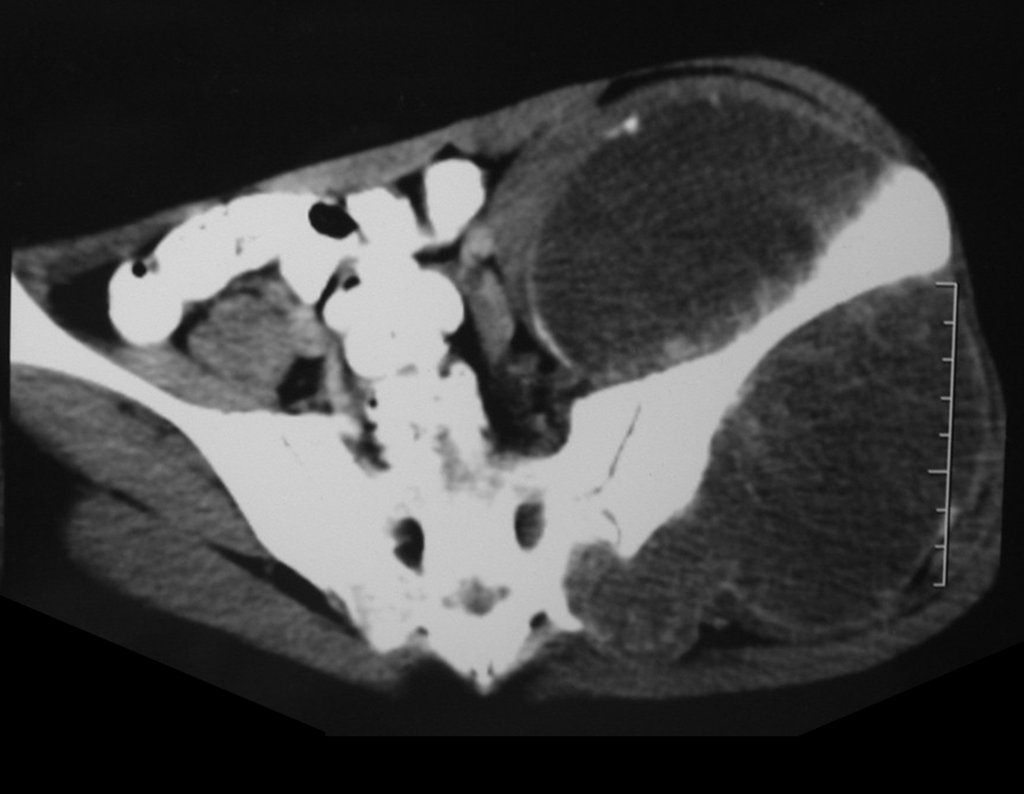
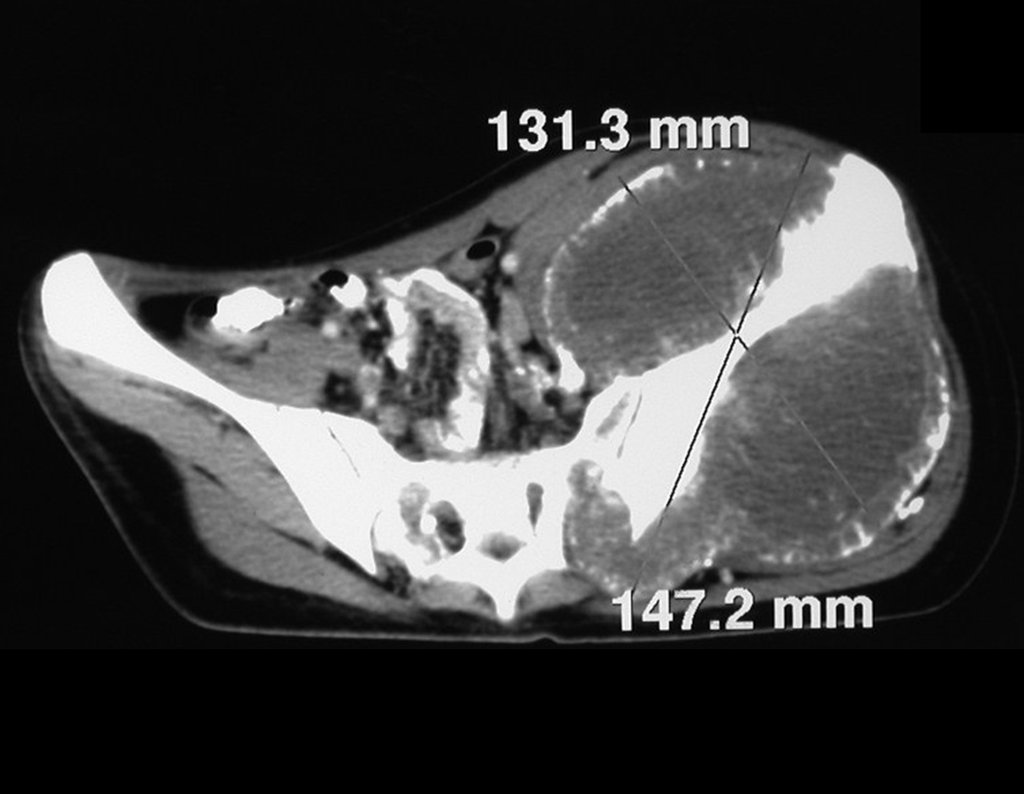
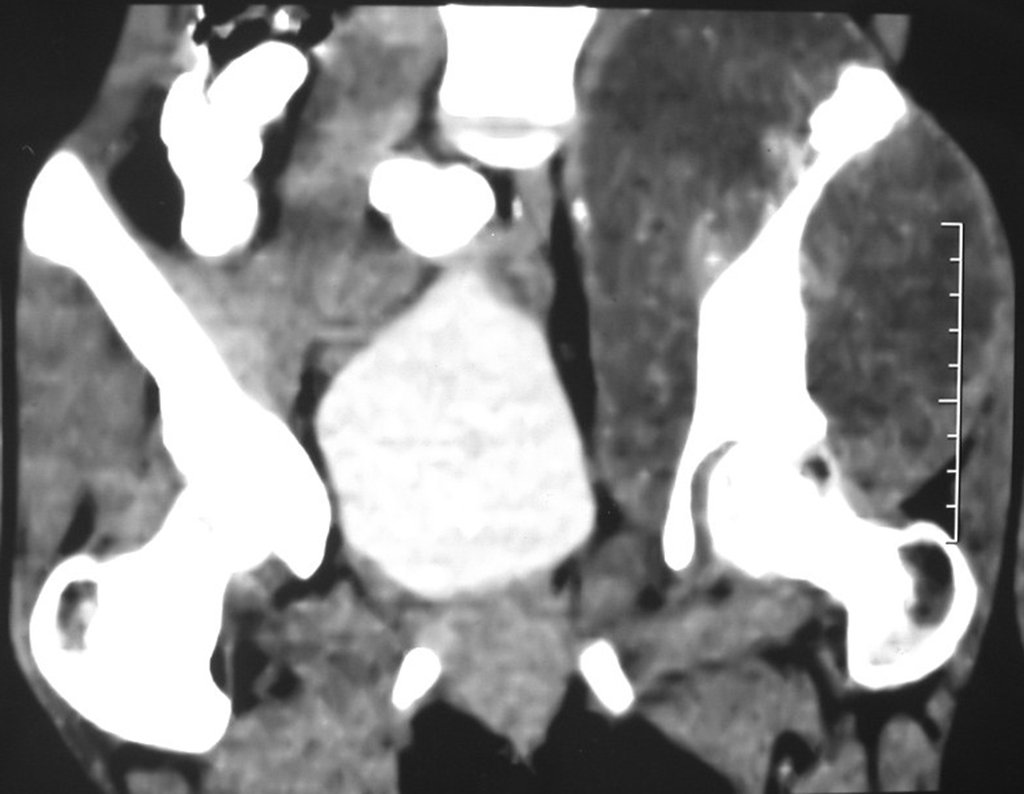
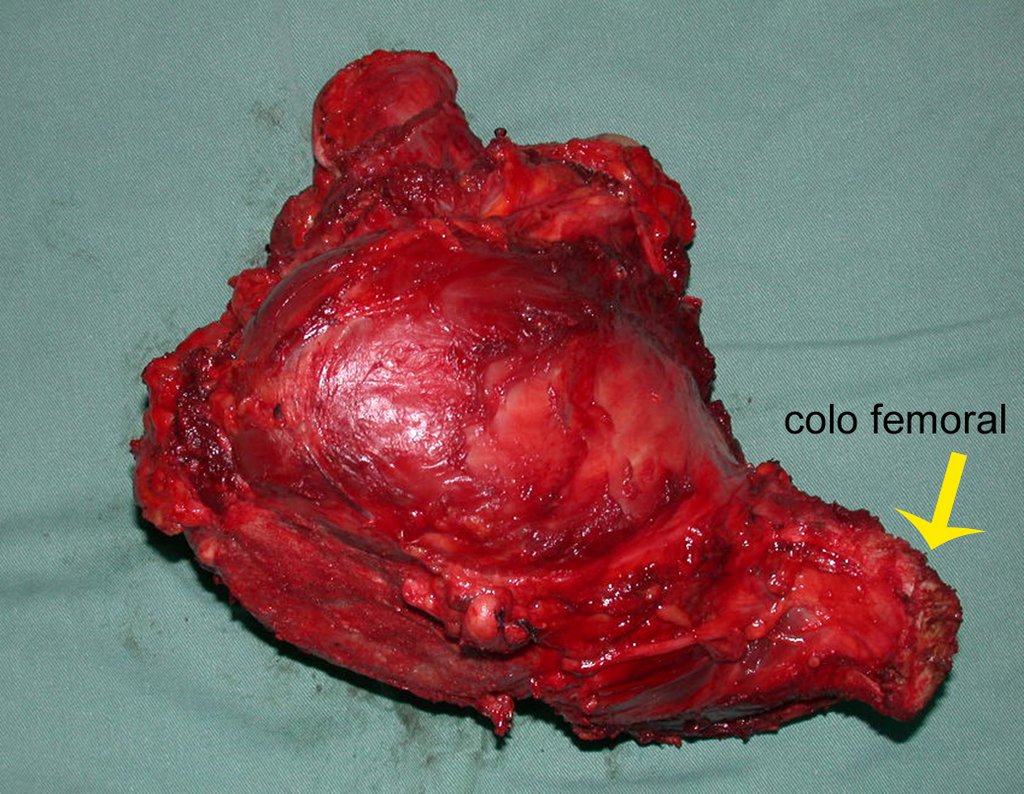
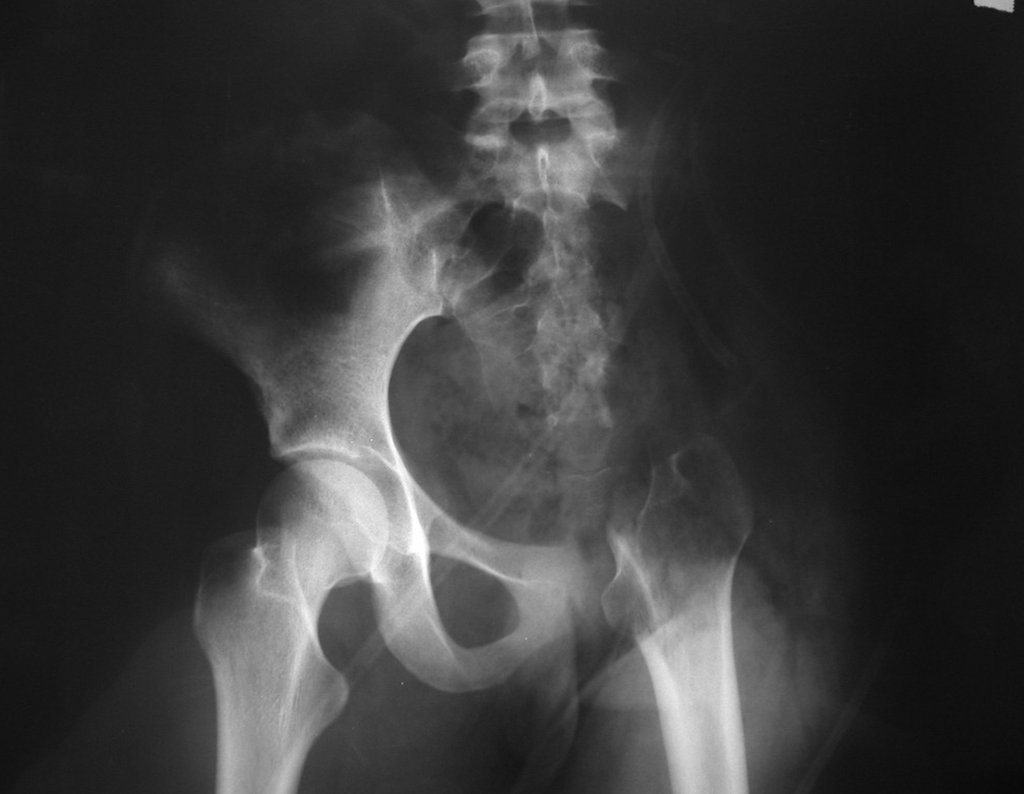
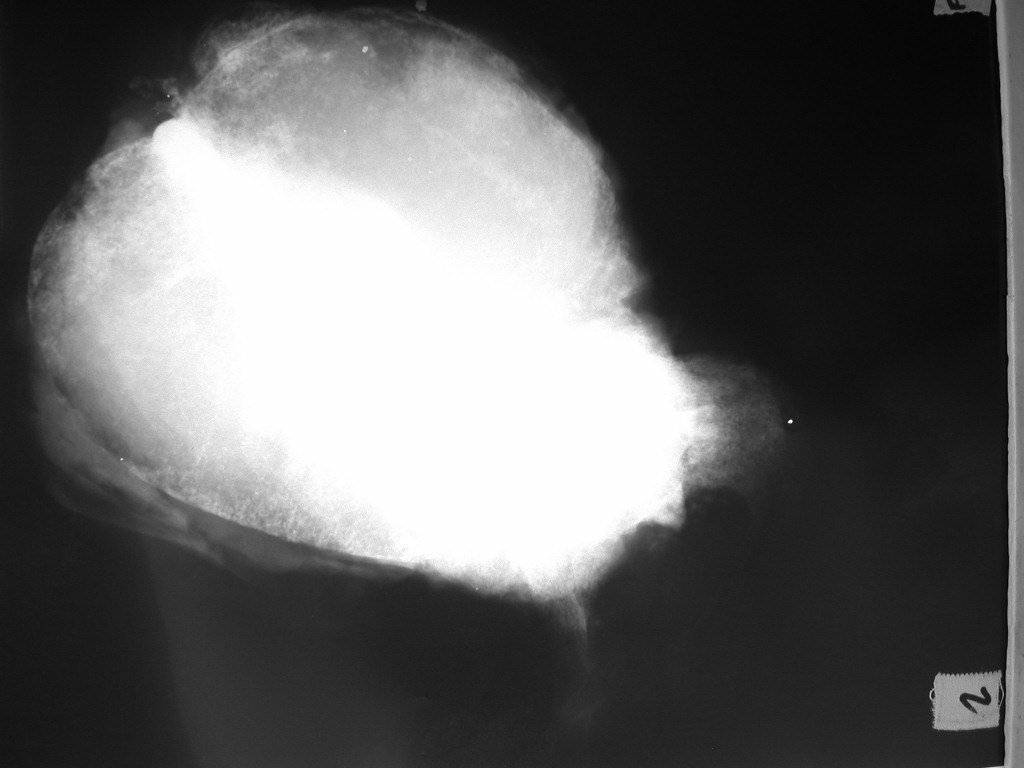
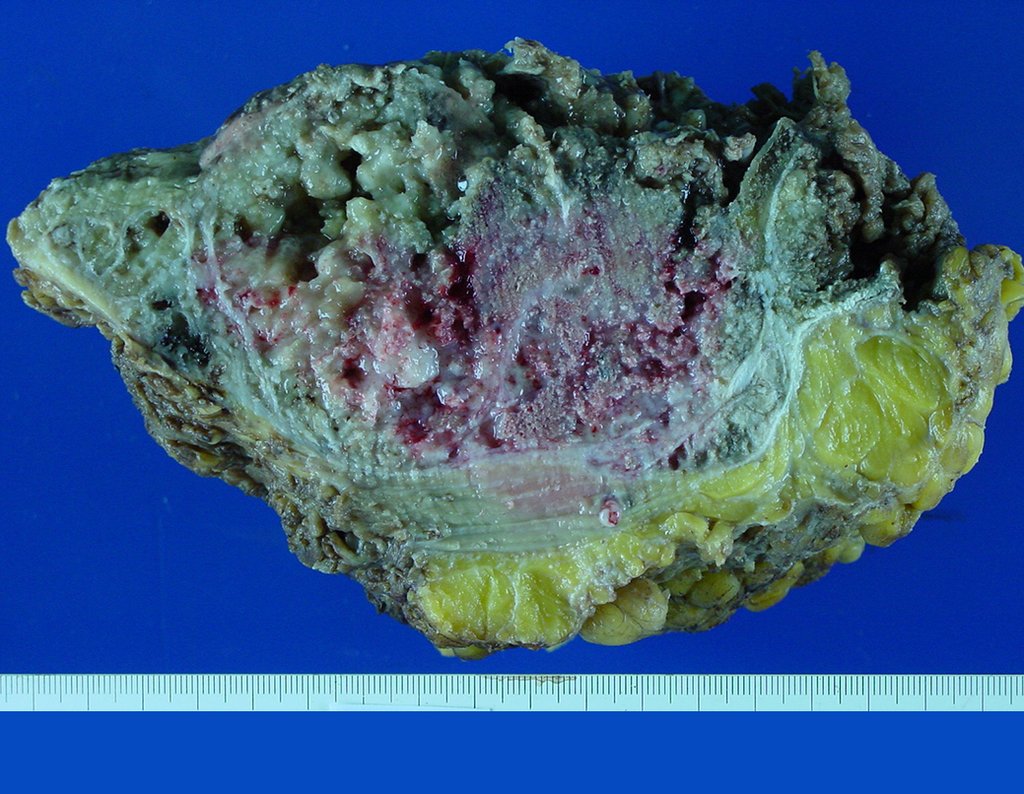
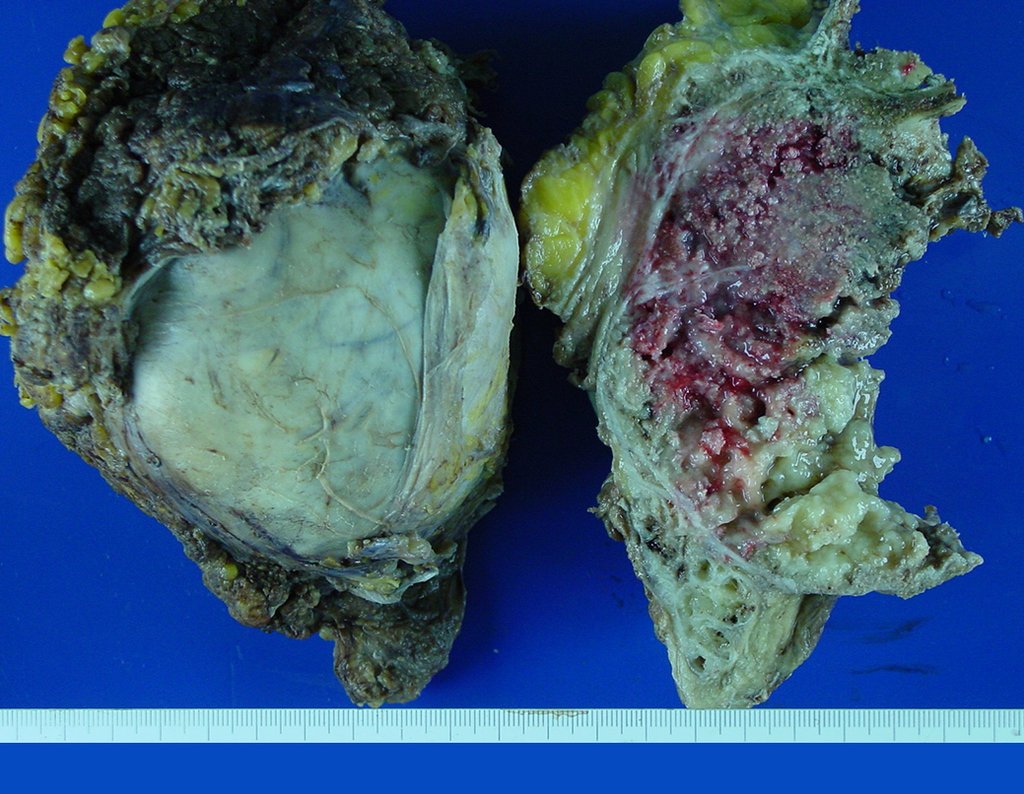
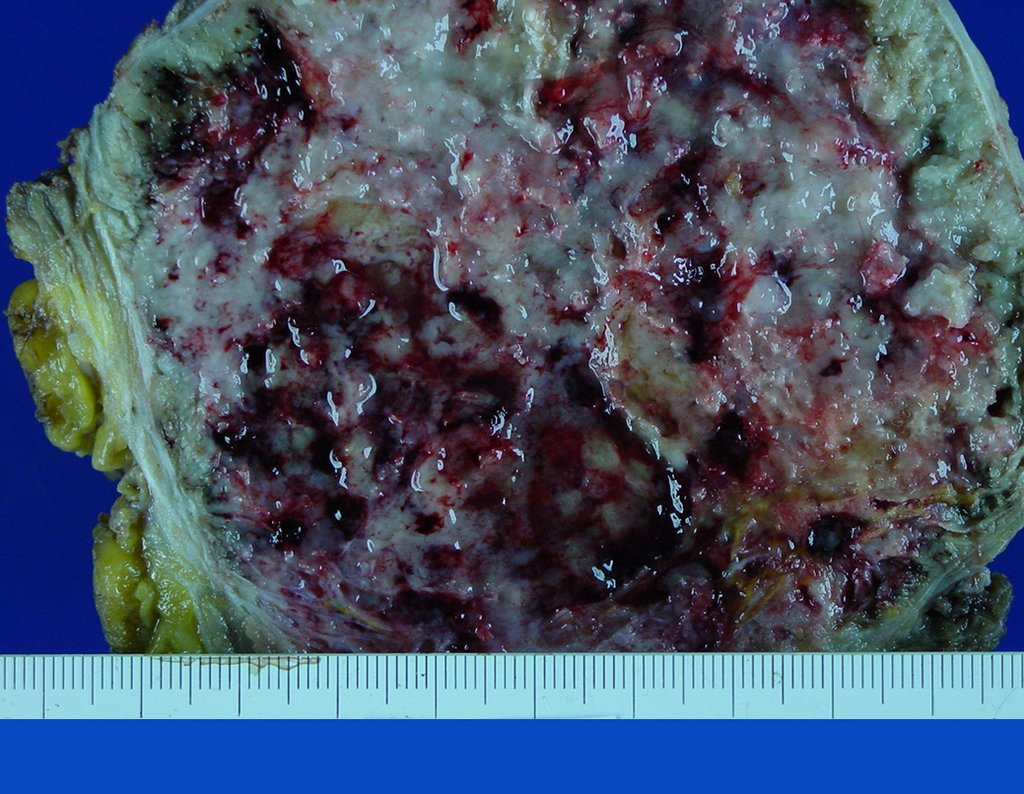
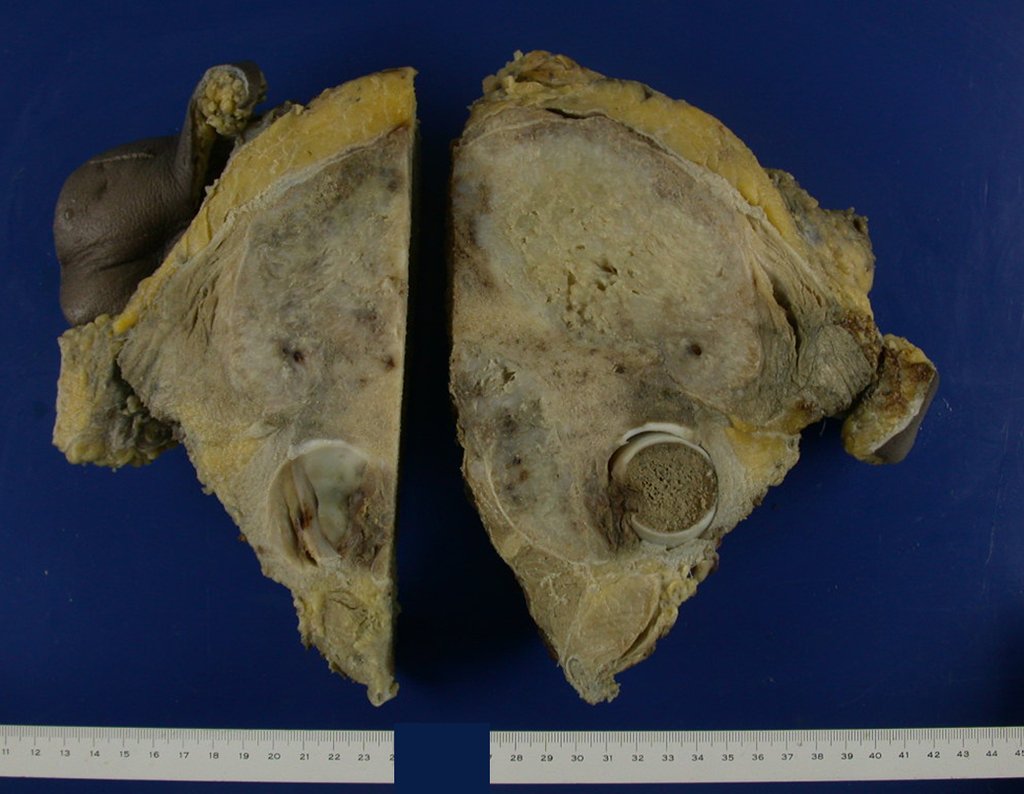
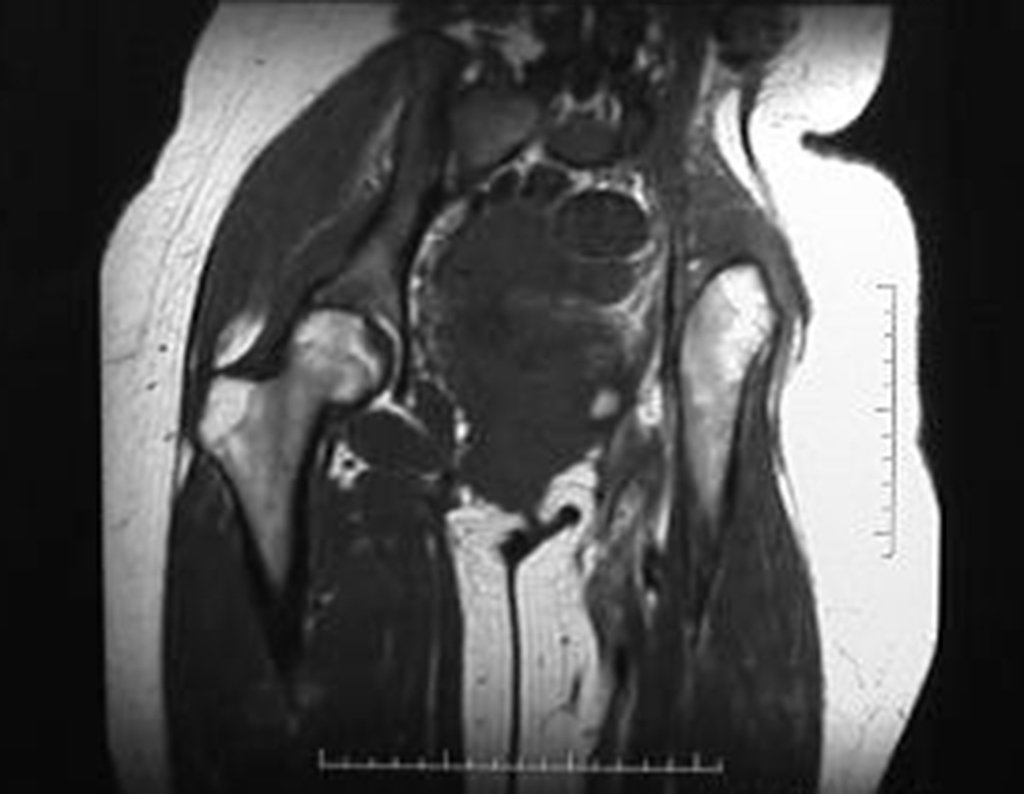
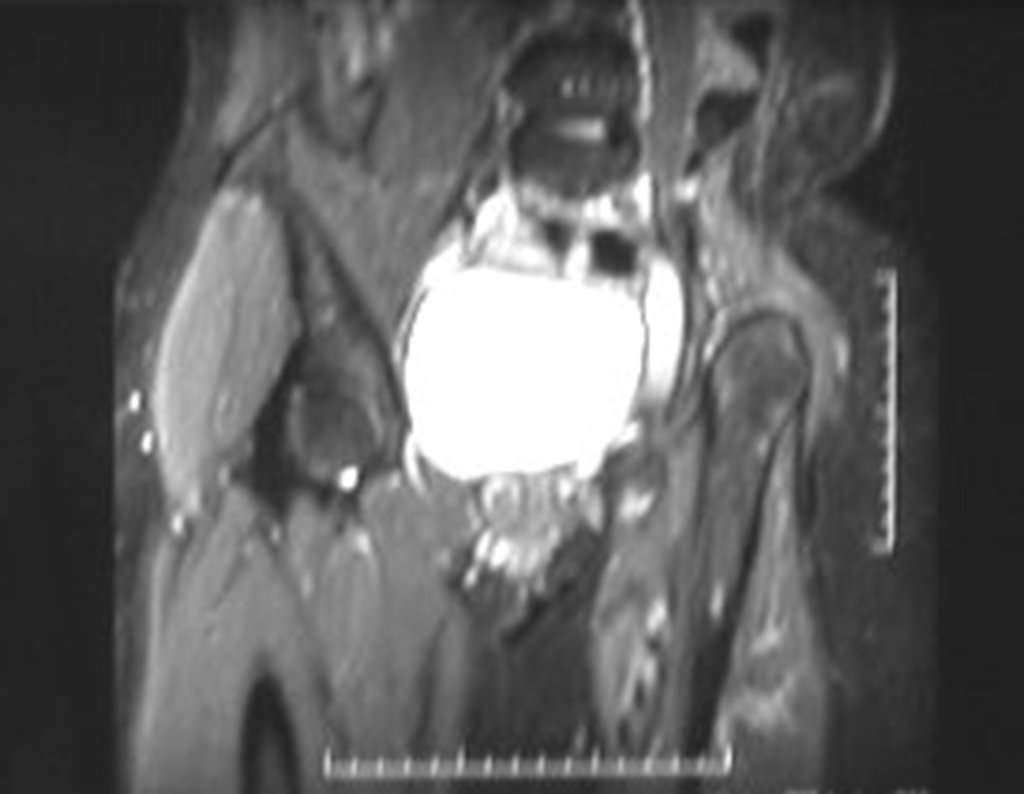
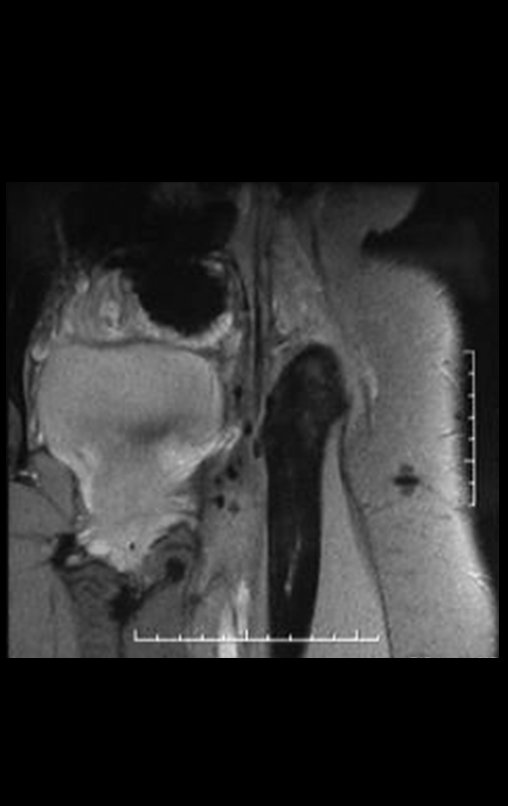
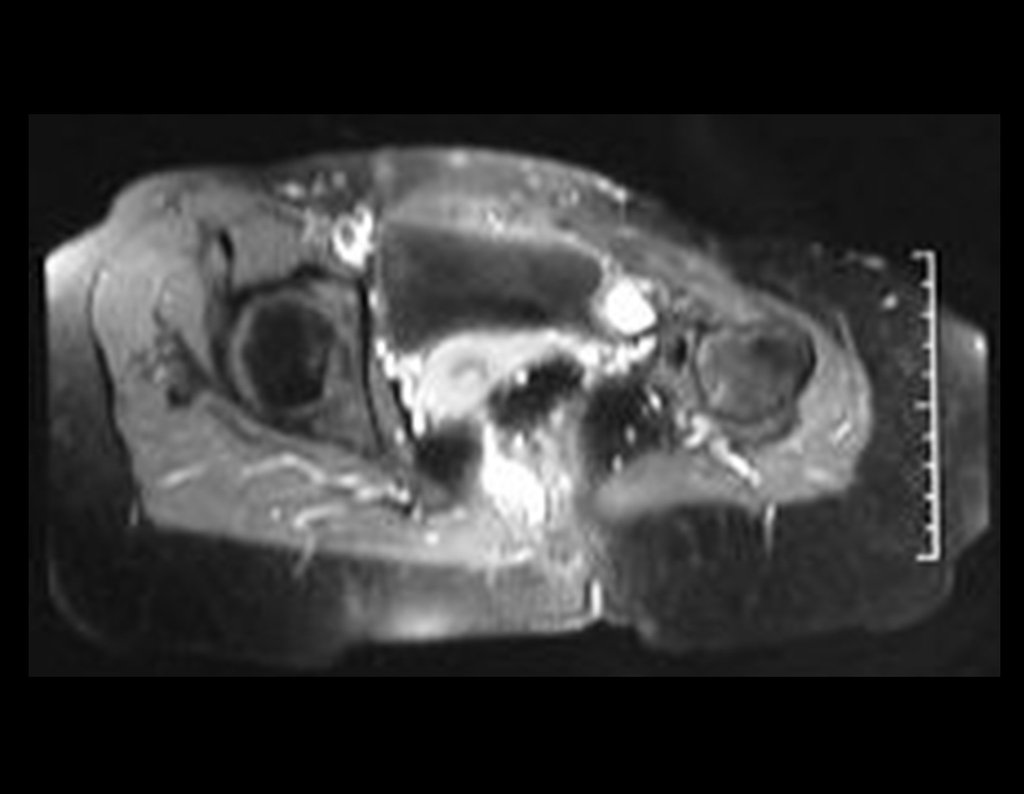
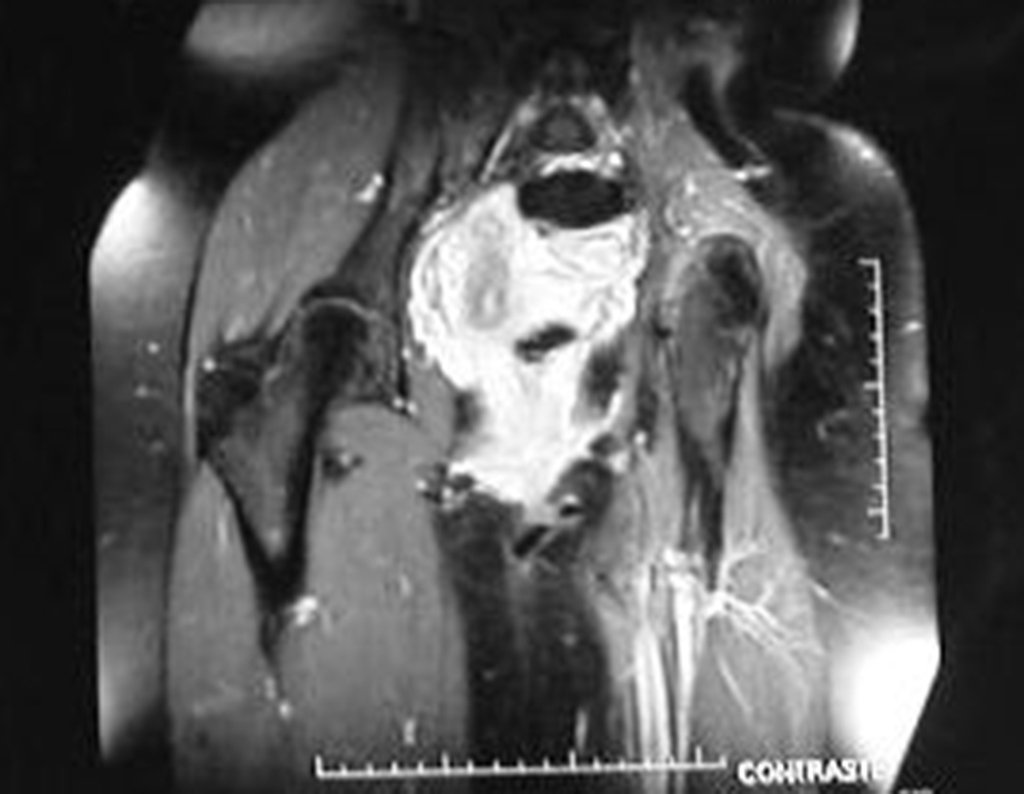
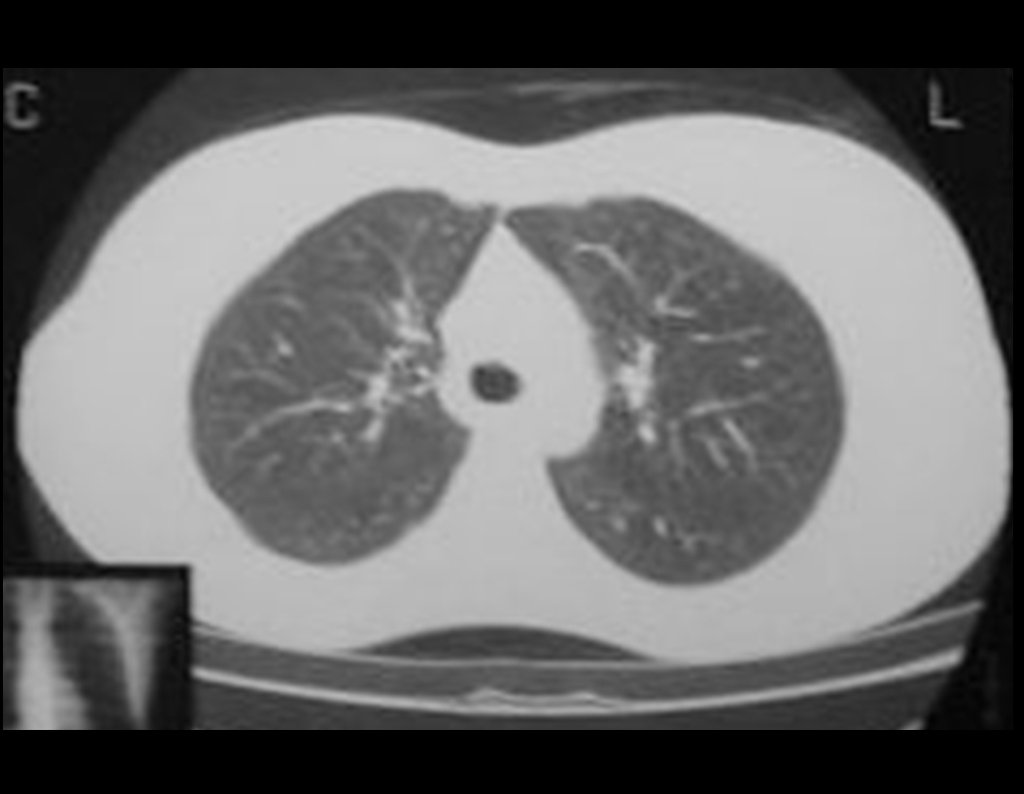
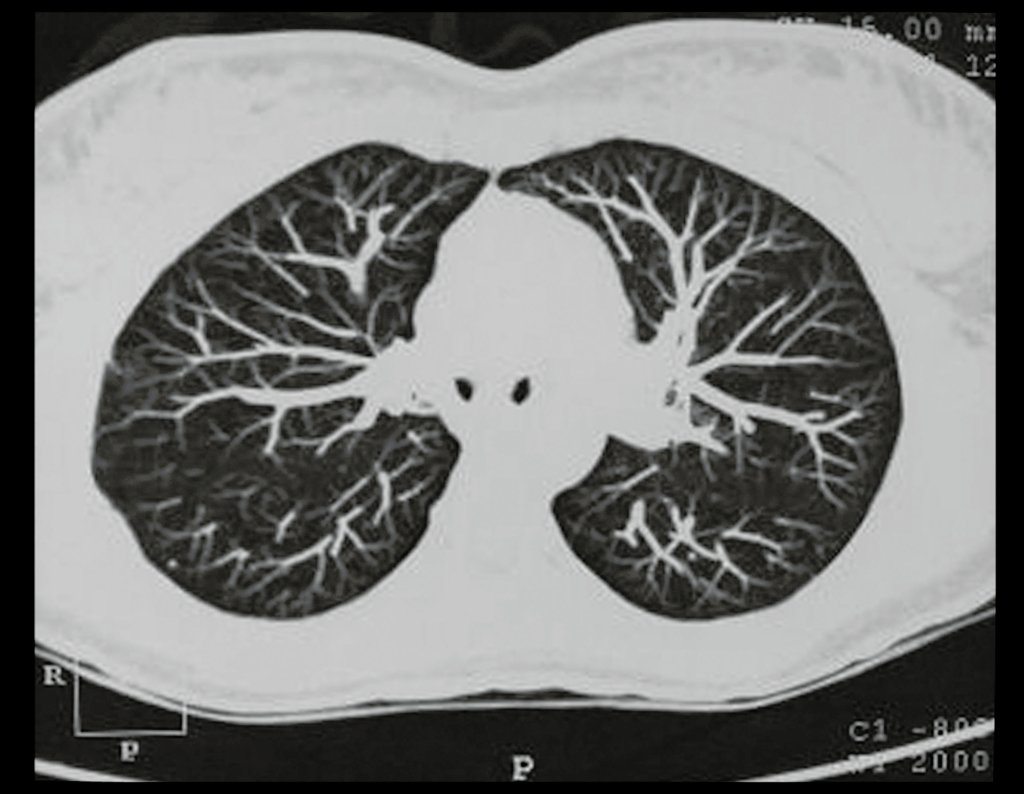
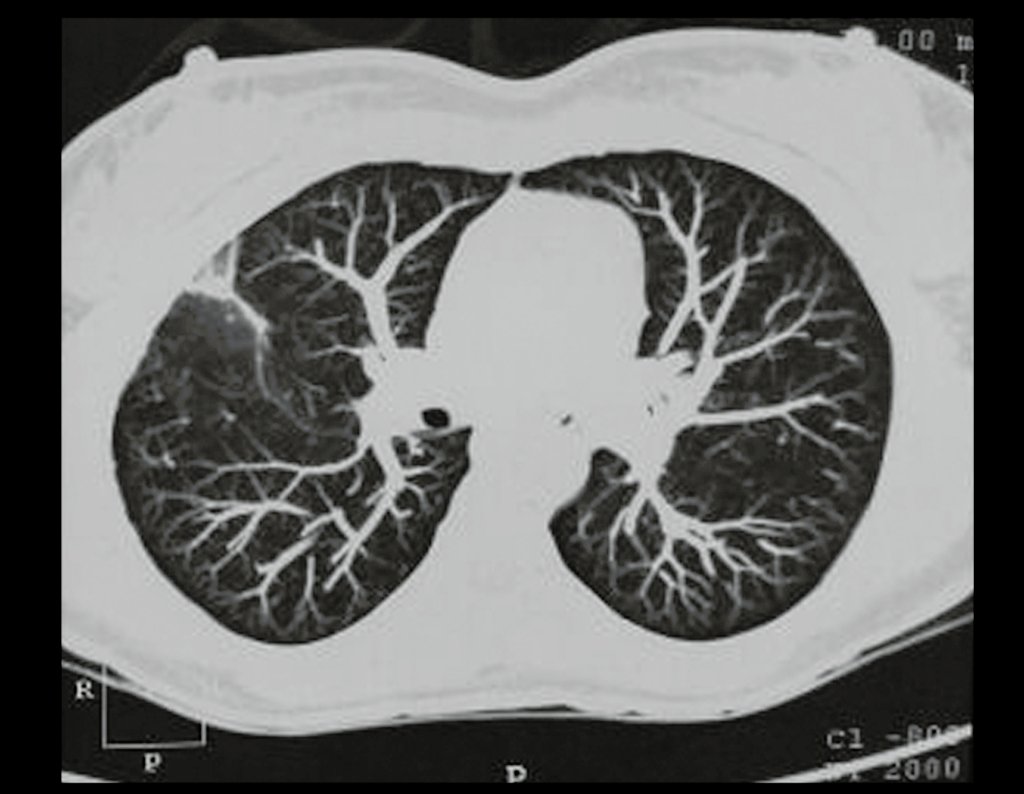
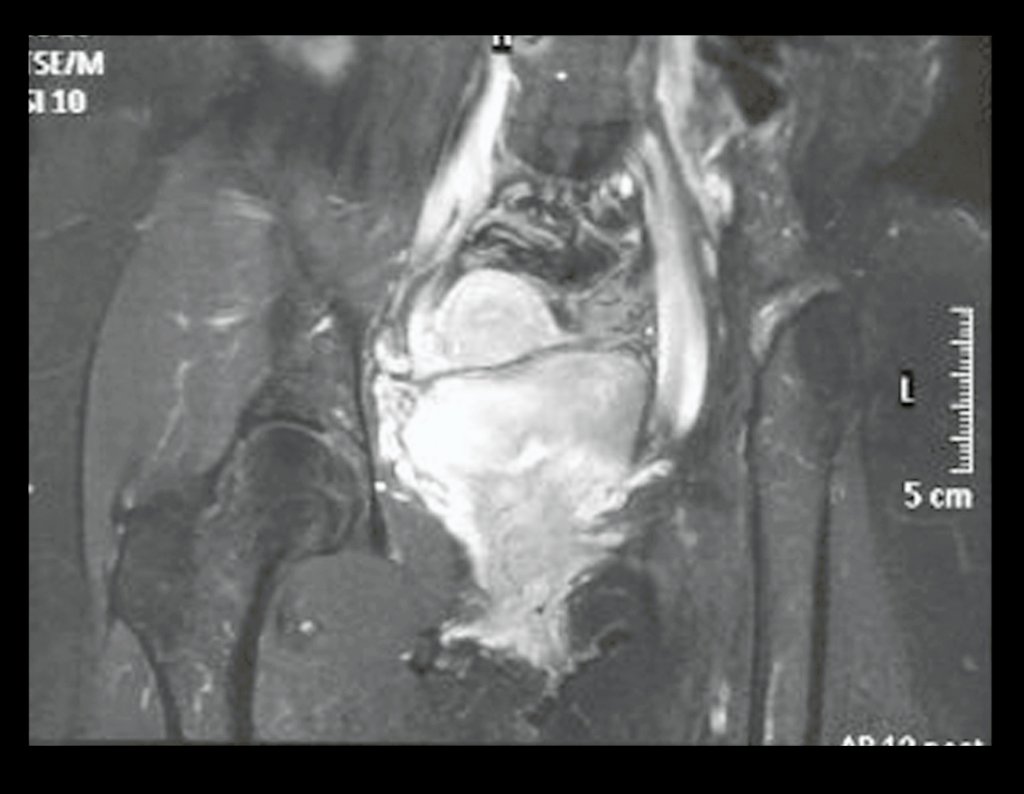
Niña de nueve años y tres meses de edad, con antecedente de traumatismo directo en tobillo derecho hace dos meses, que evoluciona con dolor y edema local. Buscó tratamiento médico y le diagnosticaron una contusión. La inmovilización con yeso se realizó durante seis días. Quince días después notó un aumento de volumen en su tobillo, que le dolía y endurecía, y buscó nuestro servicio. La radiografía reveló una lesión radiolúcida, de localización central, en el tercio distal de la tibia, con límites radiológicos imprecisos y una fina reacción perióstica laminar (fig. 1). La gammagrafía ósea mostró intensa captación sólo en el sitio y la resonancia magnética nuclear (fig. 2) mostró intensa afectación de la región metaepifisaria, con afectación evidente de la placa epifisaria tibial. Los exámenes de laboratorio demostraron cambios en el metabolismo óseo, con fosfatasa alcalina y calcio sérico muy elevados. Se realizó una biopsia con aguja y se confirmó el diagnóstico de osteosarcoma condroblástico. Se inició tratamiento de quimioterapia neoadyuvante, con tres ciclos de quimioterapia. Como parte de la planificación quirúrgica preoperatoria, realizamos arteriografía (fig. 3) para visualizar el surgimiento de la arteria nutricia del peroné, momento que consideramos importante para identificar el sitio seguro para la osteotomía y su transposición. Previo a la cirugía se realizó una ortesis cruropodal de polietileno, buscando una adecuada inmovilización, brindando un mejor soporte al miembro en el postoperatorio (fig. 4). Luego de quimioterapia neoadyuvante, fue sometida a tratamiento quirúrgico.
DESCRIPCIÓN DE LA TÉCNICA QUIRÚRGICA
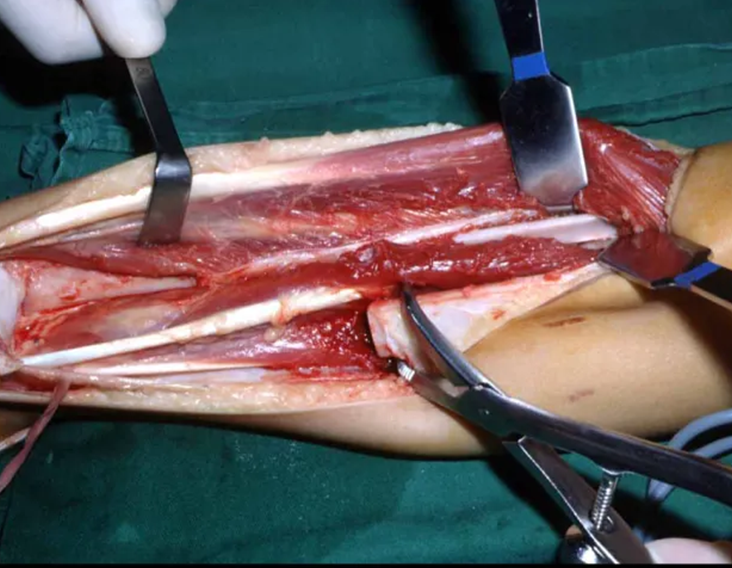
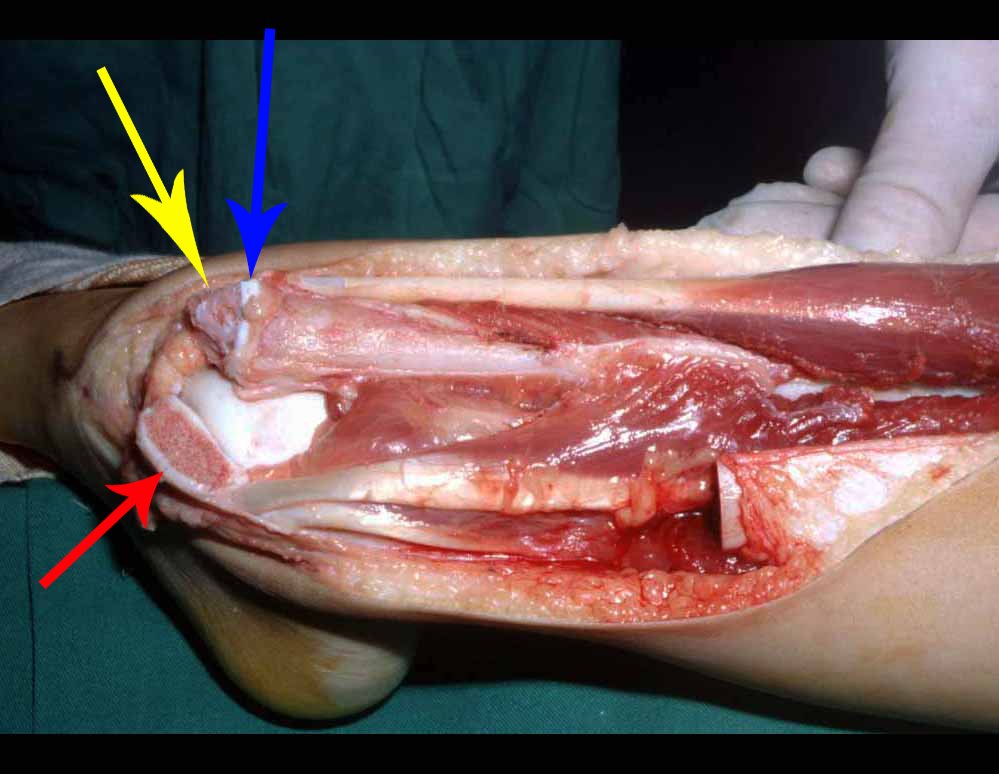
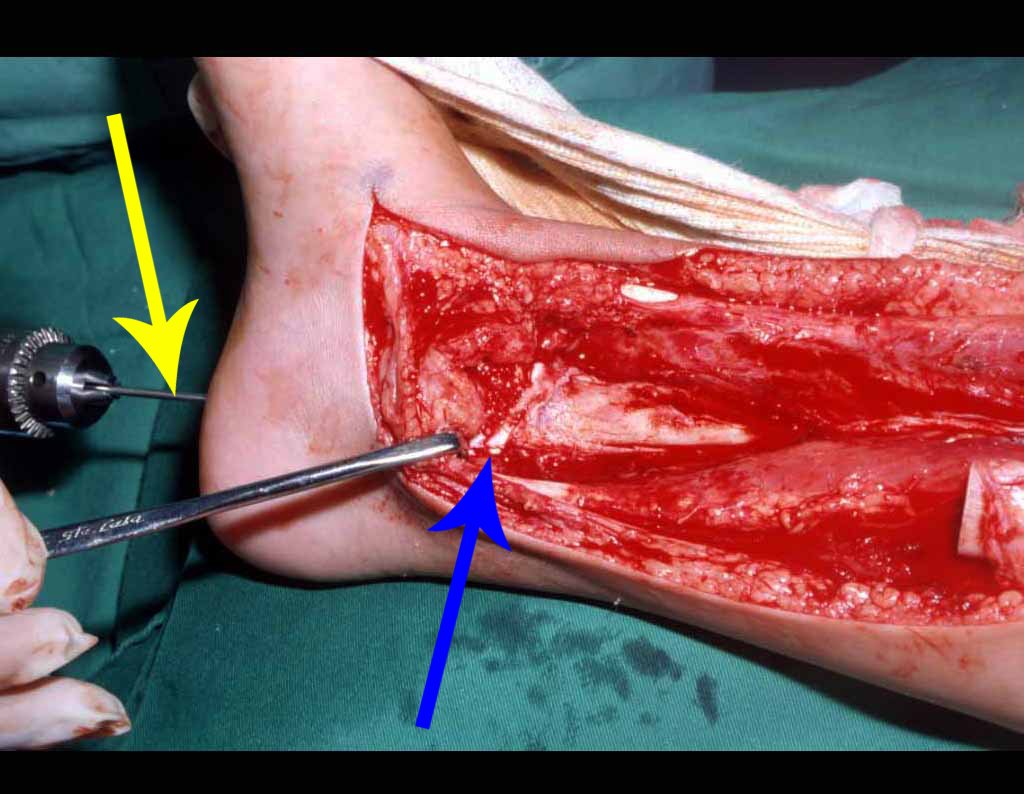
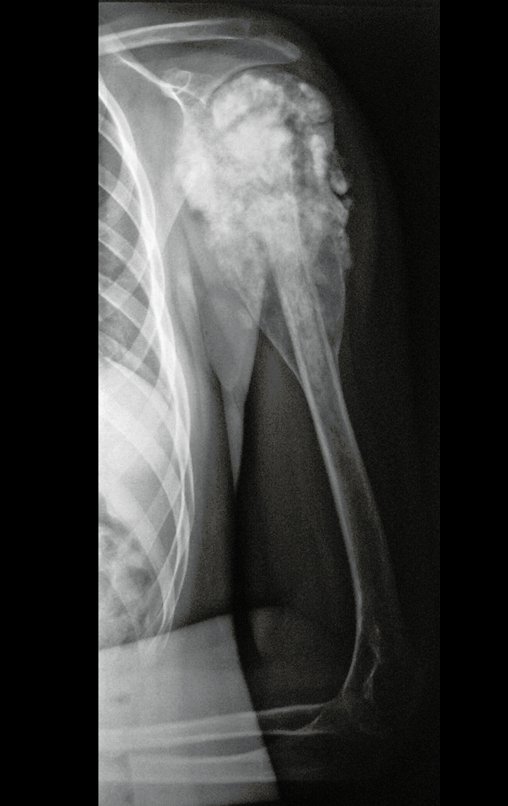
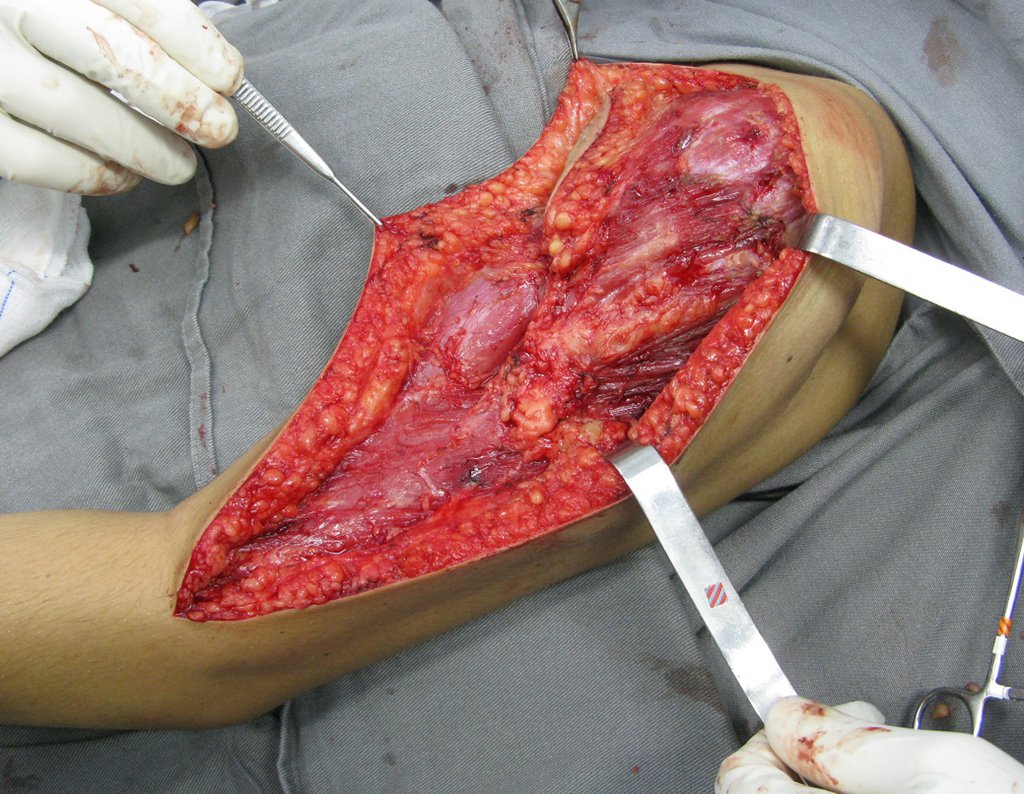
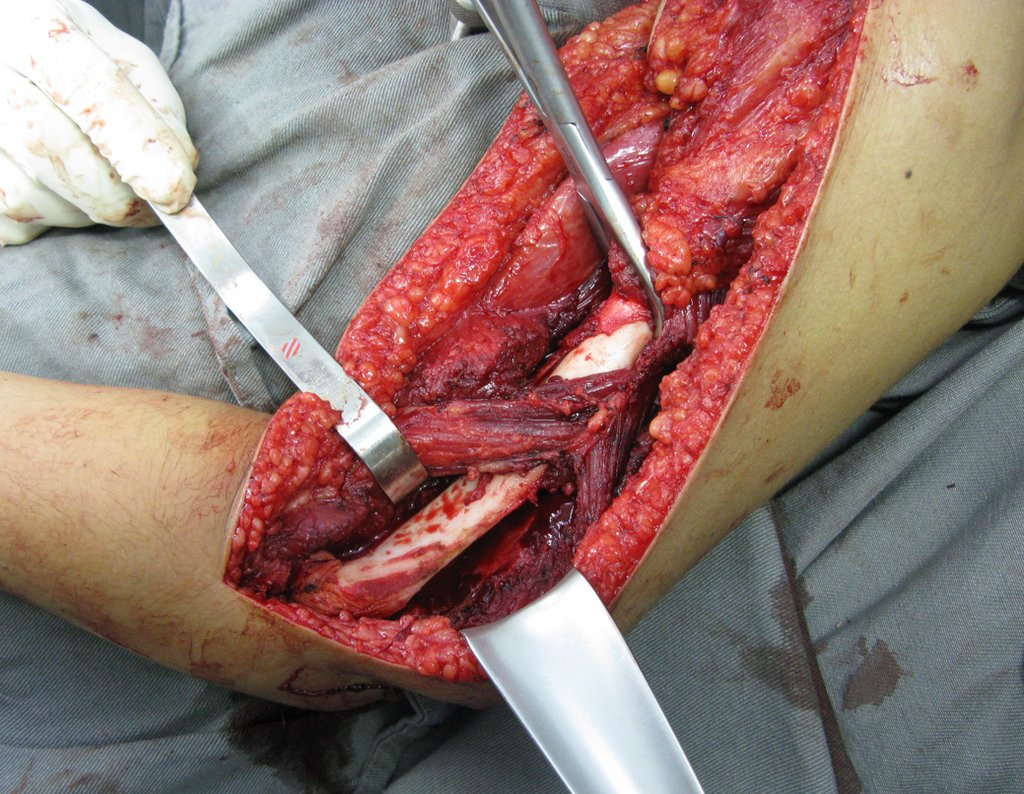
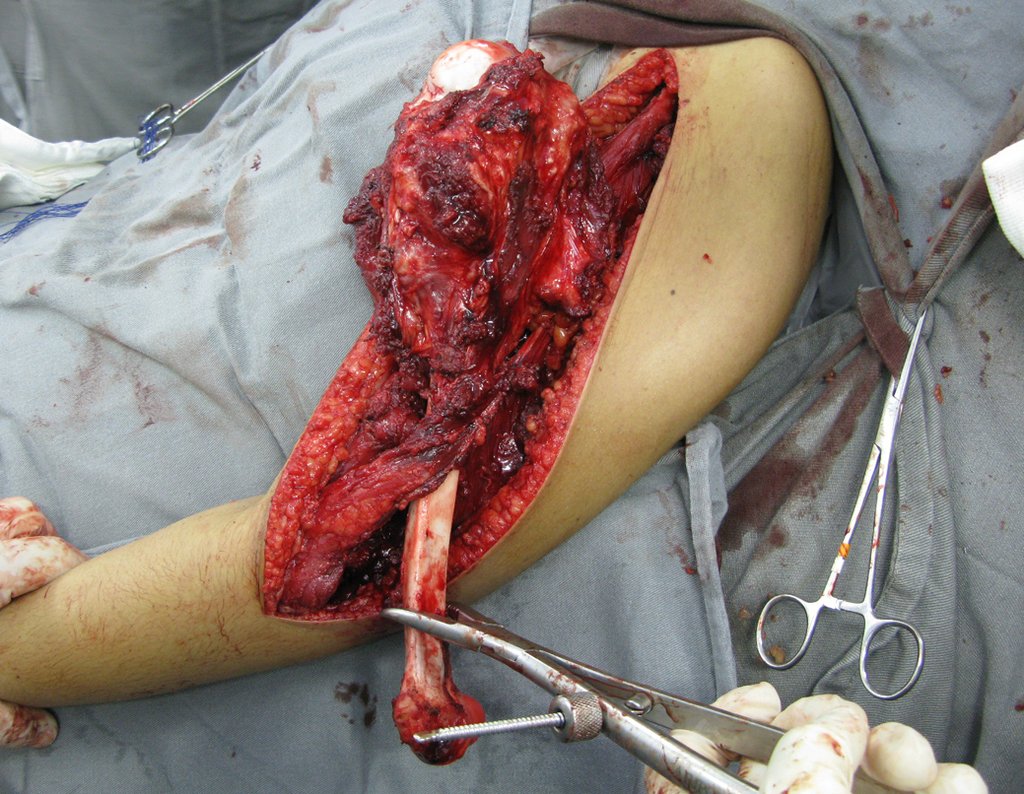
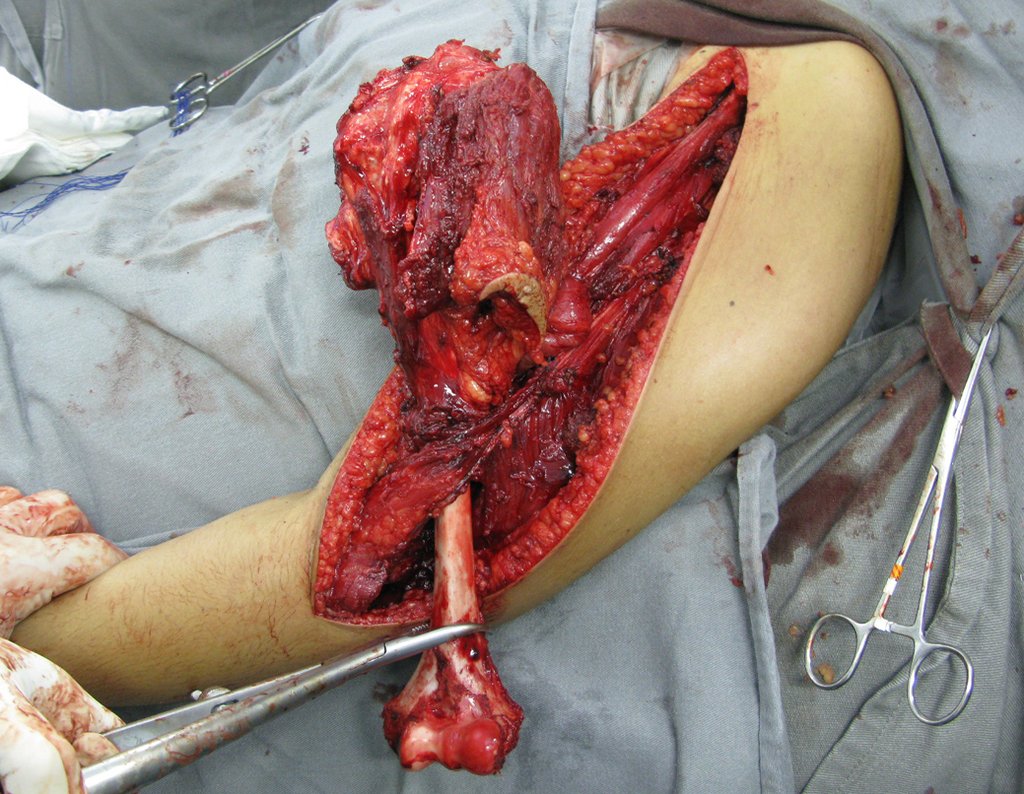
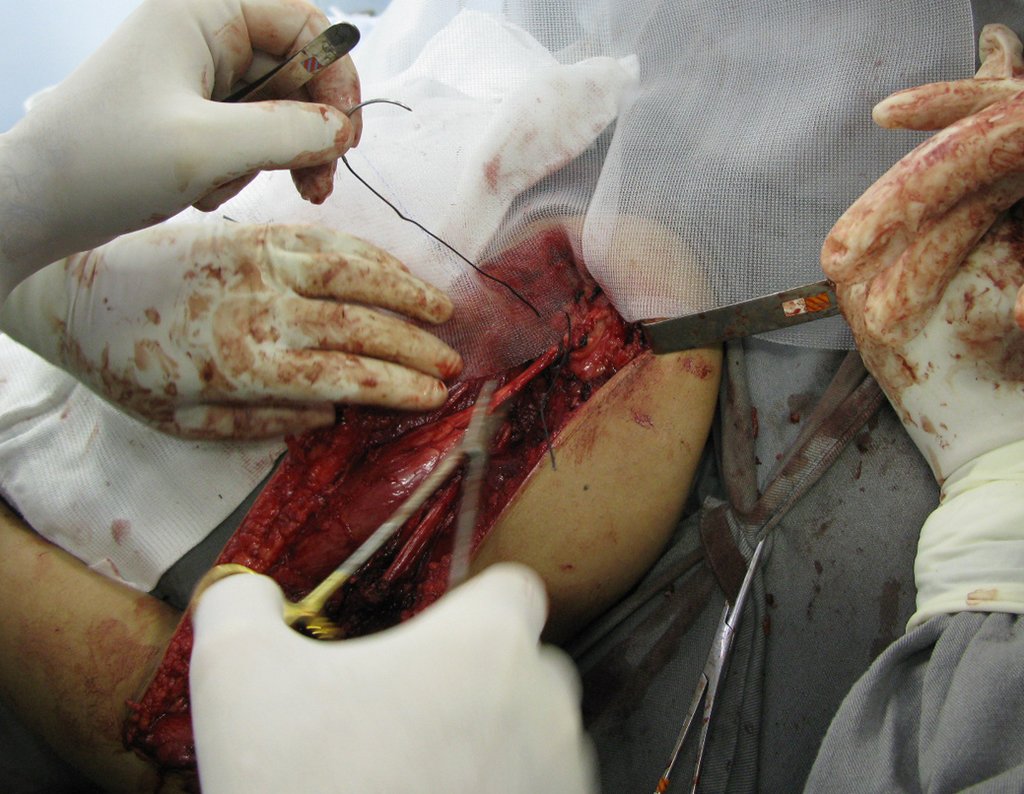
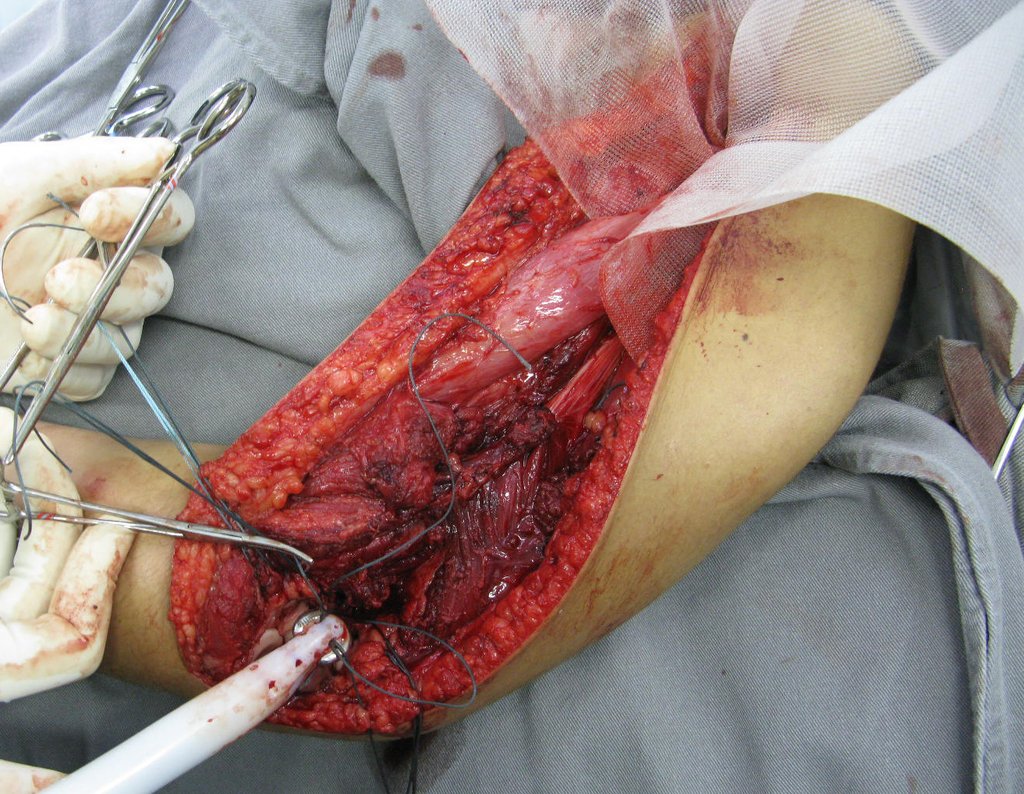
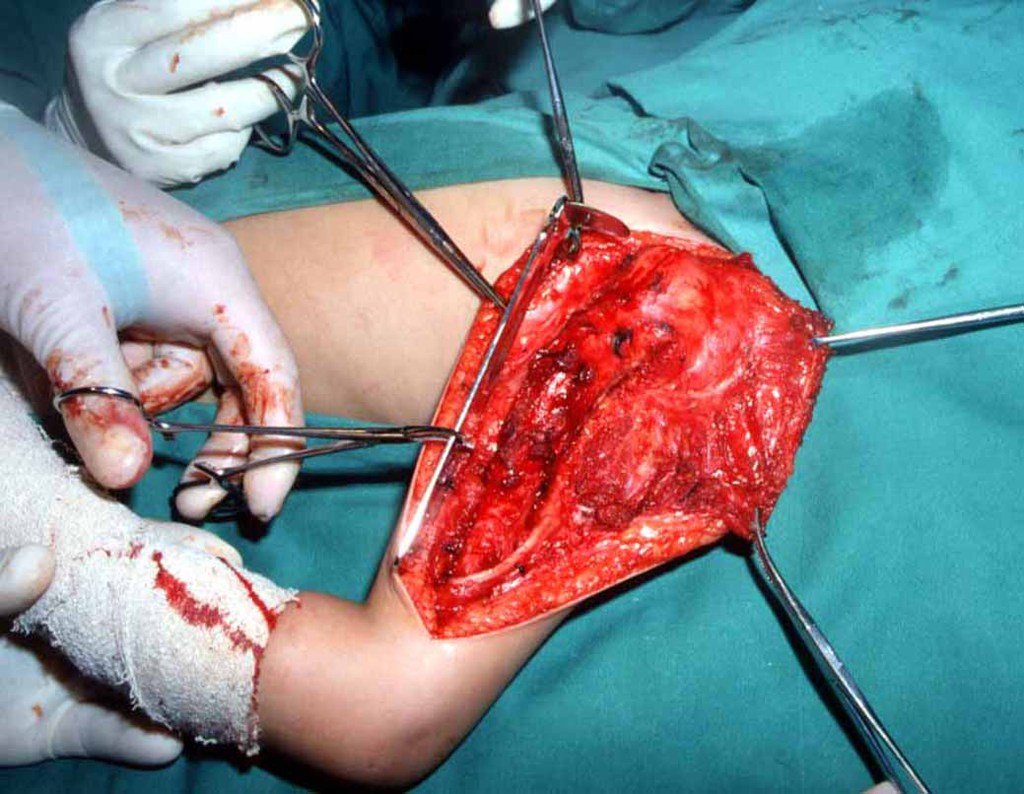
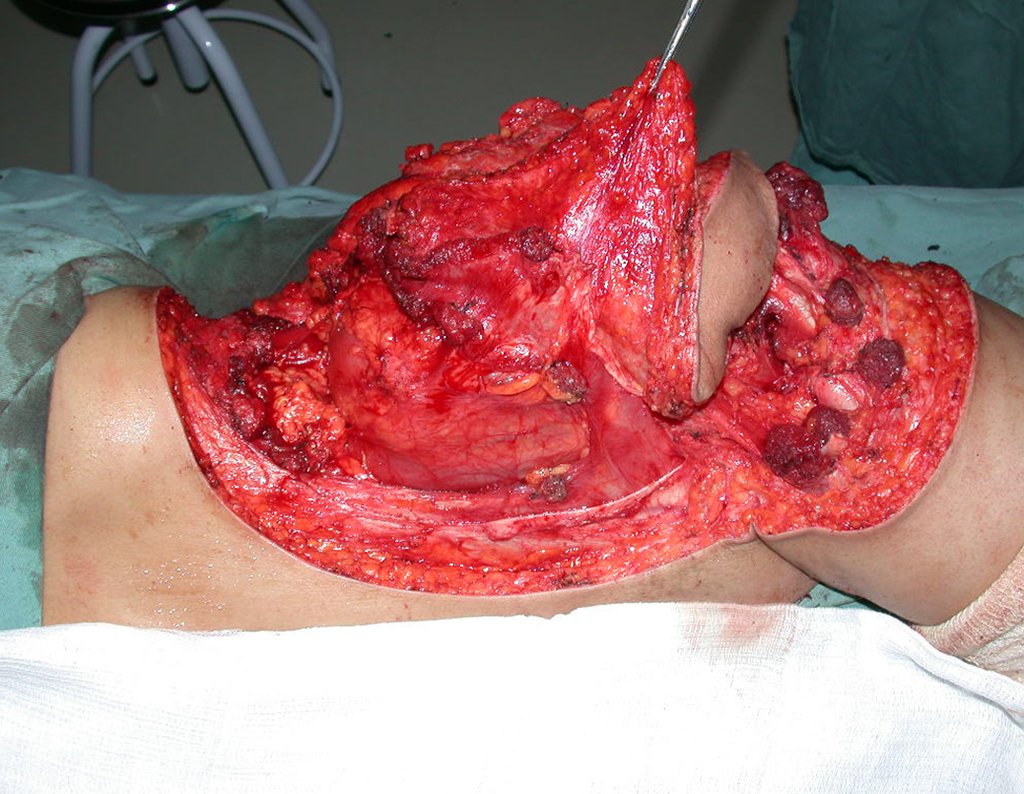
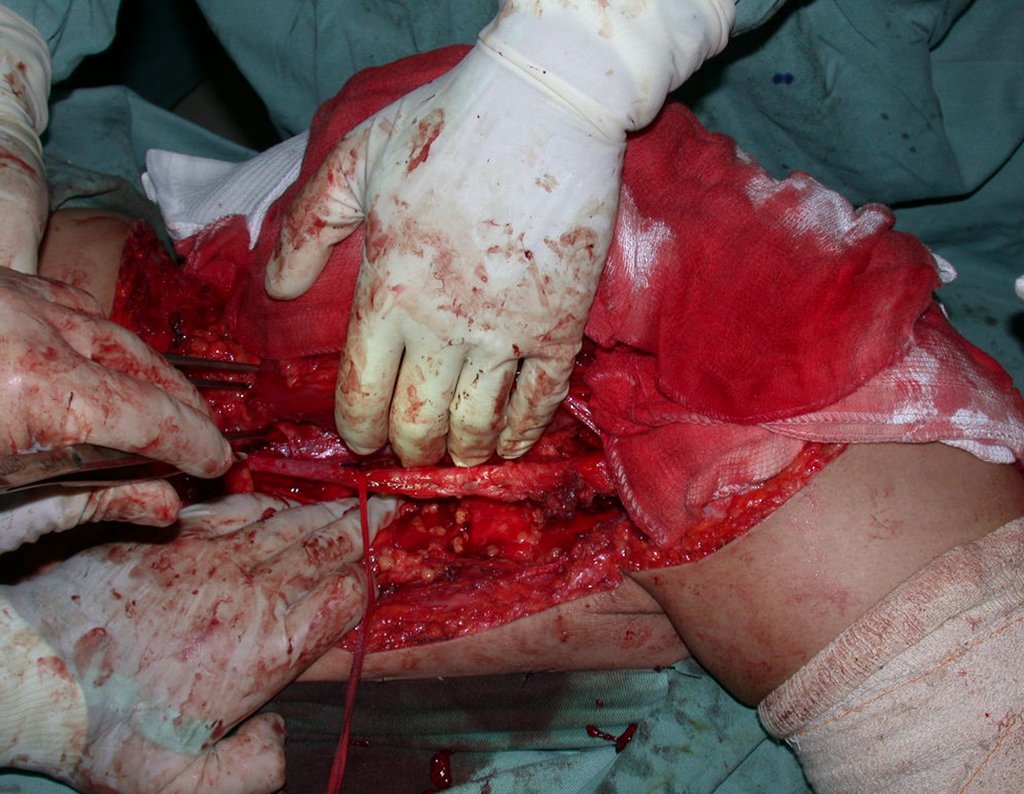
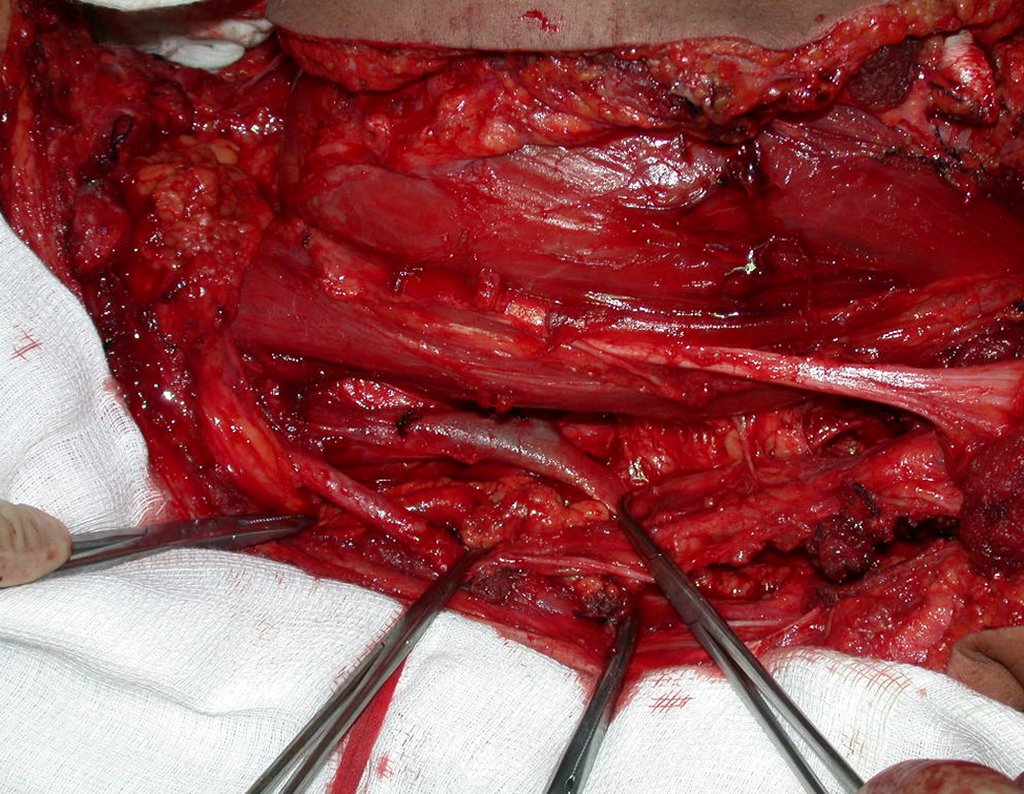
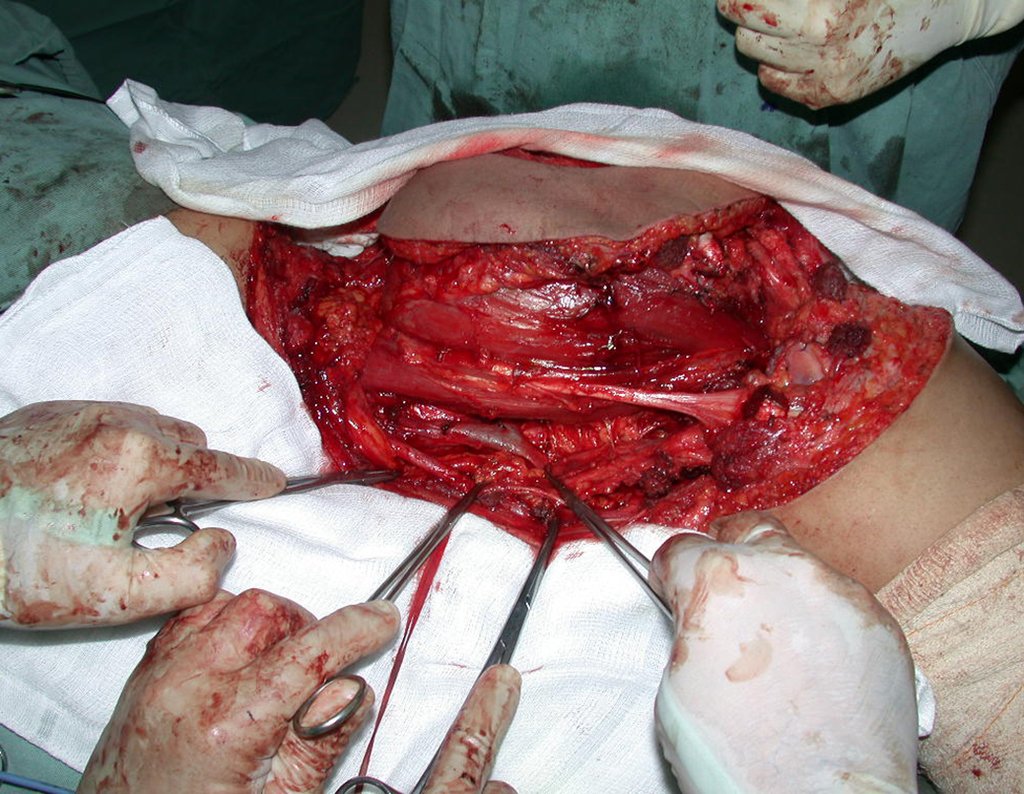
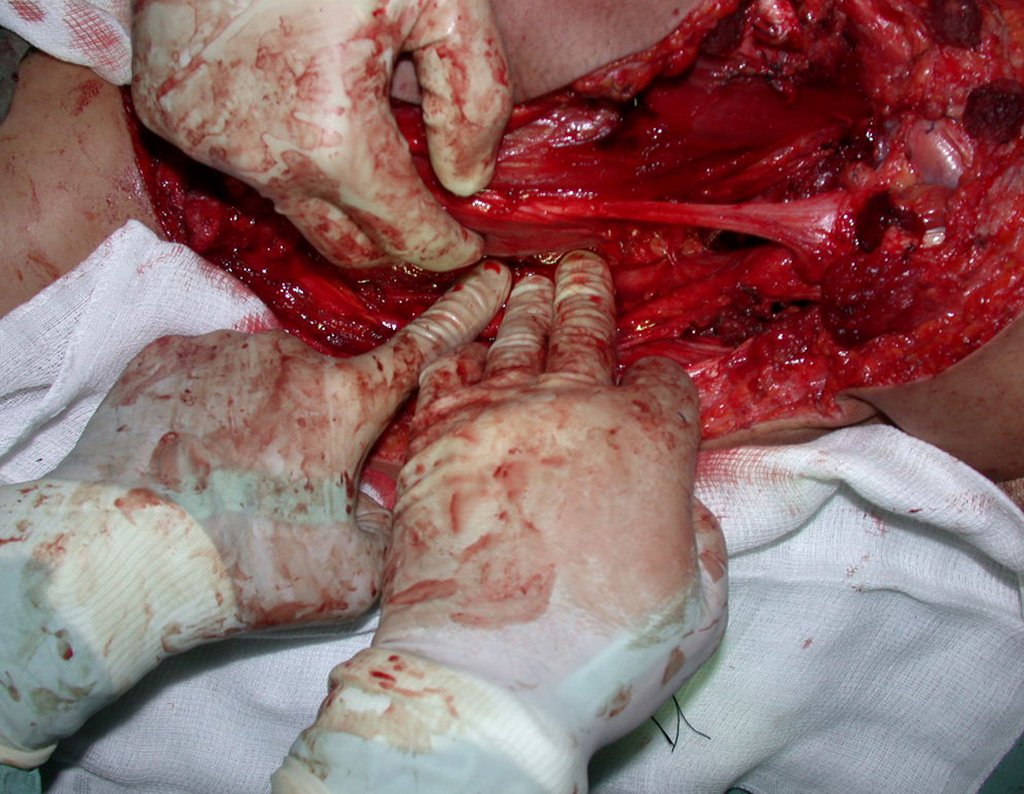
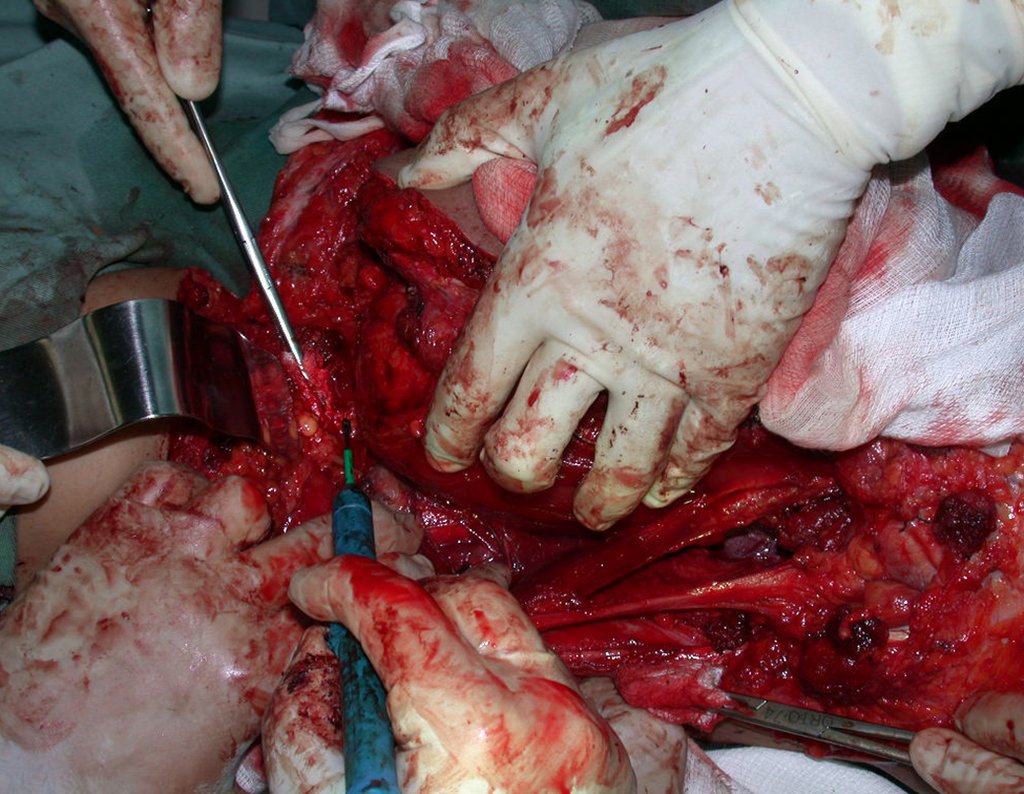
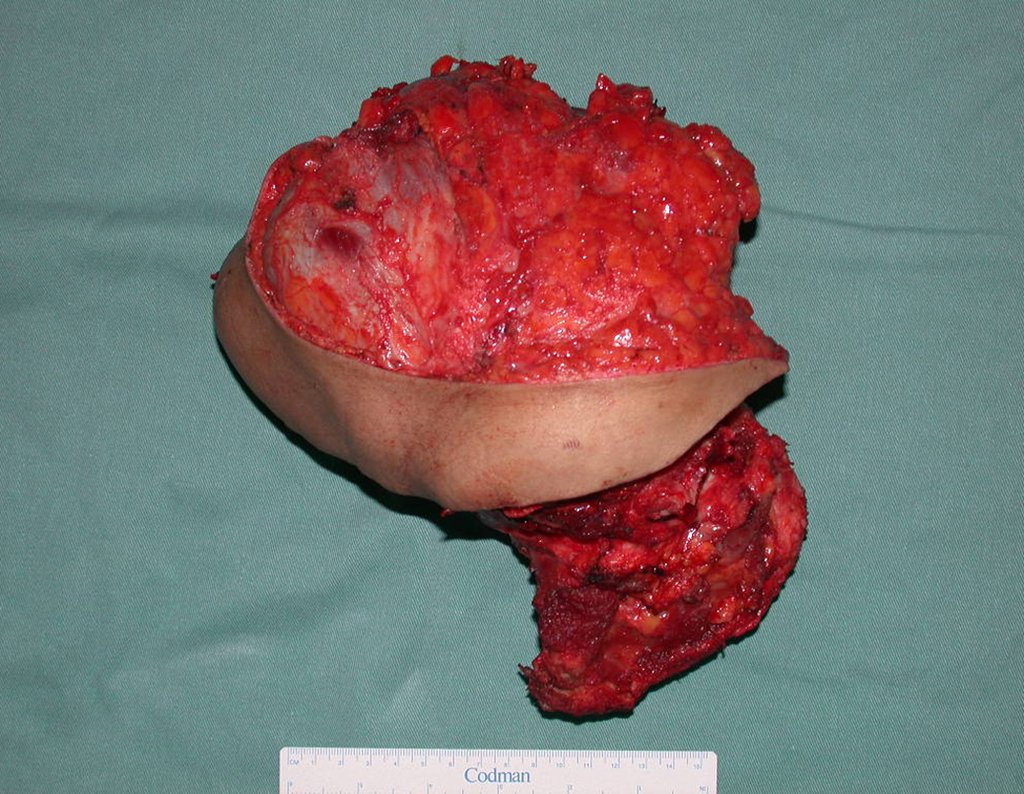
La cirugía se realiza con una incisión arqueada convexa medial comenzando al nivel de la cabeza del peroné, pasando por la superficie anterior de la pierna, hasta el final del maléolo lateral. La lesión se reseca con un margen oncológico macroscópico en los tejidos blandos y un margen óseo de 3,0 cm (fig. 5). Tras la resección del tumor, utilizando como guía la membrana interósea, se abordó el lugar de la osteotomía del peroné proximal, por encima de la emergencia de la arteria nutricia, confirmado mediante estudio arteriográfico previo (fig. 6). En este caso, como la resección del segmento tibial fue menor, abrimos una hendidura en la superficie lateral del segmento proximal de la tibia, de aproximadamente 3,5 cm de largo y lo suficientemente ancha como para permitir su enclavamiento, con una mínima desperiostización del extremo proximal. del segmento transpuesto, y sin perjudicar la nutrición proporcionada por la arteria nutricia. A continuación, retiramos el cartílago de la epífisis del peroné y tallamos un agujero en la cúpula (fig. 7) del astrágalo, permitiendo que encaje esta epífisis distal del peroné. Se continuó con el paso cuidadoso de un alambre de 2,5 mm de diámetro a través del canal medular del peroné, atravesando la placa fisaria. Este hilo continúa por la epífisis y pasa por el astrágalo y el calcáneo hasta aparecer en la piel (fig. 8).
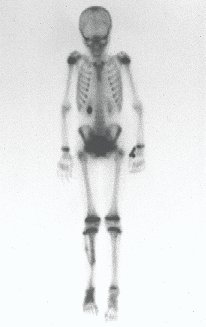
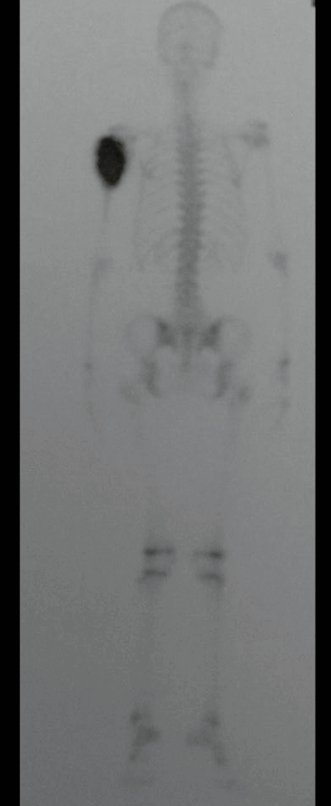
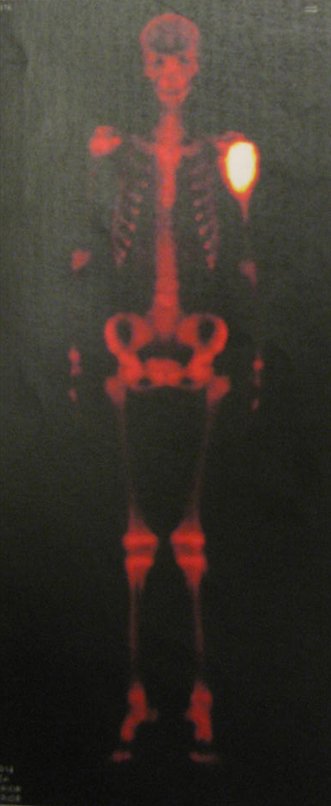
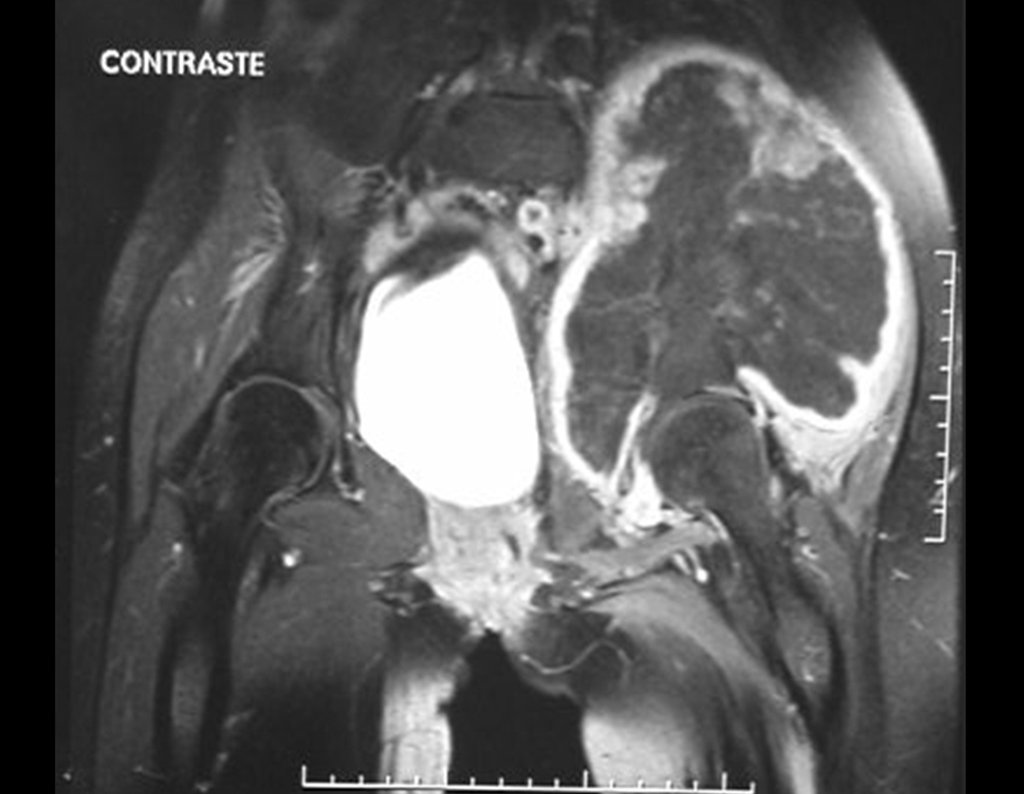
En el postoperatorio inmediato se mantuvo la extremidad en inmovilización con el dispositivo crurópodo previamente elaborado. Seis semanas después de la cirugía se realizó una gammagrafía ósea con cortes axiales, comprobándose una buena vascularización del injerto (fig. 11). En la región metafisaria del peroné trasplantado, el aumento de la hipercaptación puede deberse a la vascularización de la propia placa fisaria y también al proceso reparativo en el sitio de la artrodesis talofibular. Los controles radiológicos de septiembre/98, nueve meses después de la cirugía, muestran la integración completa del peroné transpuesto, tanto proximal como distalmente. El engrosamiento del peroné ya es evidente y se puede distinguir fácilmente su placa de crecimiento (fig. 12).
DISCUSIÓN
Los avances en la poliquimioterapia en el tratamiento del osteosarcoma han aportado nuevas perspectivas sobre el pronóstico y abordaje de los pacientes afectados. El control de la enfermedad mediante quimioterapia permitió preservar las extremidades, permitiendo proponer nuevas posibilidades y las más variadas soluciones(4,8,13). Una de las soluciones fue la sustitución del segmento afectado por prótesis internas no convencionales. Sin embargo, en los niños pequeños existen básicamente dos grandes problemas: los pacientes siguen creciendo y las prótesis se vuelven insuficientes, siendo necesaria en algunos casos la amputación, muchas veces años después del inicio del tratamiento(5,6); Además, las prótesis sufren un desgaste excesivo y los pacientes jóvenes deben someterse a revisiones tempranas. Las prótesis en niños tienen indicaciones muy limitadas(6). Con el considerable aumento de la supervivencia, se hizo necesario que el cirujano ortopédico buscara soluciones quirúrgicas duraderas para salvar las extremidades. El uso de un injerto homólogo para llenar el espacio óseo es una opción. Sin embargo, además de la mayor dificultad en la integración del injerto, el mayor número de complicaciones, superando incluso a las de las endoprótesis, también requiere de un banco de huesos, lo que no siempre es posible en nuestra realidad(6). El uso de injertos autólogos a veces se ve limitado cuando es necesario sustituir resecciones grandes. El injerto óseo vascularizado se ha utilizado con mayor frecuencia y presenta buenos resultados. A la hora de sustituir segmentos de tibia, la opción ha sido utilizar el peroné vascularizado ipsilateral o contralateral, y se han propuesto varias técnicas(3,5,9-12,15-18,23-25). Algunas de estas técnicas se realizan en dos tiempos operatorios, lo que aumenta la morbilidad. También se utilizan técnicas microquirúrgicas, pero requieren de un equipo especializado, con tiempo quirúrgico prolongado. La técnica que aquí se presenta es rápida, fácil de realizar, se realiza en un solo procedimiento quirúrgico y no requiere técnica microquirúrgica. En un intento de preservar la longitud de la extremidad, transpusimos un segmento del peroné con la fisis distal, esperando que permanezca activo. Aún no podemos decir, debido al corto período de seguimiento, que la preservación de la fisis en la técnica de transposición del peroné conducirá al crecimiento óseo, ni cómo se producirá este crecimiento.
CONCLUSIONES PRELIMINARES
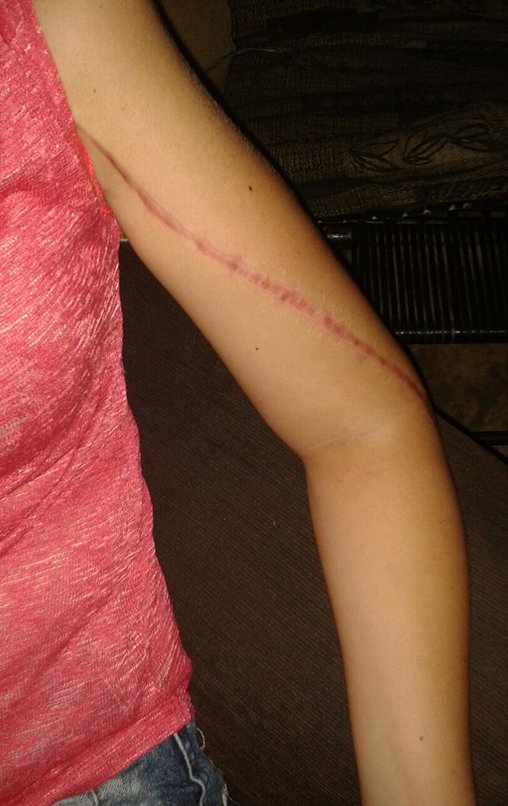
La solución biológica en el tratamiento del osteosarcoma es una realidad cada vez más común en nuestro país y siempre debe ser considerada. Creemos que la presencia de hipercaptación ósea a nivel de la proyección de la placa fisaria del peroné distal en los exámenes de mapeo óseo puede ser evidencia de que es viable, aunque es imposible distinguir qué parte de este proceso se debe a reacción ósea. al nivel de fijación de la epífisis del peroné en el cuerpo del astrágalo. Considerando el corto período de seguimiento y el hecho de que se trata de un caso único, no es posible evaluar definitivamente el método de tratamiento utilizado. Lo que podemos decir con satisfacción, por el momento, es que los controles radiológicos de septiembre/98, nueve meses después de la cirugía, muestran una integración completa del peroné transpuesto, tanto proximal como distalmente. El engrosamiento del peroné ya es evidente y la placa de crecimiento del peroné se puede distinguir fácilmente. Creemos que se producirá un crecimiento y esperamos que haya una adaptación de esta placa fisaria, para que crezca con la velocidad de la tibia, ya que sabemos que la velocidad de crecimiento también está influenciada por la ubicación en la que se encuentra.
REFERENCIAS:
1. Bacci, G. et al: Quimioterapia primaria y cirugía tardía para el osteosarcoma telangiectásico no metastásico de las extremidades: resultados en 28 pacientes. Eur J Cáncer 30A: 620-626, 1994.
2. Campanacci, M.: “Osteosarcoma clásico”, en Campanacci, M. et al: Tumores óseos y de tejidos blandos, Bolonia, Aulo Gaggi Ed., 1990. p. 455-480.
3. Campbell, WC: Transferencia del peroné como complemento a la deficiencia tibial del injerto óseo libre: informe de tres casos. J Orthop Surg 1:625, 1919.
4. Carter, SR, Grimer, RJ y Sneath, RS: una revisión de la experiencia de 13 años con osteosarcoma. Clin Orthop 270: 45-51, 1991.
5. Chacha, PB: Injerto pedicular vascular del peroné ipsilateral para pseudoartrosis de la tibia con un gran defecto. J Bone Joint Surg [Br] 63: 244-253, 1981.
6. David, A. et al: Osteosarcoma: revisión de 39 casos. Rev Bras Ortop 33: 45-48, 1998.
7. Davis, AM, Bell, RS y Goodwin, PJ: Factores pronósticos en el osteosarcoma: una revisión crítica. J Clin Oncol 12: 423-431, 1994.
8. Dubousset, J., Missenard, G. y Kalifa, C.: Manejo del sarcoma osteogénico en niños y adolescentes. Clin Orthop 270: 52-59, 1991.
9. Girdlestone, GR y Foley, WB: Pérdida extensa de diáfisis tibial. Injerto ti-bio-peroneo. Br J Surg 20: 467-471, 1933.
10. Hahn, E.: Eine método, pseudoartrosis der tibia mit grossem knochen defecto zur heitung zubringen. Zentralbl Chir 11: 337-341, 1884.
11. Huntington, TW: Caso de transferencia ósea. Ann Surg 41: 249-251, 1905.
12. Jones, KG & Barnett, HC: Injerto de hueso esponjoso para la pseudoartrosis de la tibia mediante el abordaje posterolateral. J Bone Joint Surg [Am] 37: 1250-1260, 1955.
13. Lane et al.: Sarcoma osteogénico. Clin Orthop 204: 93-110, 1986.
14. Marwin, MR: Amputación por osteosarcoma. Cáncer Bull 42: 337-343, 1990.
15. McCarrol, HR: El tratamiento quirúrgico de las fracturas no consolidadas de tibia. JAMA 175: 578-583, 1961.
16. McMaster, PE y Hohl, M.: Injerto de clavija cruzada tibioperonea. J Bone Joint Surg [Am] 47: 1146-1158, 1965.
17. Meyerding, HW: Defectos tibiales con pseudoartrosis creados por la transferencia del peroné y la fusión tibioperonea. Am J Surg 52:397-404, 1941.
18. Milch, H.: Operación de sinostosis de pseudoartrosis persistente de la tibia. Un informe de caso. J Bone Joint Surg [Am] 21: 409-420, 1939.
19. Petrilli, S. et al: osteosarcoma IIB. Estadísticas de gestión actual, control local y supervivencia – São Paulo, Brasil. Clin Orthop 270: 60-66, 1991.
20. Picci et al: Relación de la necrosis inducida por quimioterapia y los márgenes quirúrgicos con la recurrencia local en el osteosarcoma. J Clin Oncol 12: 2699-2705, 1994.
21. Simon, AM y Springfield, D.: Cirugía para tumores de huesos y tejidos blandos, Baltimore, Lippincott-Raven, 1998. p. 266.
22. Spanier, SS, Shuster, JJ y Griend, RAV: El efecto de la extensión local del tumor en el pronóstico del osteosarcoma. J Bone Joint Surg [Am] 72: 643-653, 1990.
23. Stone, JS: Pérdida parcial de la tibia sustituida por transferencia del peroné, con mantenimiento de ambos maléolos del tobillo. Ann Surg 46: 628-632, 1907.
24. Taylor, GI & Millar, GDH: El injerto óseo vascularizado libre, una extensión clínica de las técnicas microvasculares. Plast Reconstr Surg 55: 533-544, 1975.
25. Wilson, PO: Un método simple de trasplante de peroné en dos etapas para su uso en casos de pseudoartrosis congénita y complicada de la tibia. J Bone Joint Surg [Am] 23: 639-675, 1941.
Clic aquí para descargar el pdf
Haz clic aquí para ver la técnica completa con más detalle.
Lea también:
Uso de dispositivo interno extensible en el fémur de perros jóvenes .
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com