Sarcoma de tejidos blandos
El sarcoma de tejidos blandos es una neoplasia maligna, derivada del mesénquima que se presenta en los tejidos blandos, como músculos, fascias, tendones, etc. No se llama carcinoma porque este nombre hace referencia a neoplasias malignas que tienen su origen embrionario en el ectodermo, como la piel, los nervios, las vísceras o las glándulas.
Esta neoplasia surge a partir de una célula mesenquimatosa que sufre una mutación y comienza a tener una reproducción celular anómala, produciendo células polimorfas, de diferentes tamaños, hipercromáticas, dando como resultado un tejido atípico, por tanto maligno.
Su nomenclatura viene dada por su similitud con el tejido que intentan reproducir. Así, por ejemplo, cuando el tejido neoformado atípico presenta un aspecto similar al tejido graso, se denomina liposarcoma.
Etiología:
La mayoría de los sarcomas de tejidos blandos no tienen una etiología definida, pero algunos factores de riesgo están bien descritos, como radioterapia previa, linfedema, síndrome de Li-Fraumeni, neurofibromatosis tipo I, propensión genética individual e infección por VIH.
Incidencia:
Es un tumor raro, ya que el grupo de todos estos sarcomas comprende alrededor del 12 por ciento de las neoplasias pediátricas, predominando el patrón de “células pequeñas y redondas”, como el rabdomiosarcoma embrionario y el tumor neuroectodérmico periférico primitivo, y sólo el uno por ciento de todos los tumores malignos en adultos. 1,2 , Tabla 1.
Se estima que hay 12.000 nuevos casos de sarcomas de tejidos blandos al año en EE.UU., que causan alrededor de 4.700 muertes 1 .
Alrededor del 60 por ciento de los sarcomas de tejidos blandos surgen en las extremidades y la mayoría de ellos en el muslo. También ocurre en la pared torácica y el retroperitoneo. Por orden de frecuencia, los sarcomas de tejidos blandos aparecen en miembro inferior (46%), espalda (18%), miembro superior (13%), retroperitoneo (13%) y cabeza y cuello (9%) 1 .
Clasificación:
La Organización Mundial de la Salud (OMS) clasifica los sarcomas de tejidos blandos según el subtipo histológico al que se asemeja la neoplasia, como liposarcoma, sarcoma sinovial, rabdomiosarcoma, etc. 1
En algunos casos, la histología es incierta y el aspecto morfológico se utiliza para clasificarlos como sarcoma alveolar o sarcoma de células claras.
Los sarcomas de tejidos blandos más frecuentes en adultos son: indiferenciados, liposarcoma, sarcoma sinovial, leiomiosarcoma y tumor maligno de la vaina del nervio periférico, el cual se incluye en este capítulo, a pesar de tener origen en el ectodermo, ya que presenta comportamiento biológico, tratamiento y pronóstico similar. a sarcomas de tejidos blandos 1,2 .
El grado histológico también se utiliza para clasificar los sarcomas de tejidos blandos, dividiéndose clásicamente en Grado 1 , bien diferenciados y con bajo grado de malignidad histológica; Grado 2 , moderadamente diferenciado y Grado 3 , poco diferenciado con alto grado de malignidad 1 .
Cuadro clínico:
El cuadro clínico inicial es palpable como tumoración abultada, muchas veces indolora, con crecimiento progresivo que puede alcanzar un tamaño considerable, especialmente en el muslo.
Algunos pacientes pueden llegar a experimentar dolor y parestesia debido al efecto compresivo del tumor. Son clínicamente eutróficos en la mayoría de los casos, siendo síntomas excepcionales la fiebre o la pérdida de peso.
Los sarcomas de tejidos blandos tienden a crecer entre músculos adyacentes, empujando y comprimiendo las estructuras circundantes, y rara vez se extienden más allá de los compartimentos anatómicos. La velocidad de crecimiento varía entre los subtipos histológicos.
No existen criterios clínicos absolutos para diferenciar los tumores de tejidos blandos benignos de los malignos. Sin embargo, todos los tumores profundos, es decir, por debajo del plano de la fascia muscular, y los tumores superficiales mayores de 5 cm, tienen una alta probabilidad de ser malignos 2 .
Puesta en escena:
En el momento del diagnóstico, el sarcoma de tejido blando rara vez metastatiza y no supera el 10 por ciento de los casos. Esto ocurre con mayor frecuencia en tumores de gran volumen, profundos a la fascia muscular y de alto grado 2 .
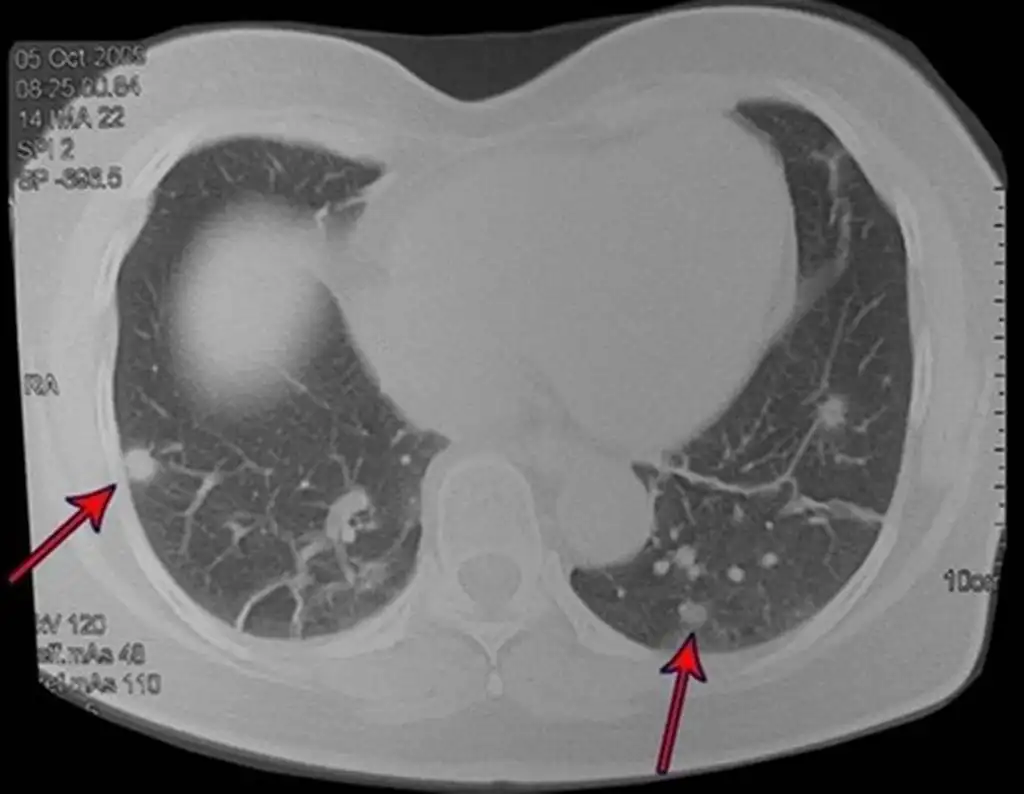
El patrón de diseminación de la mayoría de los sarcomas es hematógeno y el sitio principal de metástasis es el pulmón. Por este motivo, a todos los pacientes con sarcoma de tejidos blandos se les debe realizar una estadificación torácica. Siempre debe estar indicada la tomografía de tórax para buscar metástasis pulmonares, especialmente en pacientes de alto riesgo, como lesiones superficiales mayores a 5 cm, tumores profundos y aquellos con alto grado de malignidad.
Los ganglios linfáticos regionales son sitio de metástasis en el 2,6% de los casos, sin embargo, en algunos subtipos histológicos estas pueden ser más frecuentes y deben ser investigadas, como rabdomiosarcoma, sarcoma sinovial, sarcoma epitelioide, sarcoma de células claras y angiosarcoma 2 .
Se recomienda la tomografía del abdomen y la pelvis, especialmente en la estadificación del sarcoma de células redondas de tejido blando y del liposarcoma mixoide, debido a la alta tasa de metástasis extrapulmonares al abdomen y al retroperitoneo. En el caso del angiosarcoma, la evaluación del sistema nervioso central, mediante tomografía de cráneo, es necesaria debido a la propensión a metástasis al cerebro.
Exámenes de imágenes:
a) Radiografía:
La radiografía es la prueba de imagen más barata y accesible. Puede utilizarse como primera línea de evaluación tumoral, para diferenciar un tumor de origen esquelético de un sarcoma de tejidos blandos. Además, puede presentar calcificaciones en su interior.
b) Resonancia magnética:
La resonancia magnética sigue siendo la prueba de elección para evaluar sarcomas de tejidos blandos cuando no existen elementos metálicos, como una prótesis ortopédica. Puede detallar los límites del tumor y su relación con las estructuras vecinas. El uso de contraste también puede diferenciar lesiones sólidas de lesiones llenas de líquido, por lo que se debe solicitar la exploración con contraste.
c) Tomografía:
La tomografía es el examen de elección en tumores retroperitoneales y en la búsqueda de metástasis pulmonares, ya que la resonancia no es adecuada por el movimiento respiratorio y el peristaltismo intestinal. En el estudio del MTS de las extremidades, la resonancia es superior para delimitar la extensión neoplásica 2 .
d) Pet-Cet:
La tomografía por emisión de positrones con flúor desoxiglucosa (FDG-PET/CT) permite, con alta sensibilidad, diferenciar el sarcoma de tejido blando de alto grado de los tumores benignos de tejido blando. Sin embargo, pierde valor para diferenciar entre tumores de bajo grado y de bajo grado. 2 .
La FDG-PET/CET no debe utilizarse de forma rutinaria en la evaluación inicial de un paciente con tumor tisular, sin embargo su uso está indicado para determinar el pronóstico y la respuesta al tratamiento de quimioterapia 2 , 3 .
El valor de absorción estándar (SUV) es una cuantificación de la glucosa marcada con flúor consumida por el tumor y demuestra el metabolismo del tumor. El sarcoma de tejidos blandos con SUV igual o superior a 6, que después de la quimioterapia muestra una reducción de este valor inferior al 40 por ciento, presenta mayor riesgo de recurrencia sistémica de la enfermedad 2 .
e) Gammagrafía:
La gammagrafía ósea no siempre se realiza en la estadificación inicial del sarcoma de tejidos blandos, ya que las metástasis óseas en adultos son poco frecuentes en la etapa inicial de la enfermedad. La excepción son los tumores de células redondas y el liposarcoma mixoide, pero el mapeo esquelético puede ser falso negativo y se recomienda la evaluación mediante resonancia magnética 2 .
Biopsia:
La biopsia está indicada para el diagnóstico histológico del SMT, ya que las pruebas de imagen no presentan características sugestivas del subtipo histológico, como podemos inferir en algunas neoplasias óseas, como el osteosarcoma.
No siempre es necesaria una biopsia para el tratamiento, ya que el tratamiento del MTS sigue siendo principalmente quirúrgico y, en algunos casos, la biopsia puede sustituirse por una resección por escisión o también llamada biopsia por escisión.
Los tumores superficiales, por encima de la fascia muscular, menores de 5 cm, tienen baja probabilidad de ser malignos. En estos casos se pueden resecar sin diagnóstico histológico si se someten a cirugía oncológica (resección amplia con margen oncológico, sin comprometer las estructuras nobles circundantes) , ya que este sería el tratamiento correcto en el caso de que estemos ante una alta -grado de sarcoma de tejidos blandos de calidad.
La biopsia debe ser realizada por el cirujano que realizará el tratamiento definitivo o ser guiada por él. El trayecto de la biopsia debe estar alineado con la incisión que se utilizará para la resección y todo este trayecto de la biopsia debe extirparse en bloque, junto con el tumor.
La biopsia incisional, realizada a través de una incisión quirúrgica, exponiendo parte del tumor, fue la más utilizada para el diagnóstico del sarcoma de tejidos blandos. Actualmente, las biopsias percutáneas han ganado terreno con el desarrollo de agujas adecuadas, como la Trucut®, y métodos de imagen como la ecografía y la tomografía para guiarlas.
Patología:
El patólogo siempre debe estar presente para realizar el examen de la sección congelada, con el fin de confirmar y asegurar que el material recolectado sea representativo de la lesión, evitando la necesidad de repetir el procedimiento. El resultado histológico definitivo debe esperar la histología con parafina y posiblemente la inmunohistoquímica.
La biopsia percutánea con aguja, realizada con estas precauciones, generalmente permite diferenciar los tumores malignos de los benignos y los patólogos experimentados son capaces de determinar correctamente el grado histológico de los tumores en un 97,6 y 86,3 por ciento respectivamente, además de que esta técnica provoca una menor diseminación local. del tumor durante el procedimiento 3 .
Sarcoma de tejidos blandos – Tratamiento:
El tratamiento de los tumores de tejidos blandos es generalmente quirúrgico, sin embargo, como ocurre con la mayoría de las neoplasias, el seguimiento de los pacientes con cáncer debe ser siempre multidisciplinario.
Desde el diagnóstico hasta la estadificación y el tratamiento, en el manejo del caso interactúa un equipo de varios profesionales, como el ortopedista que realizará la cirugía oncológica , el patólogo, el radiólogo, el oncólogo clínico, el radioterapeuta, el psicólogo, el trabajador social, etc. .
El objetivo del tratamiento es preservar la vida del paciente, evitando la recurrencia local, maximizando la función del miembro afectado y minimizando la morbilidad del tratamiento.
Quimioterapia:
Los sarcomas de tejidos blandos, en la población pediátrica, responden a la quimioterapia sistémica presentando una mayor respuesta a los fármacos, proporcionando una mejora en la supervivencia, ya que el niño es capaz de soportar las dosis de quimioterapia necesarias para controlar la enfermedad, a diferencia de los adultos.
En los niños, los sarcomas de tejidos blandos más comunes son el rabdomiosarcoma, la forma extraósea del osteosarcoma y la forma extraósea del sarcoma de Ewing. Todos ellos con protocolos de quimioterapia neoadyuvante y adyuvante.
En los raros casos de que estas neoplasias se presenten en adultos, se opta por el protocolo de quimioterapia pediátrica, en dosis compatibles con los adultos y sus posibles comorbilidades.
En los sarcomas de tejidos blandos del adulto existe una gran controversia respecto al uso de la quimioterapia. El metaanálisis publicado en 1997 por la colaboración Sarcoma Meta-analysis mostró que el uso de doxorrubicina en estos pacientes aumentó el tiempo libre de recurrencia local y metástasis a distancia, pero no hubo beneficio estadísticamente significativo en la supervivencia global de los pacientes 3 .
En 2008 se publicó un nuevo metanálisis actualizado que demuestra que el uso de doxorrubicina asociada a ifosfamida promovió una mejora en la supervivencia de los pacientes 3 . Sin embargo, la quimioterapia es extremadamente tóxica, especialmente en la población adulta donde la presencia de comorbilidades clínicas puede hacer inviable un tratamiento eficaz. La recomendación actual es individualizar cada caso, recordando que el tratamiento sistémico no corrige una resección quirúrgica inadecuada.
En general, los MTS adultos responden mal a la quimioterapia. Por tanto, el tratamiento se basa en la resección quirúrgica.
Cirugía oncológica:
La cirugía de resección del sarcoma de tejidos blandos debe realizarse con márgenes amplios, de modo que todo el tumor sea extirpado en bloque y cubierto por tejido sano, con el objetivo de garantizar que no queden células neoplásicas residuales después de la resección.
Los sarcomas de tejidos blandos tienen una pseudocápsula circundante. Esta estructura está representada por un proceso inflamatorio producido por la agresión tumoral y no siempre es una barrera suficiente para las células neoplásicas, que permean los tejidos circundantes. La radioterapia adyuvante puede estar indicada para actuar sobre los márgenes cuando estos deben ser pequeños, debido a la necesidad de preservar estructuras nobles, como vasos y nervios.
La resección del tumor a través de la pseudocápsula puede dejar tejido neoplásico microscópico en el paciente y puede ser un factor de riesgo de recurrencia local y peor pronóstico.
Los sarcomas de tejido blando tienden a crecer expandiéndose y empujando el tejido circundante, pero rara vez infiltrándolo. Por tanto, la invasión del hueso o de los tejidos musculares adyacentes es poco común.
La mayoría de las veces cuando el tumor se acerca al hueso es posible disecarlo extirpando el periostio que rodea el hueso en cuestión, junto con el tumor. Esta desperiostización asociada a la radioterapia, que generalmente se utiliza como adyuvante, aumenta el riesgo de fractura, especialmente en el fémur 4 .
Reaparición:
El grosor de los amplios márgenes alrededor del tumor es cuestionable, recomendándose 1 cm, pero rara vez ocurre de forma homogénea en toda su circunferencia.
Para preservar los tejidos nobles, como grandes nervios o vasos, el cirujano eventualmente reduce este margen para evitar la resección de dicha estructura, lo que puede poner en riesgo tanto al paciente como al propio miembro para preservar la mejor función.
Por otro lado, los planos de tejido anatómico representan diferentes barreras para el tumor, como la fascia muscular, donde márgenes de 1 a 2 milímetros pueden ser adecuados para una resección segura.
Otros tejidos como la grasa o el músculo del vientre requieren márgenes más amplios.
Los nervios grandes se pueden conservar diseccionando y eliminando la vaina nerviosa externa como margen, ya que los sarcomas de tejido blando no suelen infiltrar los nervios. Cuando el tumor rodea al nervio existe mayor dificultad técnica y es posible que sea necesario seccionar y reconstruir este nervio con suturas microquirúrgicas.
Los injertos nerviosos para la reconstrucción rara vez son útiles en las extremidades inferiores de los adultos, especialmente en un sitio que será necesario irradiar. Los niños, sin embargo, pueden tener mejores resultados.
Generalmente se evita la cirugía ablativa, ya que incluso una función limitada de la extremidad inferior puede ser viable, incluso en casos que requieren una resección completa del nervio ciático.
Radioterapia:
El uso de radioterapia adyuvante promueve la destrucción de las células tumorales alrededor de la lesión principal. Cuando se asocia con resección quirúrgica que preserva la extremidad, promueve un mayor control local, minimizando la recurrencia entre un 10 y un 15% 4 . Sin embargo, la combinación de esta modalidad terapéutica no aumenta la supervivencia global.
La radioterapia está indicada para casi todos los casos de sarcoma de tejidos blandos.
La resección quirúrgica exclusiva puede ser suficiente en casos de tumores superficiales de bajo grado o de pequeño volumen, totalmente intramusculares, siempre y cuando se garanticen amplios márgenes en la cirugía oncológica realizada.
Con la mejora del control local, la radioterapia como adyuvante en los sarcomas de tejidos blandos ha reducido la tasa de amputación de extremidades del 50% en los años 1970 al 1% actual, sin comprometer la supervivencia 5 .
La indicación de amputación en presencia de MTS puede ser necesaria en tumores excesivamente extensos, de modo que el muñón no tenga función.
Un ejemplo es la necesidad de resecar un tronco nervioso principal, como es el plexo braquial, ante la imposibilidad de obtener márgenes amplios. En este caso, la pérdida de sensibilidad da como resultado una extremidad restante inviable.
La afectación de grandes vasos por el tumor ya era indicación de amputación en el pasado, sin embargo con la técnica de reconstrucción vascular se hizo posible resecar el tumor en bloque con los vasos y reconstruirlos con un injerto vascular, permitiendo una extremidad viable.
Márgenes quirúrgicos:
La principal variable en el control local de la enfermedad son los márgenes quirúrgicos de resección del tumor 5 .
La presencia de márgenes coincidentes con el tumor aumenta el riesgo de recurrencia local y la recurrencia aumenta el riesgo de metástasis a distancia, lo que puede conducir a una supervivencia más corta.
La presencia de márgenes comprometidos, sin embargo, no representa certeza de recurrencia local, ya que sólo el 30 por ciento de los casos sometidos a resección incompleta y sometidos a radioterapia adyuvante sufrieron recurrencia.
Por otra parte, márgenes amplios tampoco son garantía de control local, ya que, incluso cuando se asocia con radioterapia, la recurrencia en esta situación ronda entre el 5 y el 10 por ciento.
La presencia de márgenes positivos en la resección puede requerir un nuevo abordaje del lecho quirúrgico, buscando ampliar los márgenes previamente obtenidos.
Este nuevo abordaje dependerá del análisis de qué estructura anatómica será necesario resecar para esta expansión.
En los centros de referencia en cirugía oncológica, la presencia de márgenes comprometidos suele estar relacionada con un posible tumor residual en grandes haces nerviosos que requeriría amputación para su resección. Si este es el caso, se puede utilizar una dosis más alta de radioterapia (66-68 Gy) o optar por la amputación como último recurso.
Tumores benignos de tejidos blandos:
Los tumores benignos de tejidos blandos son cien veces más frecuentes que los tumores malignos. Entre ellos, el lipoma subcutáneo se encuentra entre los más diagnosticados en la práctica clínica.
Estas lesiones no causan dolor y se diagnostican cuando son superficiales y protruyen en la piel o cuando son profundas y alcanzan un gran volumen. La excepción es el schwannoma que surge de un nervio periférico y puede presentar dolor, parestesia y, con menos frecuencia, cambios motores.
Aunque son benignos, con el crecimiento de estos tumores se puede producir la compresión de estructuras adyacentes y sólo entonces aparecerán los síntomas.
El tratamiento de la mayoría de los tumores benignos de tejidos blandos depende de los síntomas que eventualmente produzcan. Como la mayoría de ellos son asintomáticos, la resección quirúrgica está indicada cuando aumentan de tamaño, provocando molestias o cambios estéticos.
En tumores superficiales, de pequeño tamaño, asintomáticos y sin signos sugestivos de malignidad en los exámenes de imagen, se puede optar por observar la evolución clínica.
El tumor desmoide, a pesar de ser benigno, es una neoplasia de tejidos blandos localmente agresiva, que produce síntomas atacando los tejidos vecinos.
A diferencia de la mayoría de las neoplasias benignas de tejidos blandos, la resección desmoide debe estar indicada con márgenes amplios, una cirugía oncológica similar al tratamiento de los tumores malignos.
El tumor desmoide es muy recurrente, incluso después de una resección adecuada. En algunos casos, el paciente puede requerir la amputación de la extremidad debido a numerosas recurrencias, o cuando experimenta dolor o disfunción intratable y una nueva resección se vuelve imposible.
Discusión:
- ¿Una consideración es realizar una biopsia previa o biopsia escisional ( resección por biopsia ) en casos de sarcomas de tejidos blandos superficiales, pequeños, o en lugares donde es posible la cirugía oncológica, con márgenes amplios en toda la circunferencia del tumor?
- Otra consideración es respecto de los sarcomas de tejidos blandos en adultos, en los que la quimioterapia neoadyuvante no mejora localmente ni interfiere con la supervivencia. Existe controversia sobre el uso de la radioterapia neoadyuvante:
- A) Radioterapia + cirugía + radioterapia o
- B) ¿Cirugía + radioterapia?
La Tabla 2 a continuación resume los parámetros que debemos considerar.

Para definir la cirugía oncológica , debemos analizar la relación entre el tumor y la piel, las aponeurosis, los vasos y los nervios. También es necesario definir si es necesaria o no una biopsia previa o la posibilidad de realizar una resección biopsia, extirpando la lesión en un solo paso, siempre y cuando sea posible operarla con un margen oncológico sin comprometer la función.
Para ello, los estudios de imagen definirán esta posibilidad en tumores suficientemente alejados de estructuras nobles.
La posibilidad de resección sin biopsia es ventajosa ya que facilita la cirugía y evita la necesidad de repetir biopsias con muestras tumorales inapropiadas y revisar cirugías realizadas con diagnósticos inadecuados.
Muchos sarcomas de tejidos blandos son intervenidos inicialmente como tumores benignos ( incluso tras un estudio anatomopatológico de la biopsia, que no es más que una muestra de la lesión ), pero en realidad eran neoplasias malignas, que luego se diagnosticaban con un estudio completo de la cirugía. material que fue resecado.
Discutiremos la definición de tratamiento discutiendo los siguientes casos:
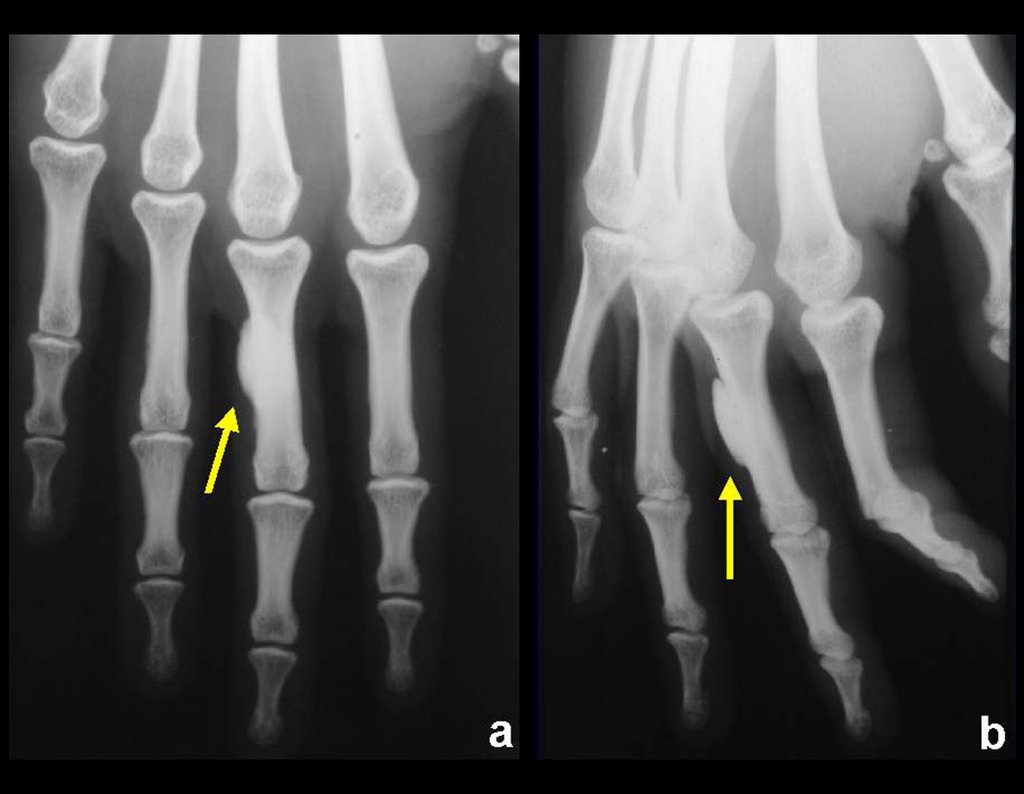
Caso 1 – Tumor de partes blandas del hombro , figura 1.
¿Qué abordaje quirúrgico se recomendará? ¿Biopsia previa? ¿Solo resección quirúrgica? En este caso, se realizó una biopsia antes de la cirugía.
El primer diagnóstico de esta muestra de biopsia fue sarcoma de células fusiformes indeterminado.
La revisión anatomopatológica realizada por otros patólogos de Brasil y Estados Unidos informó: “… sarcoma de células fusiformes no clasificado, de grado intermedio, con alguna posibilidad de que sea liposarcoma desdiferenciado …”
La cirugía oncológica debe realizarse con un margen de seguridad. Este caso debe ser intervenido como neoplasia maligna, al tratarse de una lesión heterogénea.
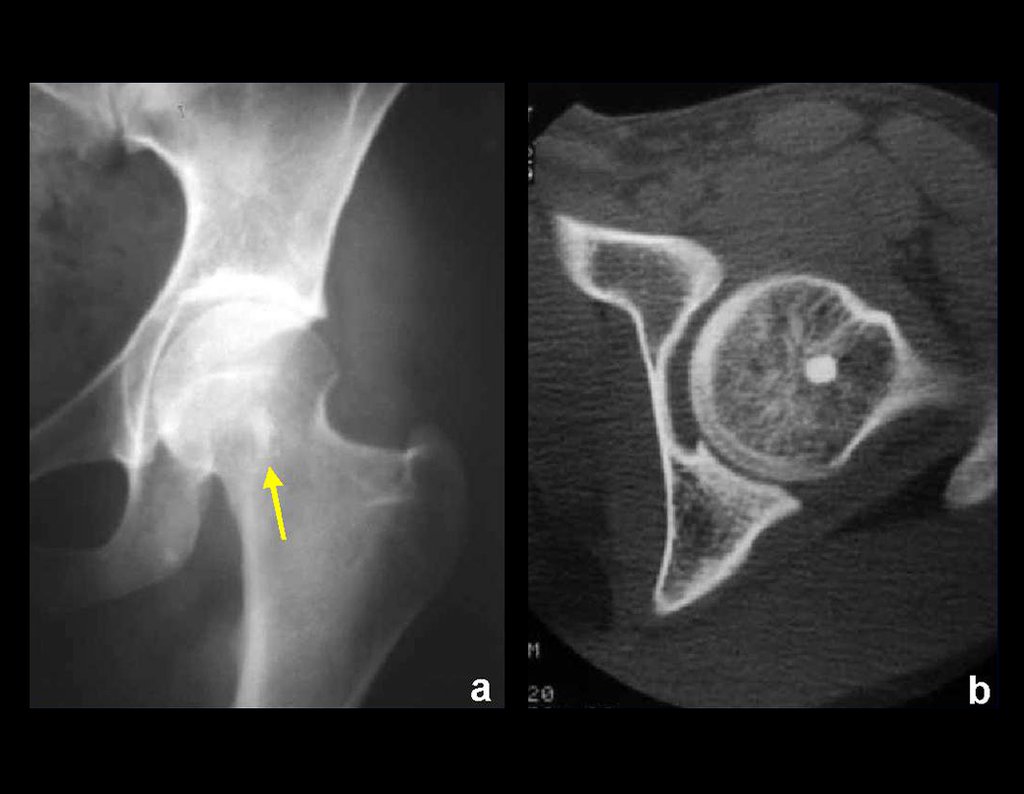
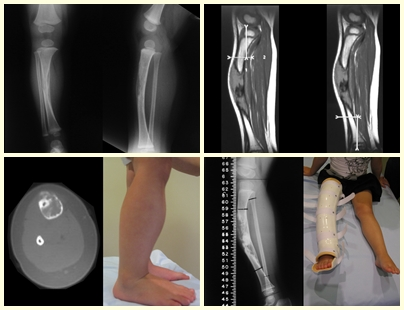
Caso 2 – Sarcoma de tejido blando de alto grado de miembro inferior , figuras 2 a 4.
¿Cuál es el tratamiento para esta lesión en la región anterior del muslo?
Esta lesión es ciertamente una neoplasia maligna de tejidos blandos.
Aunque de la biopsia se infiera que se trata de una lesión benigna, el abordaje quirúrgico necesariamente debe realizarse con la técnica indicada para neoplasias malignas, una cirugía oncológica, debido a la heterogeneidad de la lesión.
La biopsia es sólo una muestra del tumor y puede obtener material de una zona benigna y no ayudar en nada. El procedimiento en estos casos debe ser realizado por un ortopedista especializado en oncocirugía, para realizar la biopsia durante la futura cirugía. Se realizó biopsia, figura 3.
Este tipo de lesión debe resecarse con el mayor margen posible. En este caso sabemos que los límites serán ajustados.
Sin embargo, no existe indicación para la cirugía ablativa, ya que la amputación no mejora la supervivencia.
- ¿ Quimioterapia neoadyuvante ? Baja probabilidad de respuesta. Retrasa la cirugía y, a medida que aumenta la lesión, disminuye la posibilidad de conservar la extremidad.
- ¿ Radioterapia neoadyuvante ? Fibrosis intensa con mayor dificultad para liberar vasos y nervios y complicaciones con la herida quirúrgica.
Dado que tanto la quimioterapia como/o la radioterapia neoadyuvante no modifican el pronóstico de supervivencia, no recomendamos el tratamiento neoadyuvante en estos casos y realizar primero la cirugía, mediante un abordaje dual.
Primer acceso medial, para aislamiento seguro del haz vascular y nervioso, liberación medial del periostio y posterior acceso lateral, complementando el control local con radioterapia adyuvante, figura 4.

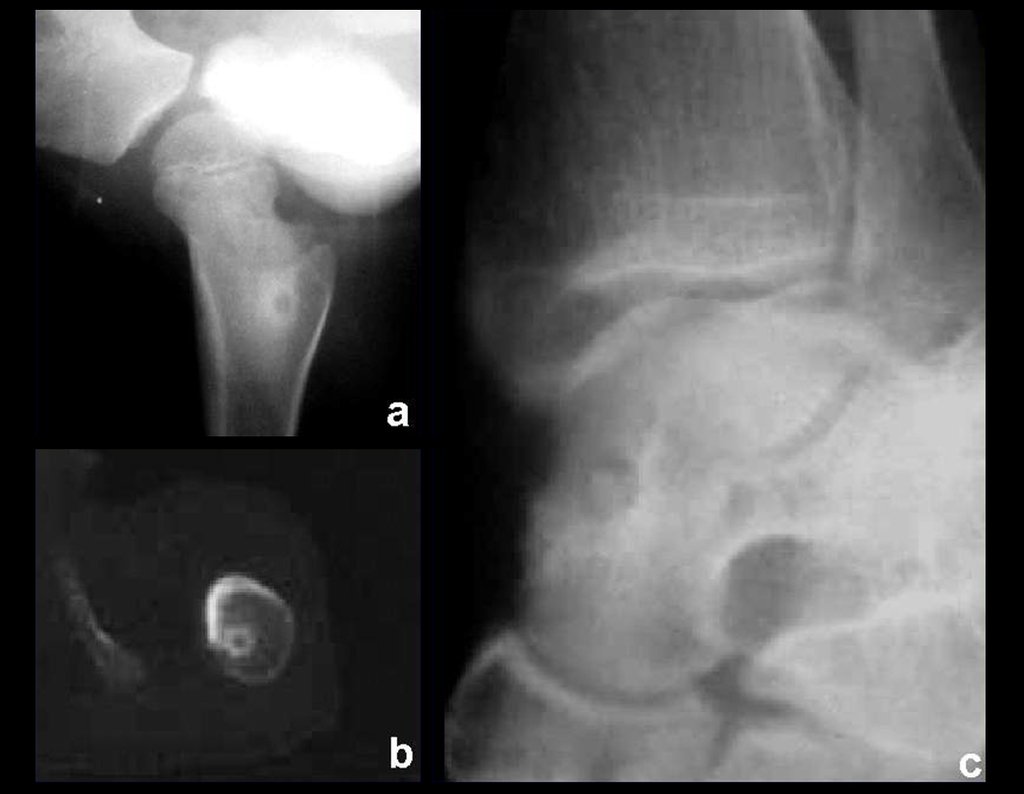
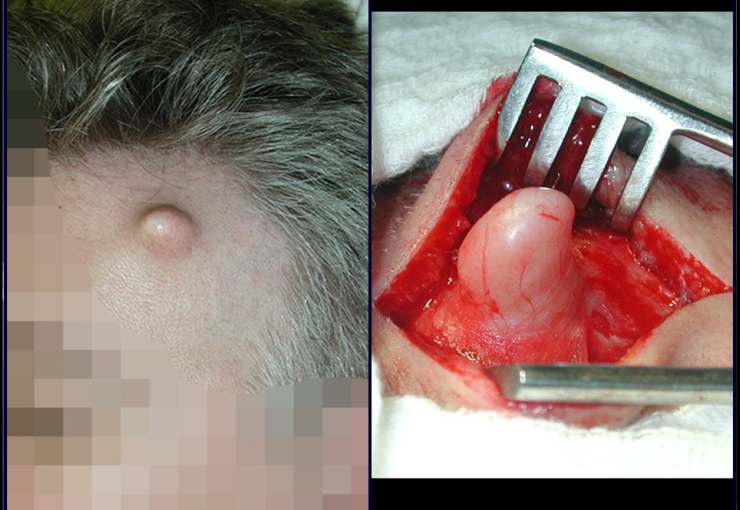
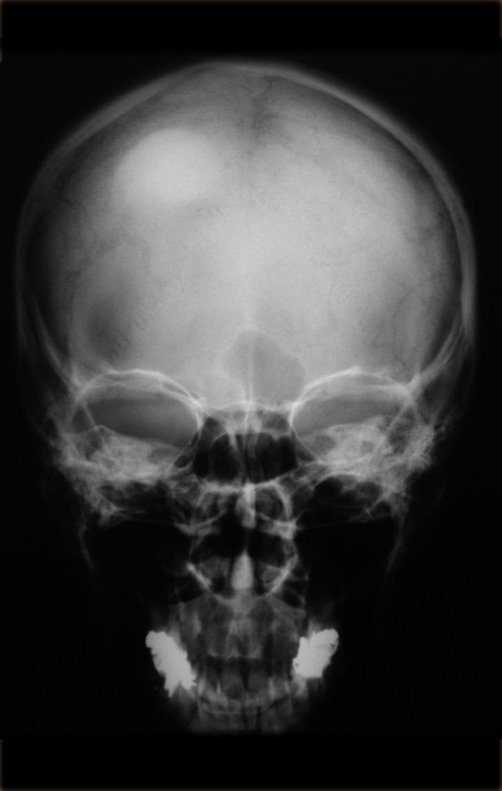
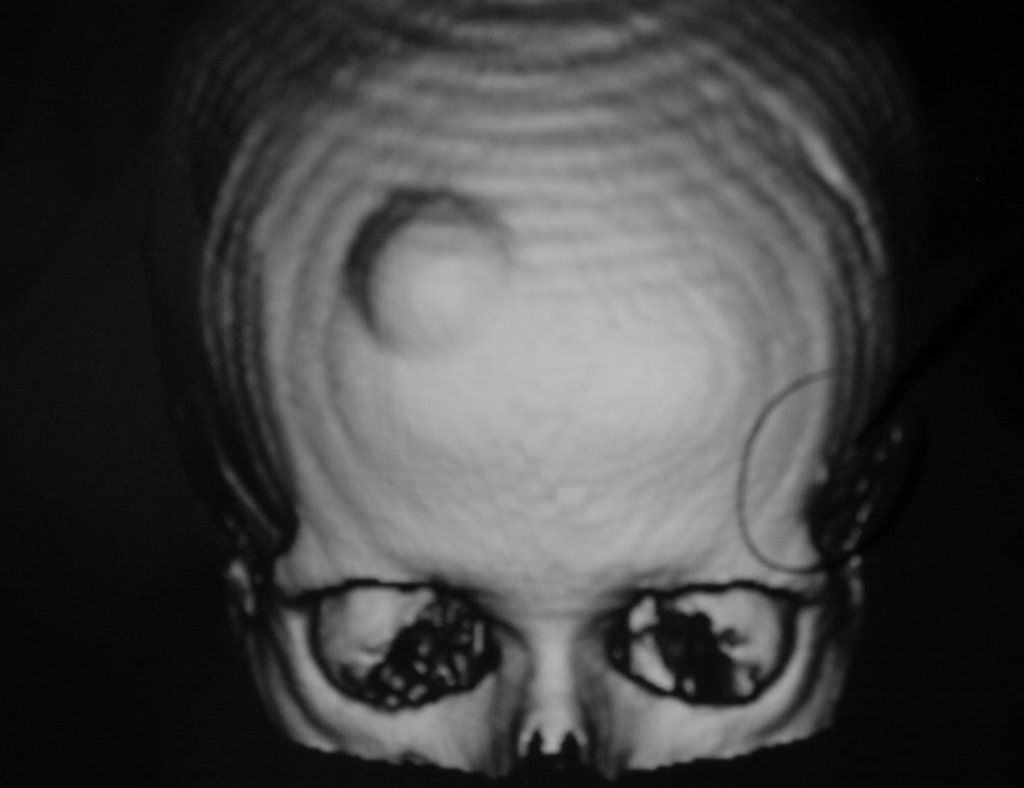
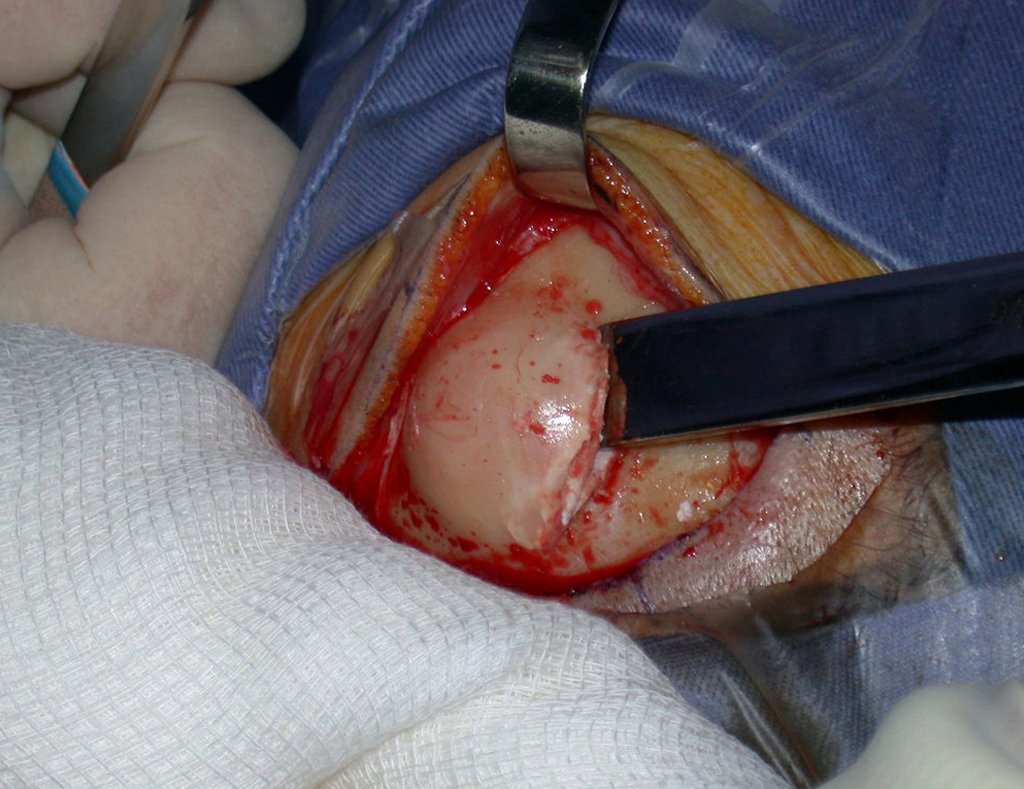
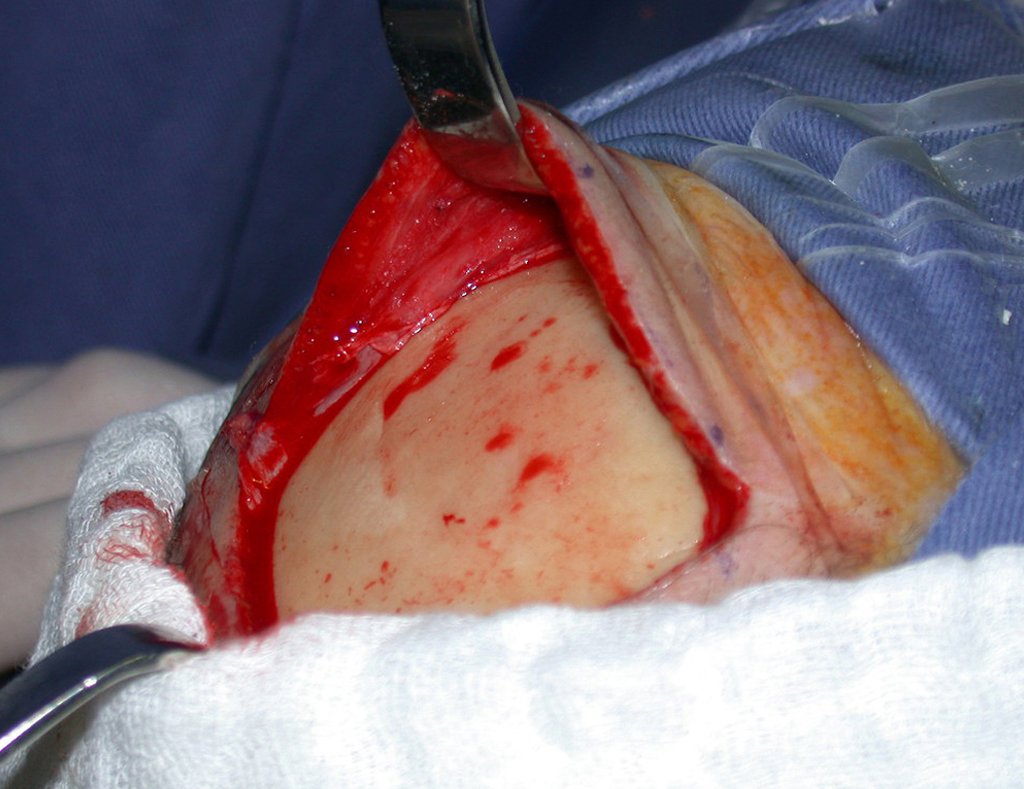
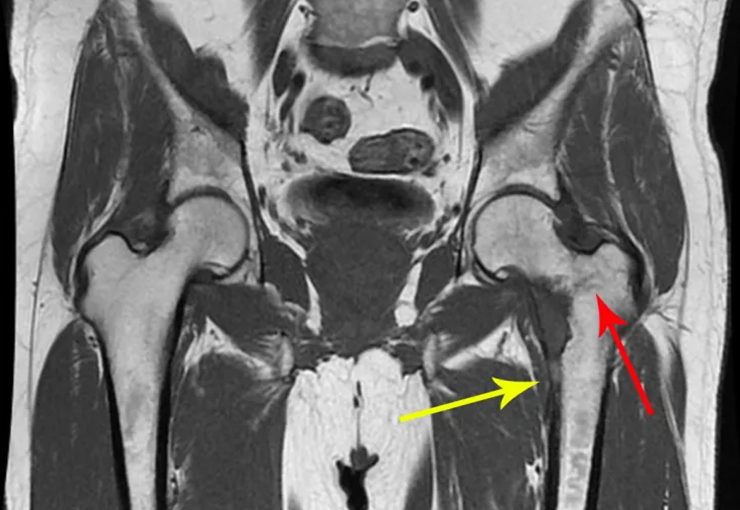
Caso 3 – STM de alto grado de la cavidad poplítea , figuras 5 a 11 y video 1.
¿Cuál es el enfoque recomendado para este caso?
La elección de la vía de biopsia debe ser determinada por la ortopedia oncológica . Se debe elegir el punto de mayor heterogeneidad, fuera de la zona de posible necrosis y a lo largo del trayecto de la futura incisión quirúrgica.


En estos tres casos presentados comprobamos que se realizó biopsia. El manejo quirúrgico, en todos ellos, se realizó sin terapia neoadyuvante.
Por lo tanto, en la mayoría de los casos de neoplasias en las que la clínica y las pruebas de imagen sugieren malignidad y que son objeto de resección con margen oncológico, preservando tanto la estética como la función, preferimos optar por una biopsia por sección congelada, realizada durante la cirugía. con la presencia del patólogo, quien confirmó que se trataba de una neoplasia maligna y realizamos la resección por biopsia ( biopsia escisional ) , primero, como se realizó en el caso 4, que se describe a continuación.
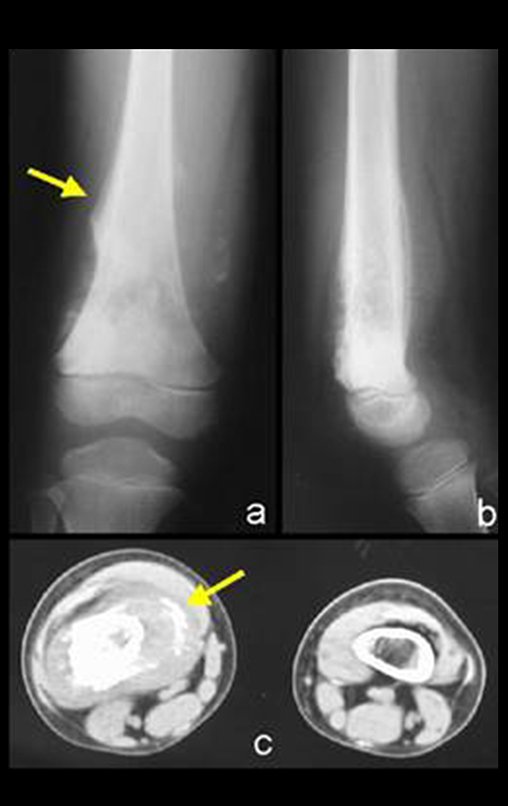
Caso 4 – EMT del muslo con metástasis al hueso del esternón , figuras 12 a 20.
Paciente atendido en el año 1997, con dolor y tumoración de rápido crecimiento en la cara medial del muslo derecho, afectando los tejidos blandos.
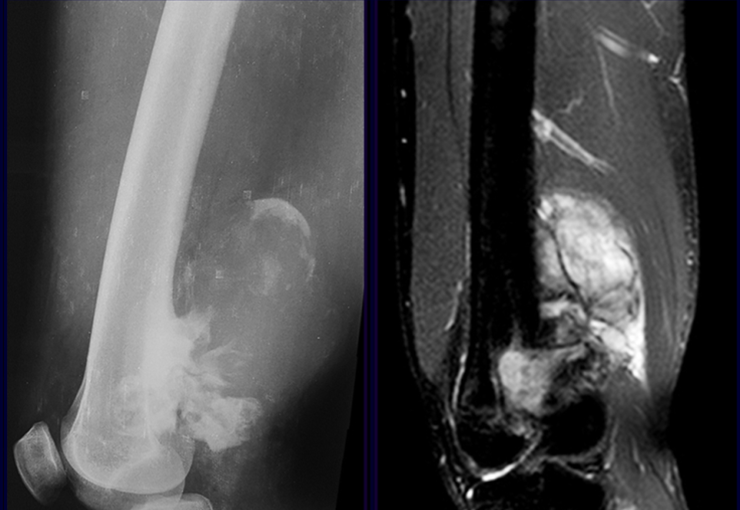
La mejor prueba de imagen para evaluar lesiones de tejidos blandos es la resonancia magnética (MRI). Este examen reveló la presencia de una lesión sólida de aproximadamente 5,5 cm por 7,0 cm, dentro de los músculos aductores del muslo, figura 12.

Con este cuadro clínico e imagenológico tenemos que responder a la siguiente pregunta:
1- ¿Realizar una biopsia, o resección por biopsia, ya que en este caso es posible extirpar la lesión con margen oncológico, sin cambiar su función?
2- Si el resultado de la biopsia reporta una lesión sin atipia, fibroxantoma por ejemplo, ¿se cambiaría la resección quirúrgica? ¿Sería más económica una resección? ¿Incluso con las características de estas imágenes, ya que la biopsia es sólo una pequeña muestra de la lesión?
Según nuestra orientación, el manejo quirúrgico no puede cambiar. En este caso la resección debe realizarse con margen oncológico. La biopsia debe realizarse con el propósito de orientar la indicación o no de terapia neoadyuvante, si se confirma que se trata de una neoplasia maligna que responde, como el rabdomiosarcoma embrionario, en el niño.
3- ¿Qué tipo de biopsia realizar? ¿Con una aguja tru-cut? ¿Incisional? ¿Con diagnóstico de sección congelada y cirugía oncológica al mismo tiempo?
Guía:
Lo mejor es realizar siempre una biopsia de las lesiones de tejidos blandos con aguja tru-cut, guiada por ecografía y anatomía patológica por corte congelado, para validar el material recogido.
El procedimiento de resección dependerá de cada caso y se puede realizar en los casos en los que sea posible el margen oncológico, sin pérdida funcional.
En caso contrario, se deberá esperar los resultados del examen anatomopatológico en parafina e incluso inmunohistoquímica, cuando sea necesario.
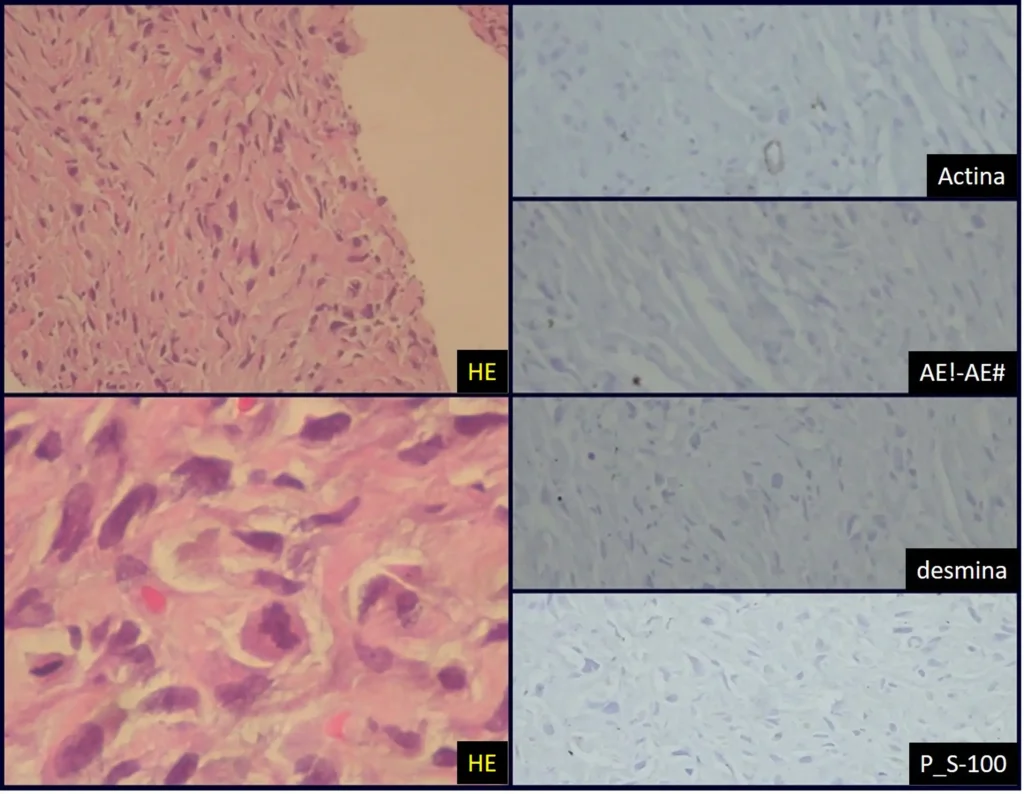
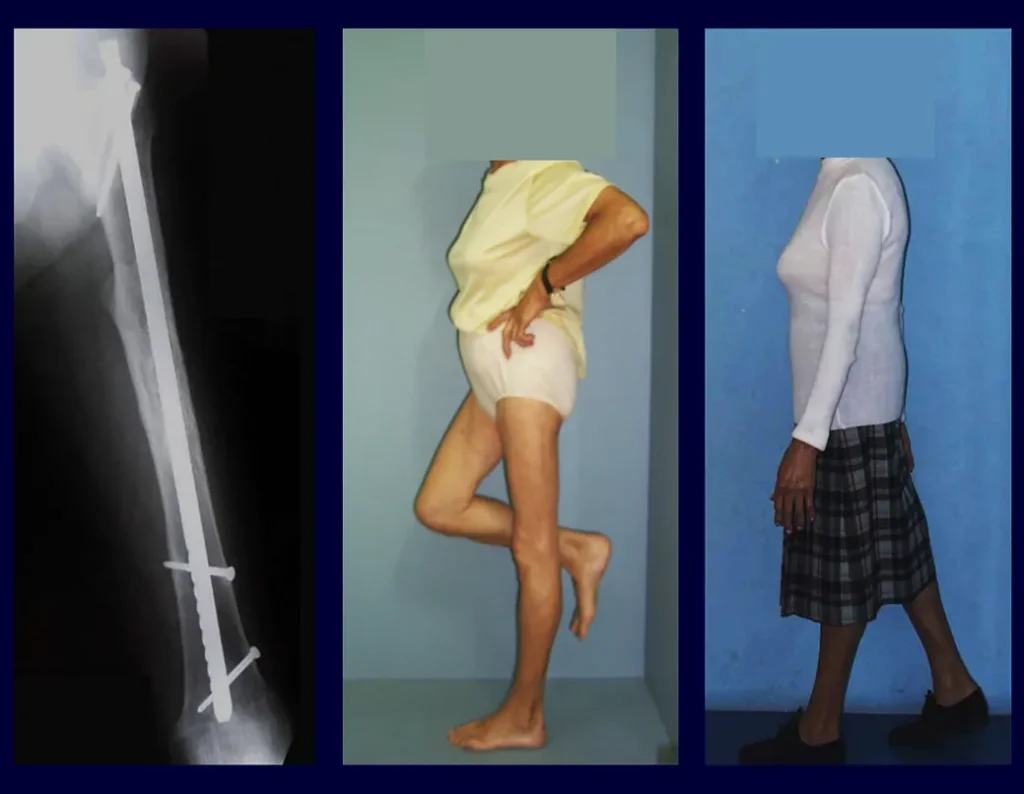
En este caso el diagnóstico fue de sarcoma de alto grado, en corte congelado y como fue posible la resección con margen se realizó la cirugía con el mismo procedimiento anestésico, figura 14, donde podemos observar el aspecto histológico anaplásico de este tumor.
En esta cirugía se inició radioterapia adyuvante, con la colocación de catéteres para braquiterapia, procedimiento todavía muy recomendado en aquel momento.
Estos catéteres se pasan a través de una aguja con un diámetro tubular suficiente para la posterior colocación de los alambres de iridio. Los catéteres se pasan y fijan con un clip de plástico, figuras 14 a y b .
Posteriormente se retiran los catéteres y se complementa con radioterapia externa. La Figura 14 c muestra el aspecto local tras el tratamiento de radioterapia adyuvante.

El caso fue discutido en un equipo multidisciplinario que optó por no realizar quimioterapia adyuvante, ya que la relación entre posibles beneficios y efectos secundarios no era favorable, teniendo en cuenta que esta quimioterapia no aumenta la supervivencia global, Lancet 1997 20 .
Evolución:
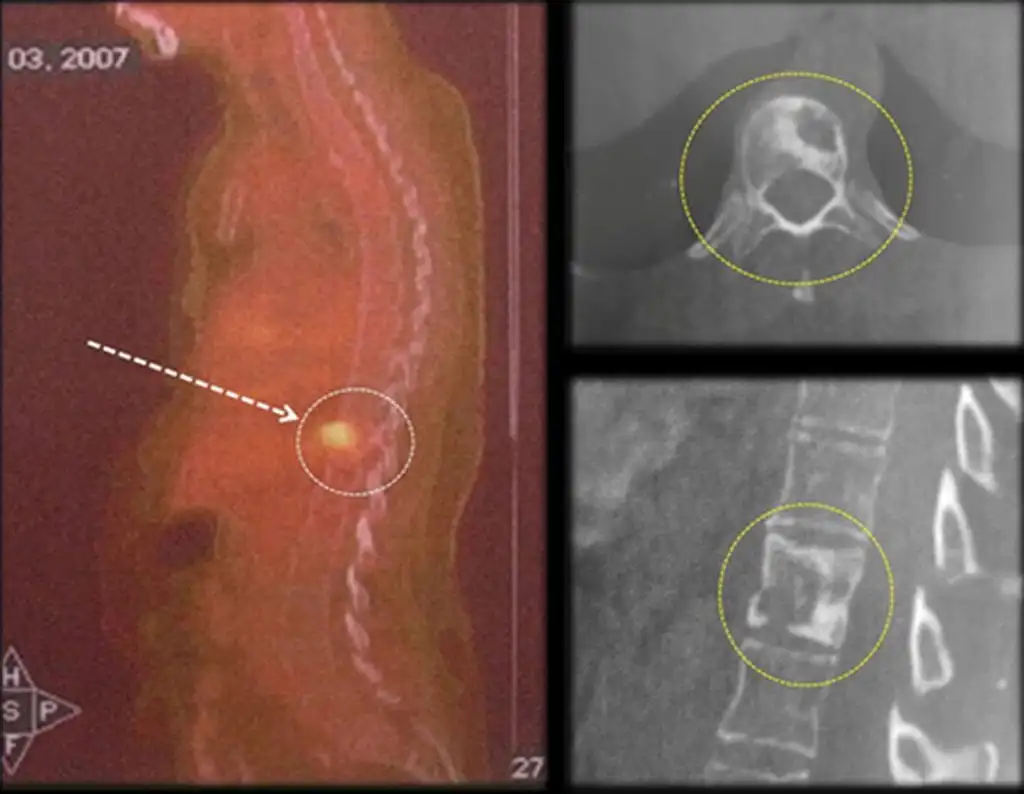
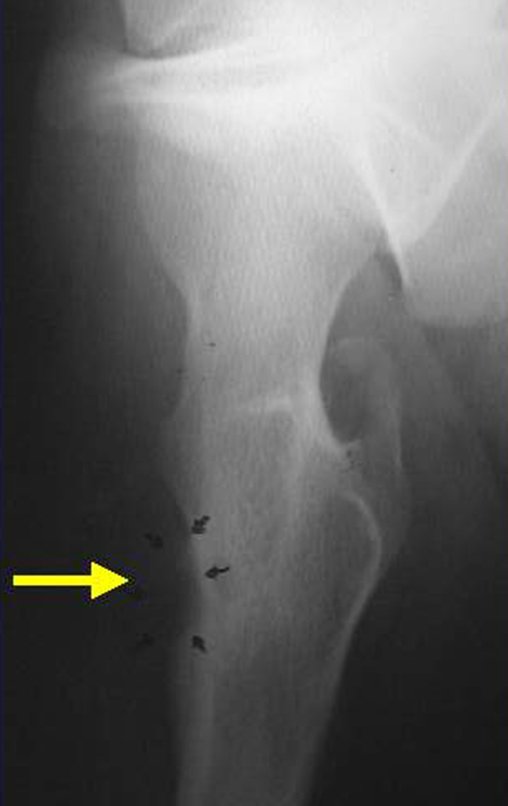
En la evaluación de control, después de cuatro años y tres meses, el paciente refirió abultamiento y dolor en el esternón. La radiografía resalta la presencia de una lesión en la porción distal del esternón. Figuras 15 a y b . La gammagrafía ósea realizada para estadificación esquelética reveló una lesión única, con intensa captación en esta región.
Figura 15 : a – Radiografía de tórax, de perfil, muestra una lesión expansiva en el esternón. b- La gammagrafía muestra intensa captación en la mitad inferior del esternón.
El estudio de resonancia magnética mostró la presencia de una lesión sólida, heterogénea, con erosión cortical y destrucción del tejido óseo del esternón, con intensa captación de contraste, caracterizando un tumor agresivo, en un paciente con antecedentes de sarcoma pleomórfico de alto grado, figuras 16 a y b .
Con la historia clínica de este paciente y estas imágenes, le hicimos las siguientes preguntas:
1- ¿Realizar una biopsia de esta lesión?
2- ¿Qué debemos hacer si recibimos un diagnóstico de un tumor benigno, como un fibrohistiocitoma por ejemplo? ¿O un quiste óseo aneurismático? ¿Cuál sería el abordaje quirúrgico dada la historia de este paciente que ya había sido operado de sarcoma de alto grado? ¿Legrado? ¿Se repite la biopsia?
Debemos recordar que la biopsia es sólo una muestra, por lo que es cuestionable repetir las biopsias hasta obtener un diagnóstico de lesión maligna para este paciente.
Debemos asumir la necesidad de resección con margen de esta lesión, ya que la cirugía oncológica está indicada y la resección del esternón no provoca daño estético ni funcional.
Aún debemos considerar que la quimioterapia neoadyuvante no añadiría ninguna ventaja al caso ni la radioterapia previa cambiaría la necesidad de resección de la zona comprometida.
Conducta:
Si vamos a resecar el esternón ¿qué vía de acceso debemos utilizar? ¿Cuál es la incisión que permite la resección más amplia y estética?
Se optó por la vía de acceso horizontal inframamario, figura 18.
Figura 17 : a – Radiografía que muestra la lesión. b – Incisión realizada en la región inframamaria. c – Resección del esternón. d – Imagen del lugar de resección del esternón.
Podemos observar la buena hemostasia alcanzada, la cual se debe tener cuidado para eliminar la necesidad de colocación de drenajes y permitir una mejor estética.
4- ¿Cómo reconstruir esta resección? En este caso no es necesaria la prótesis de esternón ni la colocación de una placa de cemento rígida, que, con la movilidad respiratoria, puede provocar deformidad y dolor. No se necesita una estructura rígida, no se produce hundimiento del pecho.
Este caso fue discutido nuevamente en una reunión multidisciplinaria.
La radioterapia postoperatoria no estuvo indicada tras el tipo de resección en bloque en este caso, en esta localización.
La revisión de la literatura en ese momento no indicó el beneficio de la quimioterapia versus la toxicidad y la evidencia de supervivencia general fue igual, Cancer 2008 10 . El paciente no recibió tratamiento adyuvante.
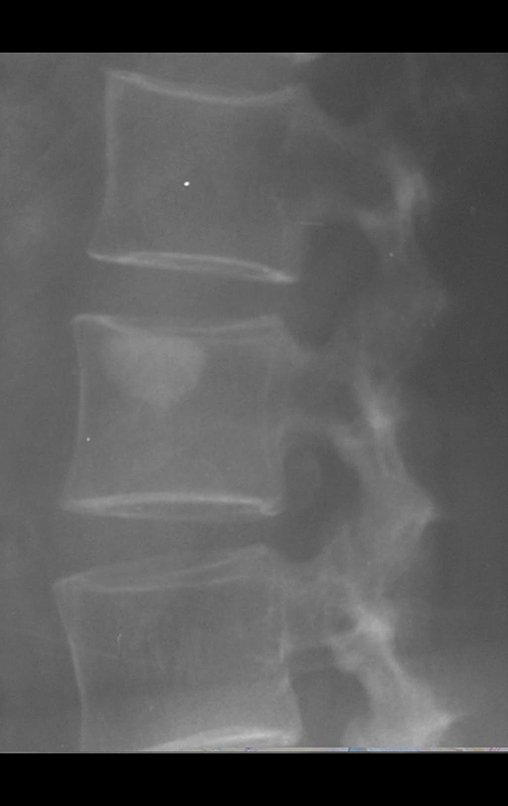
Luego de siete años y ocho meses de tratamiento del tumor del muslo y otros cuatro años y dos meses de resección del esternón, el paciente presentó metástasis en la vértebra torácica, T11, figura 19.
La paciente recibió quimioterapia paliativa adyuvante y después de dos años la lesión se extendió, falleciendo por metástasis pulmonares, figura 20.
Comentarios:
Un estudio aleatorizado realizado en 2012 sobre quimioterapia adyuvante con doxorrubicina e ifosfamida no mostró ningún beneficio en la supervivencia libre de recaídas ni en la supervivencia global, Lancet 28 .
En la literatura de 2013, UpToDate 29 todavía informaba que los beneficios de la quimioterapia neoadyuvante y adyuvante eran inciertos .
La quimioterapia para el sarcoma de tejidos blandos aún necesita evolucionar mucho. Es necesario individualizar el tratamiento farmacológico para cada histología particular.
No es posible meter todos los diagnósticos histológicos de “Sarcoma de Tejidos Blandos” en un mismo paquete y tratar con el mismo protocolo y, además, realizar un “trabajo científico” con conclusiones pronósticas, sin particularizar cada diagnóstico.
La gran mayoría de los tratamientos MTS no están individualizados. Sabemos que la quimioterapia para el sarcoma de Ewing es diferente a la quimioterapia para el osteosarcoma, por lo que tenemos resultados favorables en el tratamiento de estas afecciones.
Por lo tanto, un gran conjunto de sarcomas no puede incluirse en el mismo protocolo de tratamiento, del mismo modo que el trabajo sobre los resultados del tratamiento de este conjunto de tumores no permite sacar conclusiones.
Los casos que responden se mezclan con la mayoría que no responde y el oncólogo se queda sin parámetros.
En los adultos, la toxicidad se ve agravada aún más por las comorbilidades y la relación costo/beneficio hasta la fecha ha sido desfavorable.
La cirugía sigue siendo el tratamiento principal para los sarcomas de tejidos blandos.
La radioterapia tiene su papel en el control de los sarcomas de alto grado, pero no rescata una resección inadecuada. La radioterapia neoadyuvante tiene menos complicaciones para la herida quirúrgica que la braquiterapia. La radioterapia adyuvante se recomienda prácticamente en todos los casos, con excepciones puntuales en lesiones superficiales, tumores resecables menores de cinco centímetros y lesiones de bajo grado histológico.
____________________________
Bibliografía
- Miller RW, Young JL Jr, Novakovic B. Cáncer infantil. Cáncer 1995; 75:395.
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. Clasificación de la Organización Mundial de la Salud de tumores de tejidos blandos y óseos, 4.°, IARC Press, Lyon 2013.
- Siegel R, Ma J, Zou Z, Jemal A. Estadísticas de cáncer, 2014. CA Cancer J Clin 2014; 64:9.
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. Clasificación de la Organización Mundial de la Salud de tumores de tejidos blandos y huesos, 4.°, IARC Press, Lyon 2013. (2)
- Zagars GK, Ballo MT, Pisters PW, et al. Factores pronósticos para pacientes con sarcoma de tejido blando localizado tratados con cirugía de conservación y radioterapia: un análisis de 1225 pacientes. Cáncer 2003; 97:2530.
- Coindre JM, Terrier P, Guillou L, et al. Valor predictivo del grado para el desarrollo de metástasis en los principales tipos histológicos de sarcomas de tejidos blandos en adultos: un estudio de 1240 pacientes del Grupo de Sarcomas de la Federación Francesa de Centros Oncológicos. Cáncer 2001; 91:1914.
- Deyrup AT, Weiss SW. Clasificación de sarcomas de tejidos blandos: el desafío de proporcionar información precisa en un mundo impreciso. Histopatología 2006; 48:42.
- Lawrence W Jr, Donegan WL, Natarajan N, et al. Sarcomas de tejidos blandos en adultos. Una encuesta sobre patrones de atención del Colegio Americano de Cirujanos. Ann Surg 1987; 205:349.
- NCCN (2011). Guías de práctica clínica de la NCCN en oncología: sarcoma de tejido blando, versión 2.2011. Red Nacional Integral del Cáncer Fort Washington, PA: Red Nacional Integral del Cáncer Inc. (http://www.nccn.org/professionals/physician_gls/pdf/sarcoma.pdf)
- Christie-Large M, James SL, Tiessen L, et al. Estrategia de imagen para detectar metástasis pulmonares en el momento de la presentación en pacientes con sarcomas de tejidos blandos. Eur J Cáncer 2008; 44:1841.
- Fong Y, Coit DG, Woodruff JM, Brennan MF. Metástasis en los ganglios linfáticos de sarcoma de tejidos blandos en adultos. Análisis de datos de una base de datos prospectiva de 1772 pacientes con sarcoma. Ann Surg 1993; 217:72.
- Demas BE, Heelan RT, Lane J, et al. Sarcomas de tejidos blandos de las extremidades: comparación de RM y TC para determinar la extensión de la enfermedad. AJR Am J Roentgenol 1988; 15:615.
- Bastiaannet E, Groen H, Jager PL, et al. El valor de la FDG-PET en la detección, clasificación y respuesta al tratamiento de sarcomas de tejidos blandos y óseos; una revisión sistemática y un metanálisis. Tratamiento del cáncer Rev 2004; 30:83.
- Dimitrakopoulou-Strauss A, Strauss LG, Schwarzbach M, et al. Estudios dinámicos de PET 18F-FDG en pacientes con sarcomas de tejidos blandos primarios y recurrentes: impacto en el diagnóstico y correlación con la clasificación. J Nucl Med 2001; 42:713.
- Folpe AL, Lyles RH, Sprouse JT, et al. (F-18) Tomografía por emisión de positrones con fluorodesoxiglucosa como predictor del grado patológico y otras variables pronósticas en sarcomas de huesos y tejidos blandos. Clin Cancer Res 2000; 6:1279.
- Directrices de la Red Nacional Integral del Cáncer (NCCN) www.nccn.org (consultado el 18 de mayo de 2011).
- Schuetze SM, Rubin BP, Vernon C, et al. Uso de tomografía por emisión de positrones en sarcoma de tejido blando localizado de extremidades tratado con quimioterapia neoadyuvante. Cáncer 2005; 103:339.
- Noble JL, Moskovic E, Fisher C, Judson I. Imágenes de metástasis esqueléticas en liposarcoma mixoide. Sarcoma 2010; 2010:262361.
- Strauss DC, Qureshi YA, Hayes AJ, et al. El papel de la biopsia con aguja gruesa en el diagnóstico de sospecha de tumores de tejidos blandos. J SurgOncol 2010; 102:523.
- Quimioterapia adyuvante para el sarcoma de tejido blando resecable localizado en adultos: metanálisis de datos individuales. Colaboración en metanálisis de sarcoma. Lancet. 6 de diciembre de 1997; 350 (9092): 1647-54.
- Un metanálisis sistemático de ensayos controlados aleatorios de quimioterapia adyuvante para el sarcoma de tejido blando resecable localizado. 1 de agosto de 2008; 113 (3): 573-81
- Gortzak Y, Lockwood GA, Mahendra A, et al. Predicción del riesgo patológico de fractura del fémur después del tratamiento de modalidad combinada del sarcoma de tejidos blandos del muslo. Cáncer 2010; 116:1553.
- Rosenberg SA, Tepper J, Glatstein E, et al. El tratamiento de los sarcomas de tejidos blandos de las extremidades: evaluaciones prospectivas aleatorias de (1) cirugía para conservar la extremidad más radioterapia en comparación con la amputación y (2) el papel de la quimioterapia adyuvante. Ann Surg 1982; 196:305.
- Canter RJ, Beal S, Borys D, et al. Interacción del subtipo histológico y el grado histológico en la predicción de la supervivencia de los sarcomas de tejidos blandos. J Am CollSurg 2010; 210:191.
- Zagars GK, Ballo MT, Pisters PW, et al. Factores pronósticos para pacientes con sarcoma de tejido blando localizado tratados con cirugía de conservación y radioterapia: un análisis de 1225 pacientes. Cáncer 2003; 97:2530.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com