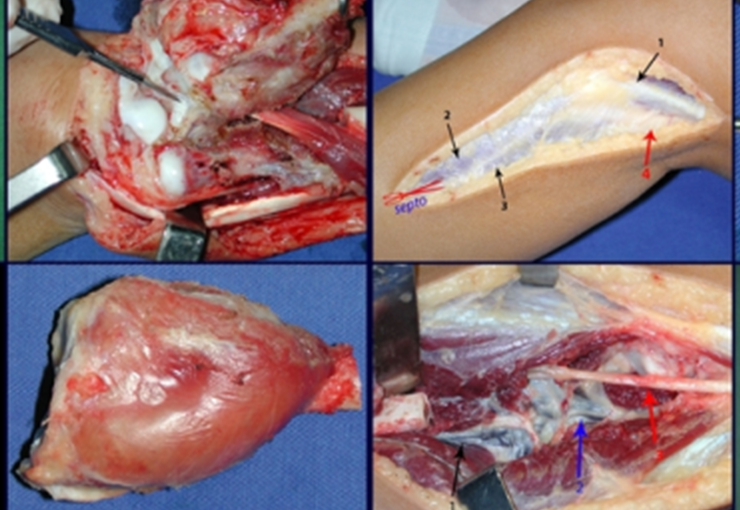
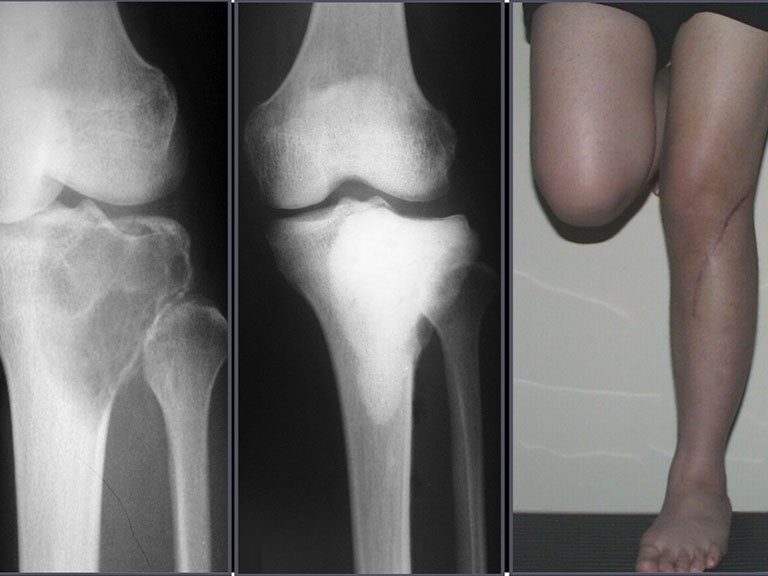
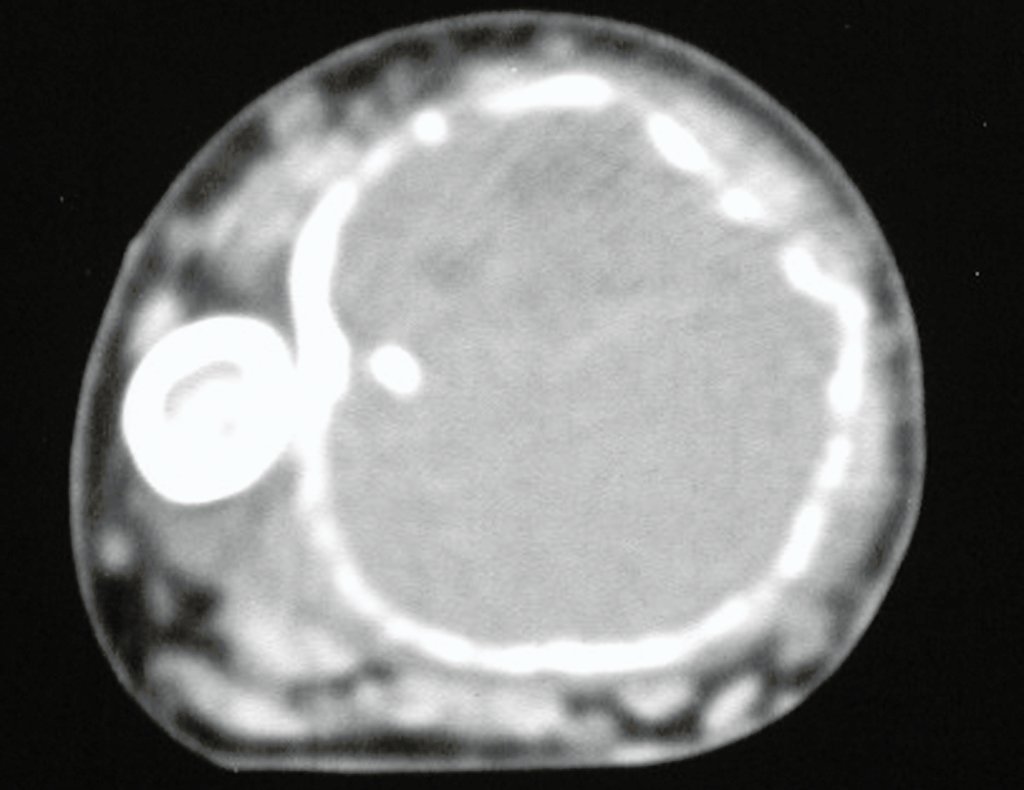
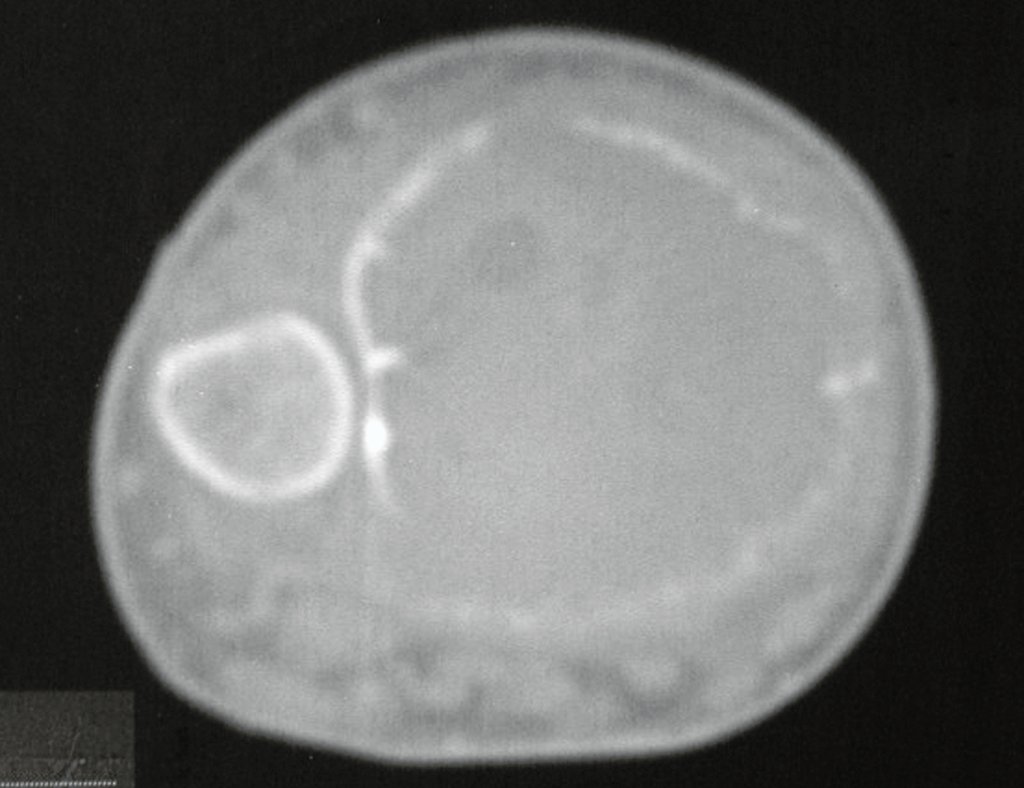
Tumor de células gigantes
Características, Diagnóstico y Tratamiento
El tumor de células gigantes, también conocido como TGC, es una neoplasia mesenquimatosa que se caracteriza por la proliferación de grandes células multinucleadas, llamadas gigantocitos. Estas células se parecen a los osteoclastos y se encuentran dentro de un estroma de células mononucleadas. Debido a su peculiar morfología histológica, el diagnóstico preciso suele requerir un análisis exhaustivo del cuadro clínico y radiográfico para evitar confusiones con otros procesos patológicos.
La principal manifestación de un tumor de células gigantes es el dolor local intermitente, a menudo acompañado de un aumento de volumen en la región afectada y restricción de los movimientos de las articulaciones adyacentes. El período de evolución varía de 6 a 12 meses, dependiendo del hueso afectado, siendo común el reporte de traumatismo como desencadenante inicial de los síntomas.
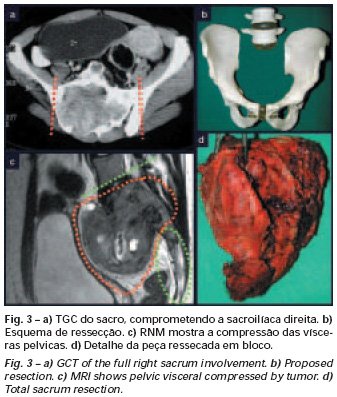
Este tipo de tumor suele afectar a un solo hueso, principalmente huesos largos como el fémur, la tibia, el húmero y el radio. Sin embargo, en casos más raros, puede ocurrir en huesos del esqueleto axial, con predilección por el sacro. La incidencia es más común entre la tercera y cuarta décadas de la vida, afectando a ambos sexos por igual.
Radiográficamente, el TGC se presenta como una lesión epifisaria caracterizada por rarefacción ósea, inicialmente excéntrica y posteriormente comprometiendo la corteza. La confirmación diagnóstica se obtiene mediante análisis histológico, que revela la presencia de células gigantes multinucleadas y estroma de células fusiformes.
El tratamiento de los tumores de células gigantes está bien establecido y apunta a la resección segmentaria de la lesión, siempre que sea posible, garantizando márgenes de seguridad tanto para el hueso como para los tejidos blandos. En los casos en los que la resección segmentaria no es factible, como en la columna cervical, está indicado el legrado endocavitario seguido de terapia adyuvante. Entre las opciones terapéuticas adyuvantes se encuentran el láser de CO2, el fenol diluido en alcohol al 4%, el nitrógeno líquido y la electrotermia.
La técnica electrotérmica ha demostrado ser eficaz para complementar el curetaje, proporcionando una limpieza más completa de la cavidad tumoral. Después de la electrotermia, se realiza el fresado de la cavidad utilizando instrumentos adecuados, como el taladro lento, para garantizar la eliminación completa de las células tumorales restantes.
El relleno de la cavidad tratada se puede realizar con diferentes materiales, como injerto óseo autólogo, sustitutos óseos o metilmetacrilato, cada uno con sus ventajas e inconvenientes. El seguimiento postratamiento es fundamental para controlar la recurrencia de la enfermedad y garantizar la eficacia del tratamiento realizado.
En resumen, el tumor de células gigantes es una patología compleja que requiere un abordaje multidisciplinar para garantizar el mejor resultado terapéutico y la calidad de vida del paciente. Los avances en las técnicas de diagnóstico y tratamiento han contribuido significativamente a mejorar el pronóstico de estos pacientes, ofreciendo opciones terapéuticas cada vez más efectivas y seguras.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Tumor de Células Gigantes
Tumor de células gigantes.
El tumor gigantocelular es una neoplasia de naturaleza mesenquimal, caracterizada por la proliferación de células gigantes multinucleadas –gigantecitos– que se asemejan a los osteoclastos, en medio de un estroma de células mononucleadas.
Debido a este aspecto histológico presente en varios otros procesos, el tumor gigantocelular podría confundirse, requiriendo muchas veces el análisis del aspecto clínico y radiológico para confirmar su diagnóstico.
El tumor de células gigantes también se conoce con las siglas TGC, con los nombres de tumor de células gigantes y osteoclastoma.
La principal manifestación es el dolor local intermitente, acompañado o no de aumento de volumen en la región afectada y limitación del movimiento en la articulación vecina. La duración de la historia, en promedio de 6 a 12 meses, varía de un caso a otro y depende del hueso afectado.
Algunos pacientes buscan tratamiento por dolor, otros por la percepción del tumor o de una fractura patológica. No es raro hacer referencia a un traumatismo más o menos intenso como inicio de la historia clínica.
Como el tumor suele ser epifisario, es frecuente la afectación clínica de la articulación vecina, con impotencia funcional progresiva.
Puede producirse derrame articular y síntomas clínicos que simulan procesos meniscales o artríticos.
En los tumores localizados en la columna y el sacro, además del dolor y el aumento de volumen, pueden presentarse manifestaciones neurológicas. El volumen es a veces enorme, predominando sobre los demás síntomas.
El tumor gigantocelular afecta generalmente a un solo hueso. Cuando existen lesiones en varios huesos se debe comprobar la posibilidad de que se trate de un “tumor marrón de hiperparatiroidismo”, cuyas lesiones tienen aspectos radiológicos similares, pero son múltiples y el paciente presenta alteraciones en el calcio y el fósforo.
El TCG se conoce clásicamente como un tumor de la epífisis de los huesos largos, más frecuente en la región de la rodilla, es decir, en la epífisis distal del fémur y epífisis proximal de la tibia y, luego, en orden de frecuencia, en la región proximal. del húmero y región distal del radio. Es raro en el esqueleto axial y cuando ocurre predomina en el sacro.
Ocurre en la tercera y cuarta década, afectando a ambos sexos por igual.
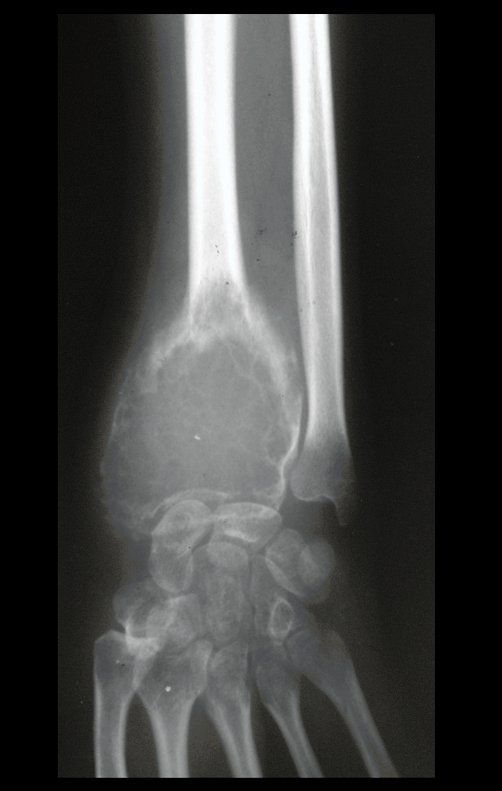
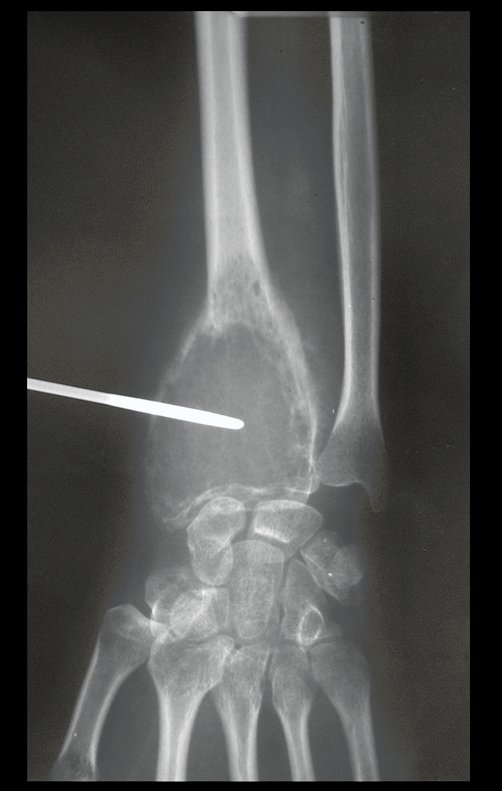
Radiológicamente se describe como una lesión epifisaria caracterizada por rarefacción ósea, inicialmente excéntrica, respetando inicialmente los límites corticales. A medida que avanza, puede producirse rotura cortical y afectación articular (fig. 27).
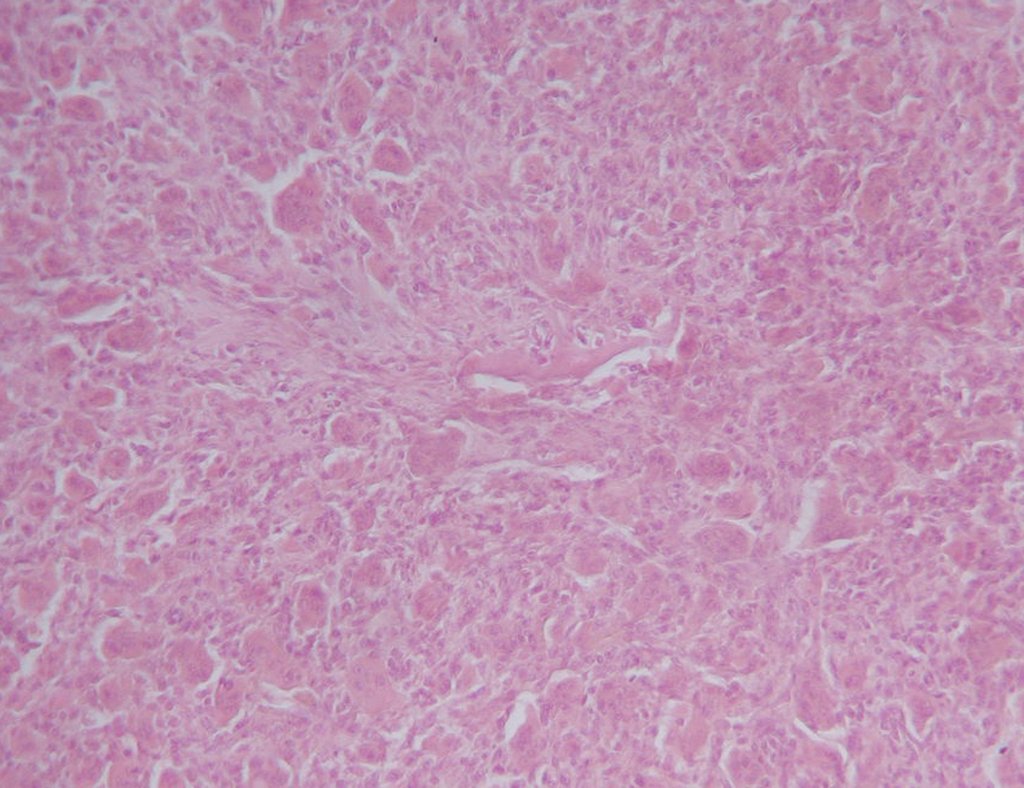
Histológicamente, las células gigantes y el estroma son los elementos más importantes de este tumor. Se caracteriza por tener numerosas células gigantes que se asemejan a los osteoclastos en un estroma de células fusiformes.
Los principales diagnósticos diferenciales clínicos, radiológicos y anatomopatológicos son el quiste óseo aneurismático, el osteosarcoma teleangectásico y el condroblastoma.
El tratamiento del tumor de células gigantes está actualmente bien establecido. Siempre que sea posible se debe optar por la resección segmentaria de la lesión, con margen de seguridad oncológica tanto en hueso como en tejidos blandos. De esta forma el cirujano brindará la mayor oportunidad de curación, sin riesgo de recurrencia.
Sin embargo, en regiones donde la resección segmentaria no es factible, como la columna cervical por ejemplo, se debe realizar el legrado endocavitario más sensato posible y complementarlo con terapia adyuvante como el láser de CO 2 , el fenol diluido en alcohol al 4%, el nitrógeno líquido y la electrotermia. El metilmetacrilato tiene un efecto adyuvante bajo y, cuando se utiliza para rellenar la cavidad, debe ir precedido de una de las terapias mencionadas.
En el pasado, el curetaje tenía altas tasas de recurrencia debido a la falta de grandes aberturas para una limpieza eficaz y la falta de uso de adyuvantes locales. Hoy en día, cuando está indicado el legrado endocavitario, se recomienda crear una ventana ósea grande para permitir al cirujano una visión amplia de la cavidad. Complementamos también este curetaje con el uso de un bisturí eléctrico (electrotermia).
Esta técnica electrotérmica es muy efectiva porque con la punta curva del bisturí podemos llegar a zonas de más difícil acceso. Este bisturí, además de cauterizar, también realiza un complemento al legrado, ya que aquellas células tumorales, que quedan en las pequeñas “cavidades” de la pared ósea, se destruyen y se desprenden, permitiendo su eliminación más fácil.
Complementamos nuestro curetaje, tras utilizar electrotermia, con el fresado de la cavidad. Para ello utilizamos el Lentodril , con una fresa dental esférica.
En la región de la rodilla (extremo distal del fémur y extremo proximal de la tibia), el sitio de mayor incidencia de CGT, recomendamos frecuentemente legrado endocavitario, seguido de electrotermia y fresado con Lentodril . Esto se debe a que la resección segmentaria de esta región implicaría artrodesis o sustitución por endoprótesis o injertos homólogos. La artrodesis de la articulación de la rodilla supone la mayor limitación para el paciente y debe evitarse. Los recambios en pacientes jóvenes pueden acarrear problemas en un futuro próximo y su indicación debe ser prudente.
Por ello, recomendamos en primer lugar la terapia más conservadora: – legrado seguido de terapia adyuvante en esta región, excepto en casos avanzados, con destrucción importante de la estructura ósea, en los que puede verse comprometido tanto la función como el control local de la enfermedad.
Queda un breve comentario sobre el llenado de la cavidad tratada. Esto se puede realizar con injerto óseo autólogo o heterólogo o con metacrilato de metilo, cada uno de ellos tiene sus ventajas y desventajas.
El metacrilato de metilo permite visualizar fácilmente posibles recurrencias, es fácil de usar y permite una carga más temprana, sin embargo no es una solución biológica y pueden ocurrir fracturas en la región.
El injerto óseo es una solución biológica y definitiva, sin embargo dificulta visualizar una posible recidiva temprana, que puede confundirse con reabsorción/integración del injerto y aún requiere seis meses en promedio para su carga completa. El injerto homólogo tiene un período de integración más largo, no siempre está disponible, pero por otro lado acorta el tiempo quirúrgico. El injerto autólogo tiene la ventaja de una biocompatibilidad y una integración más rápida, pero prolonga el tiempo quirúrgico.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
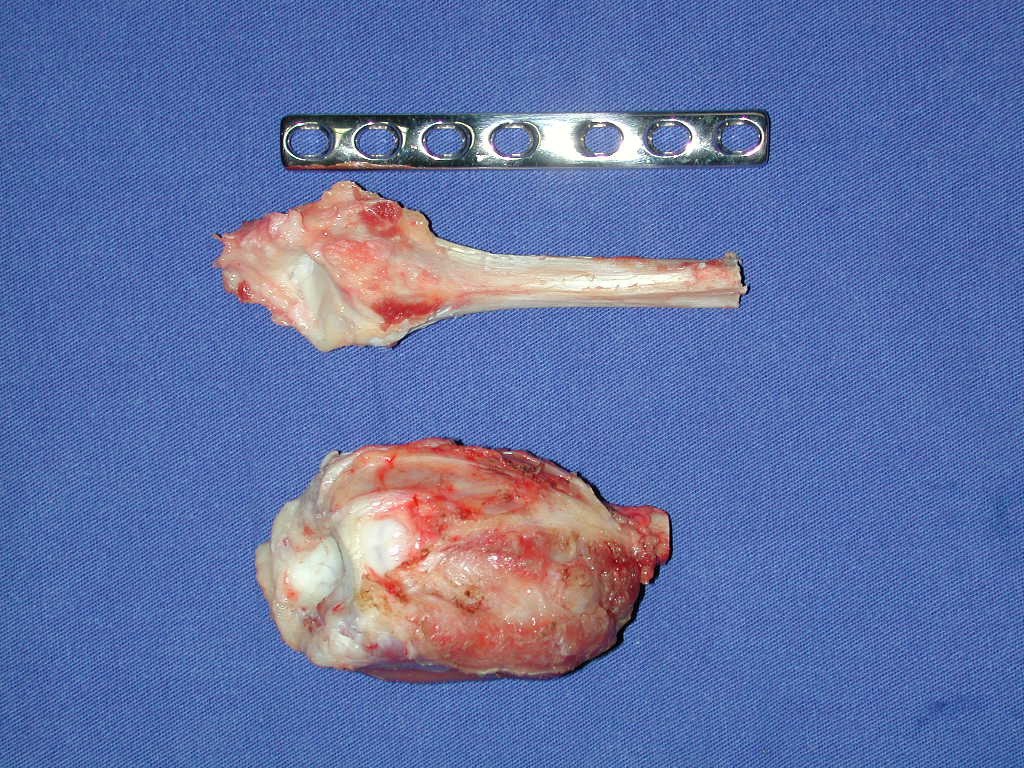
Tumor radial de células gigantes – Técnica de resección del tumor – Técnica de obtención de injerto autólogo de peroné – Técnica de reconstrucción de muñeca

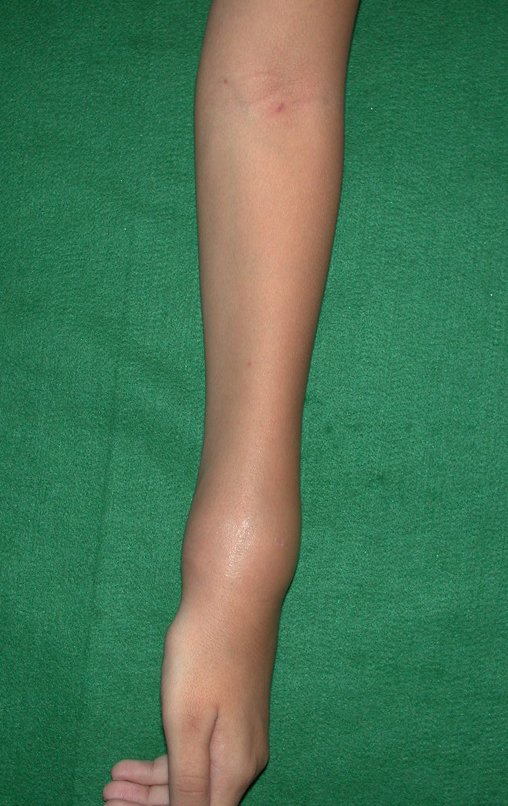
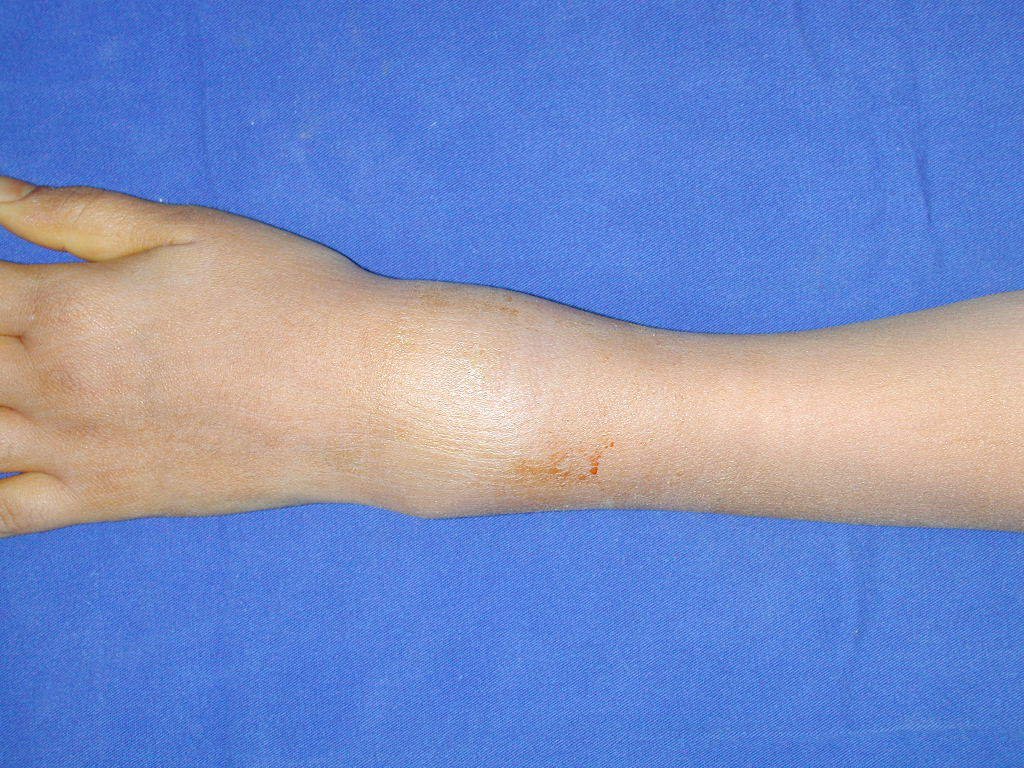
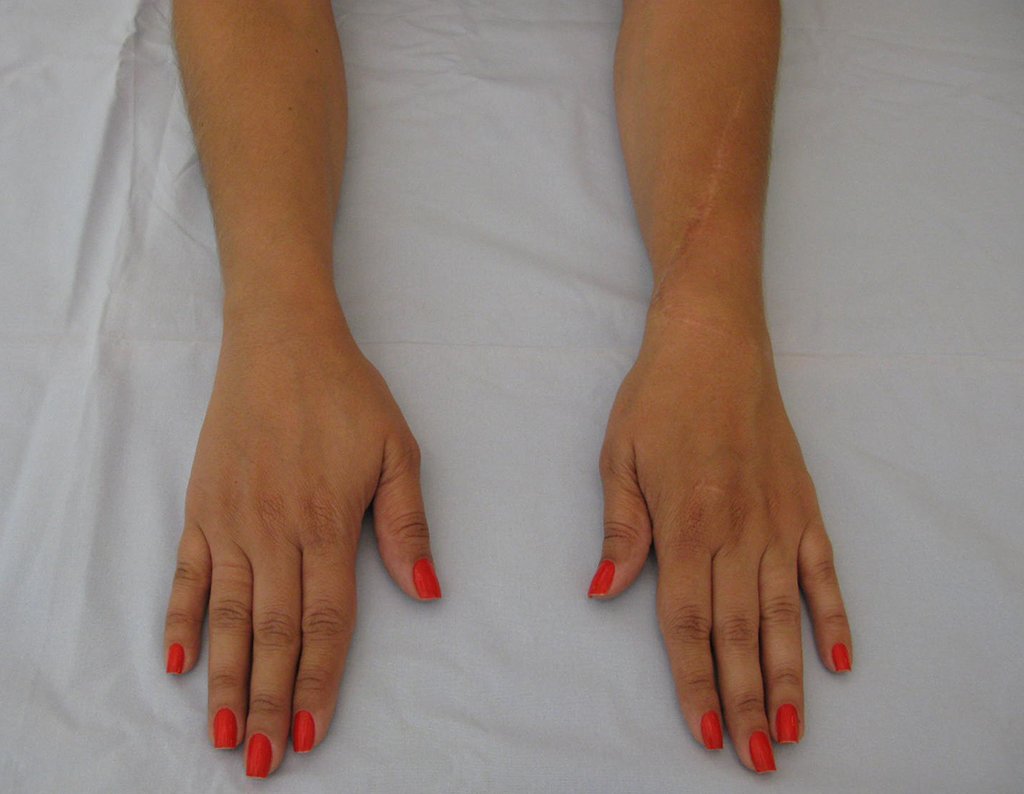
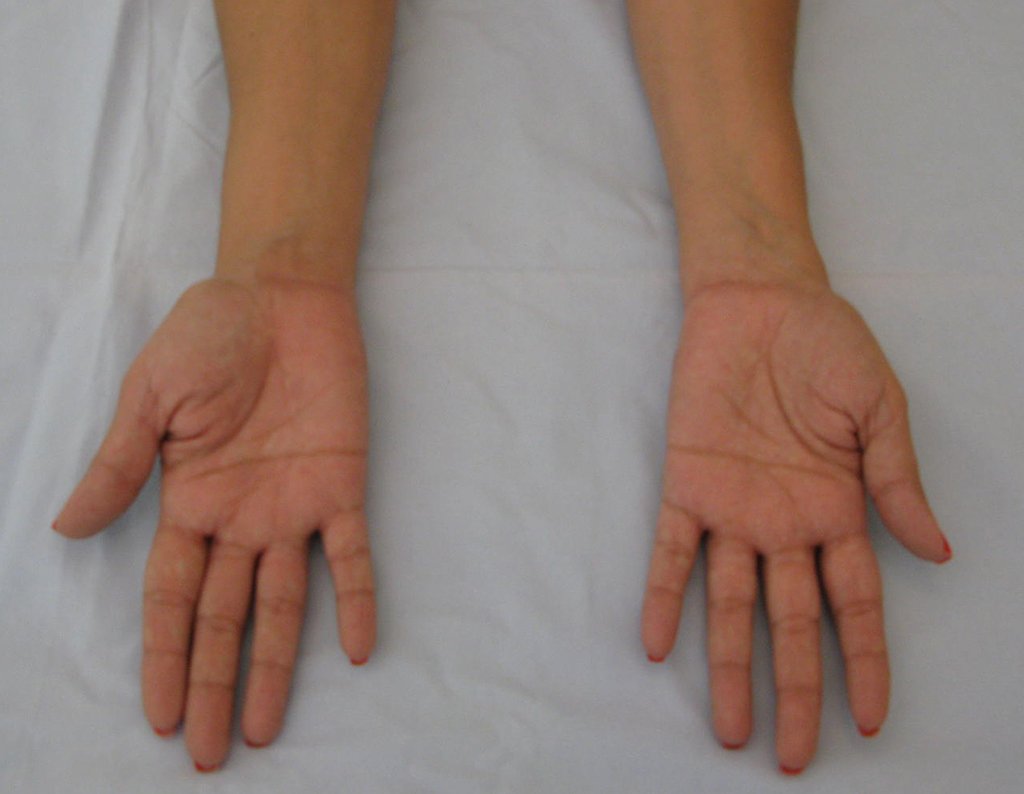
En Mayo de 2005, con sospecha de tumor de células gigantes, fue referida a un segundo hospital, cinco meses después de la primera atención. Se hizo nueva referencia ahora para nuestra atención, en Octubre del mismo año (Figuras 7 a 10).
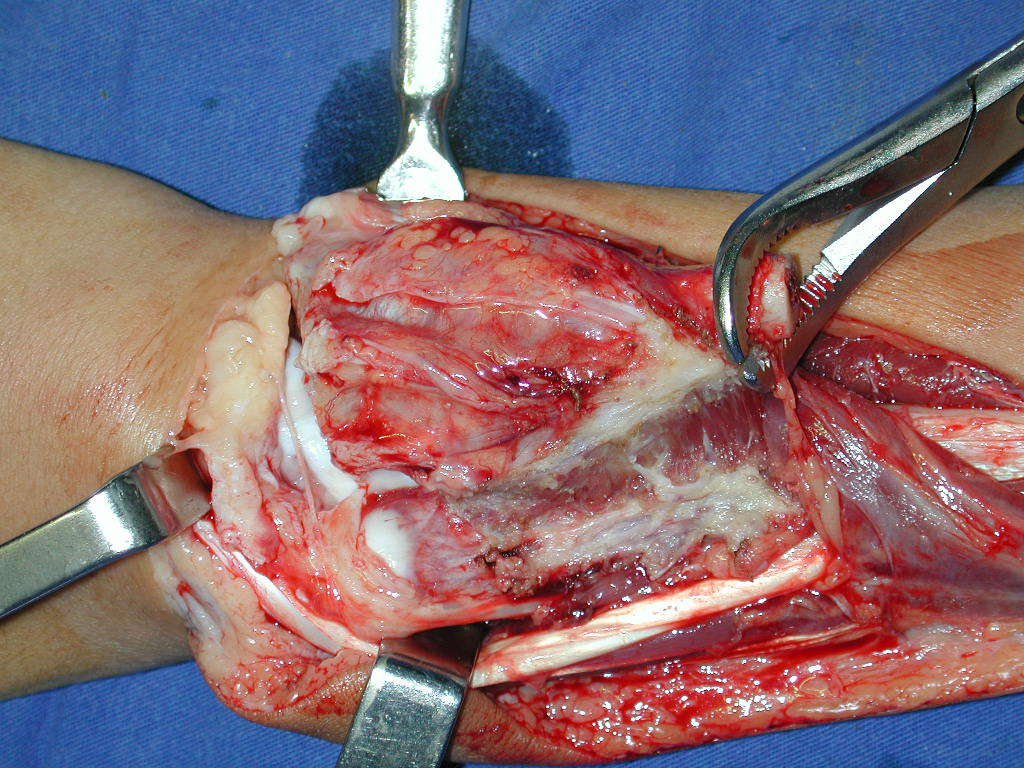
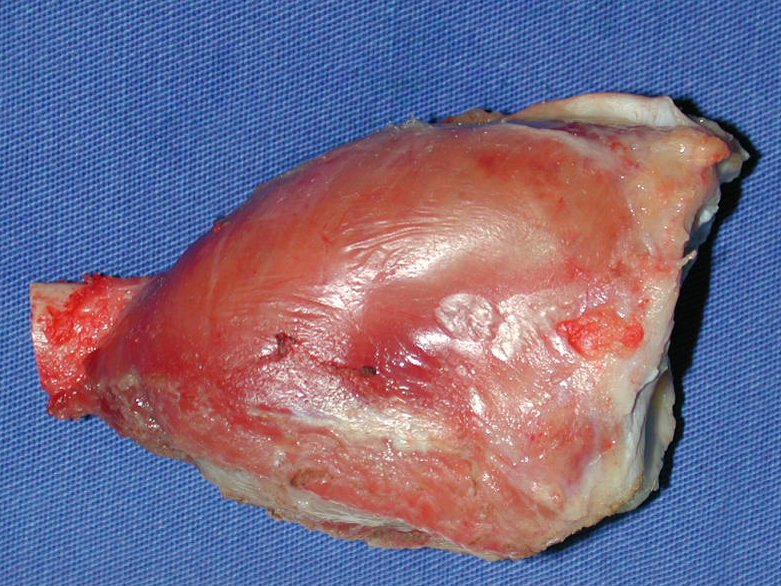
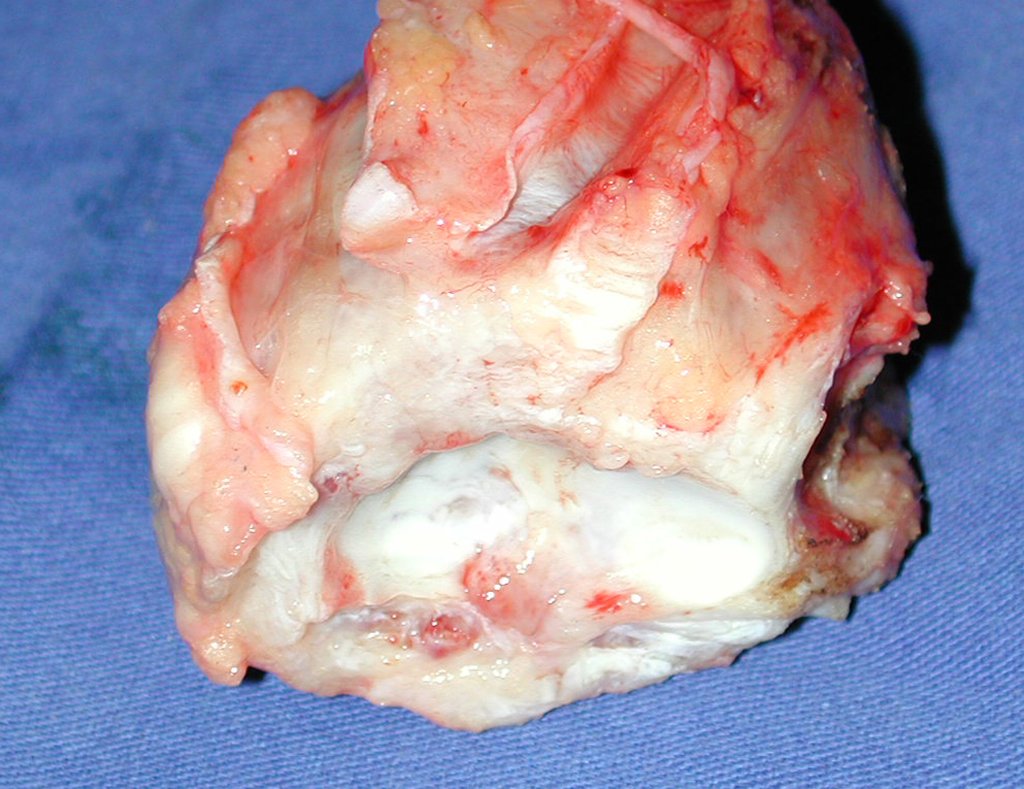
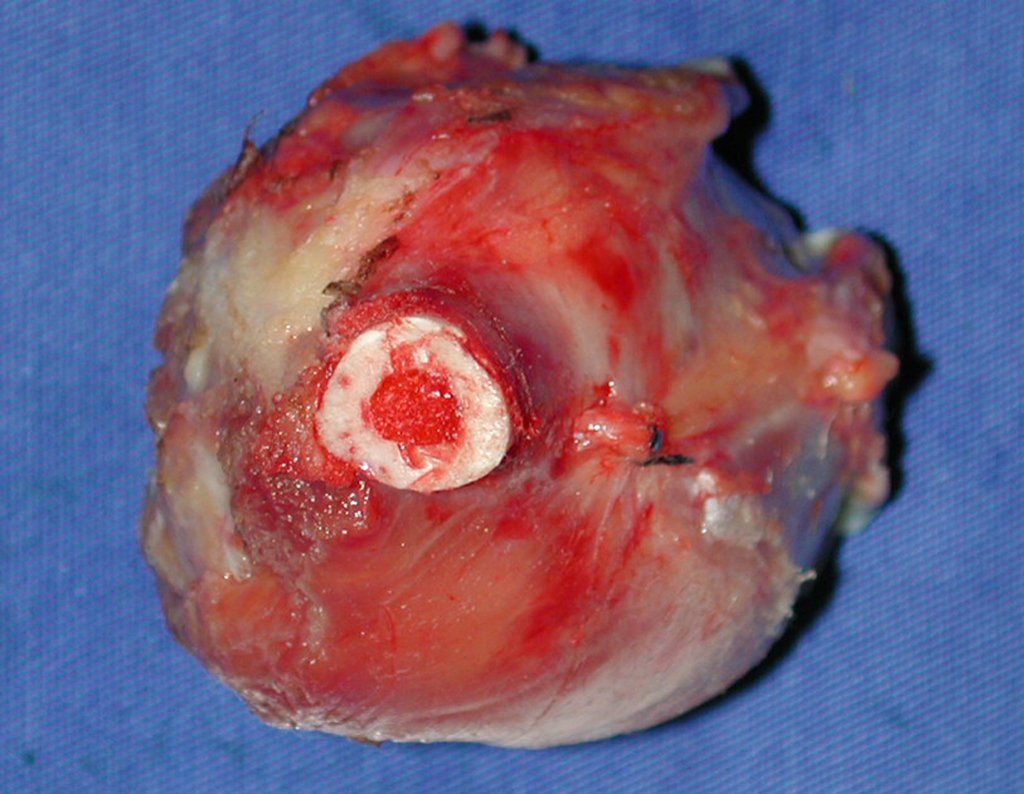
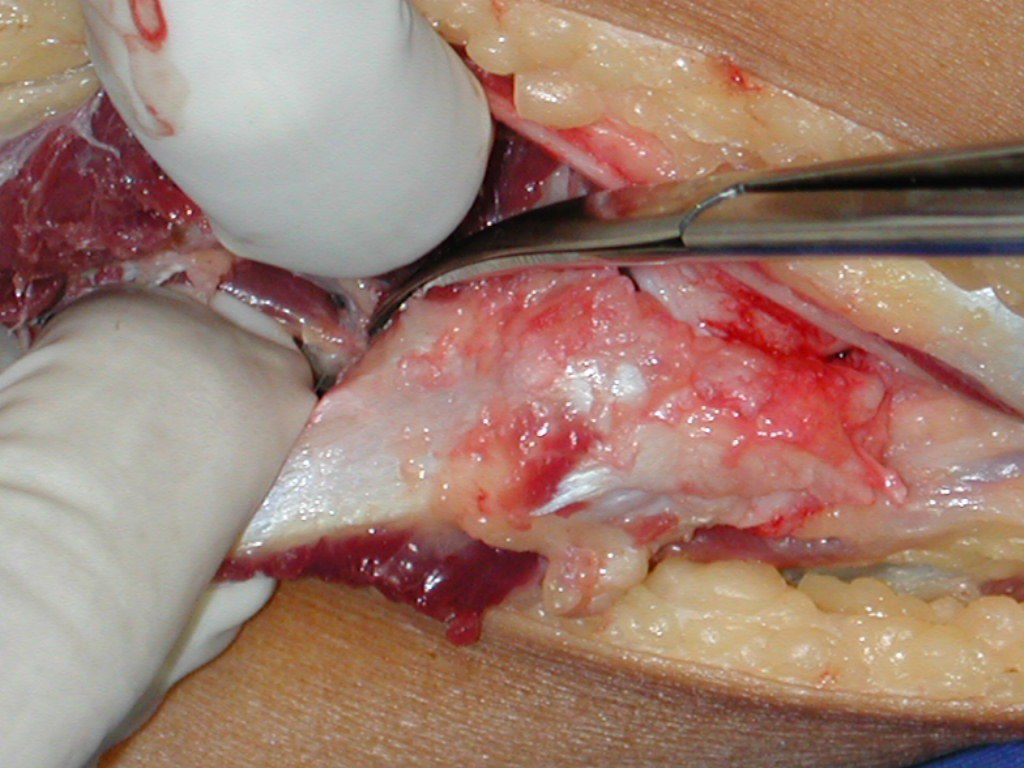
La demora de la atención compromete el tratamiento. La lesión evoluciona, destruye la estructura ósea, fractura y requiere procedimientos quirúrgicos mayores. En esta ocasión fue realizado el estadiamiento del tumor, que no presentó otro foco de enfermedad. Fue realizada la biopsia de la lesión, con aguja de Jamshidi con anestesia local y control radiológico, planificación de resección y aspecto clínico pre operatorio (Figuras 11 a 18).
El diagnóstico histológico de la biopsia confirma la sospecha clínica de tumor de células gigantes (Figura 19 a 24).
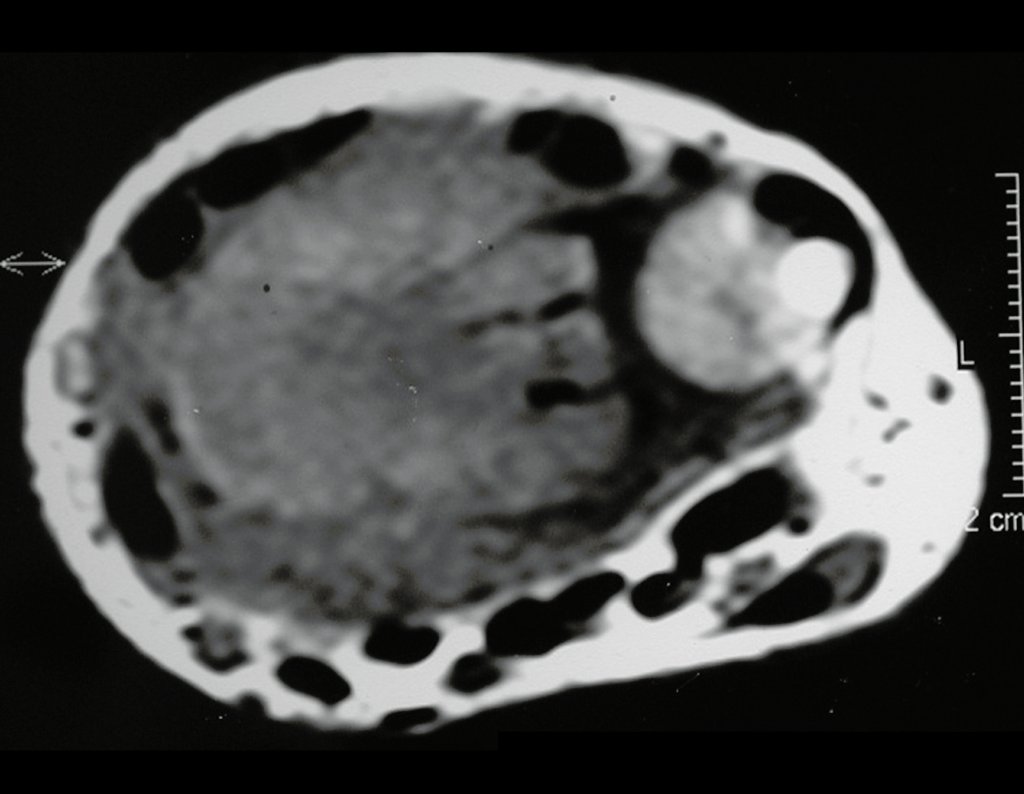
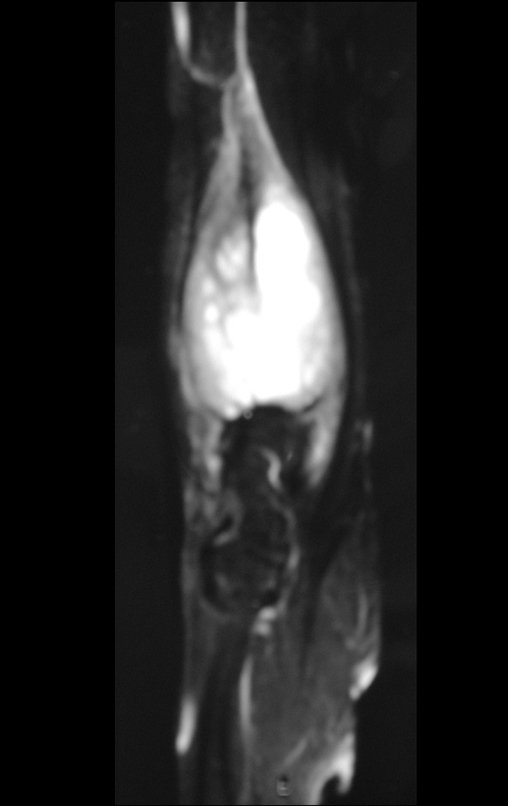
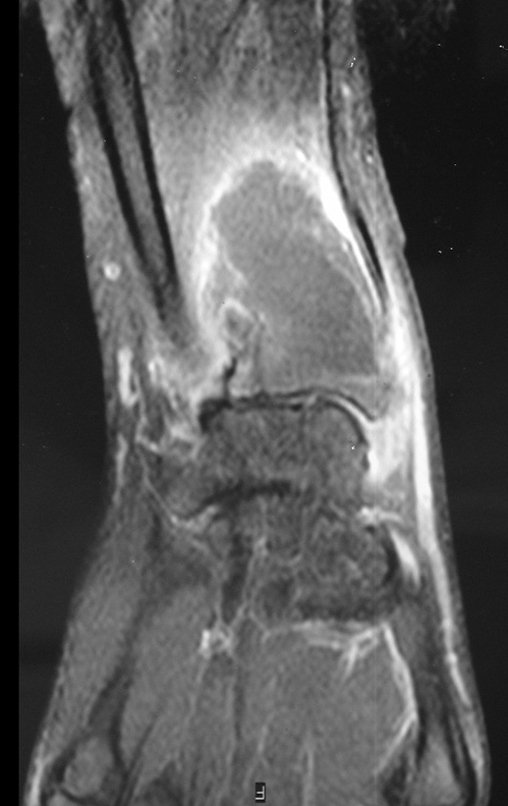
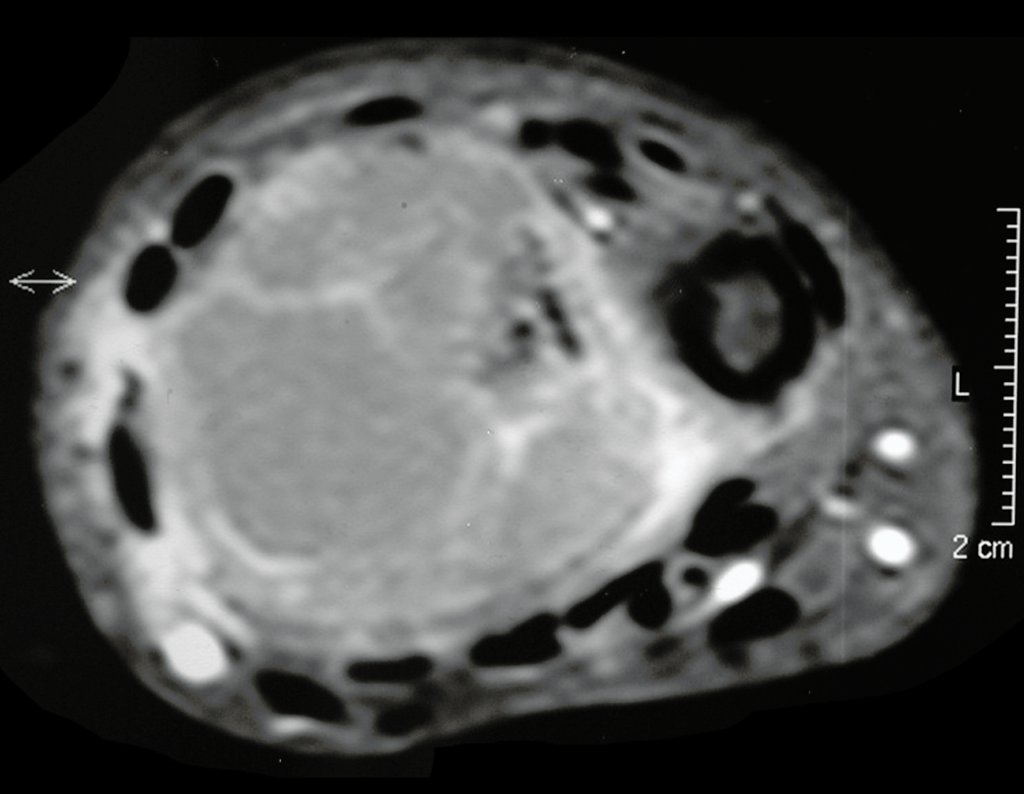
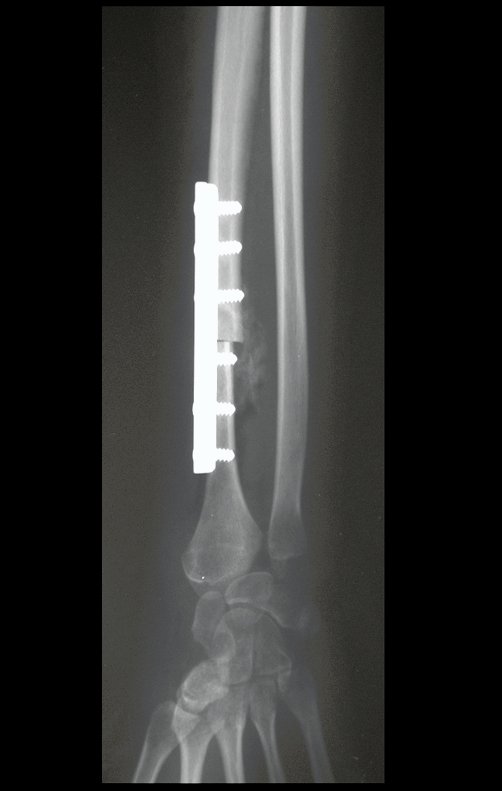
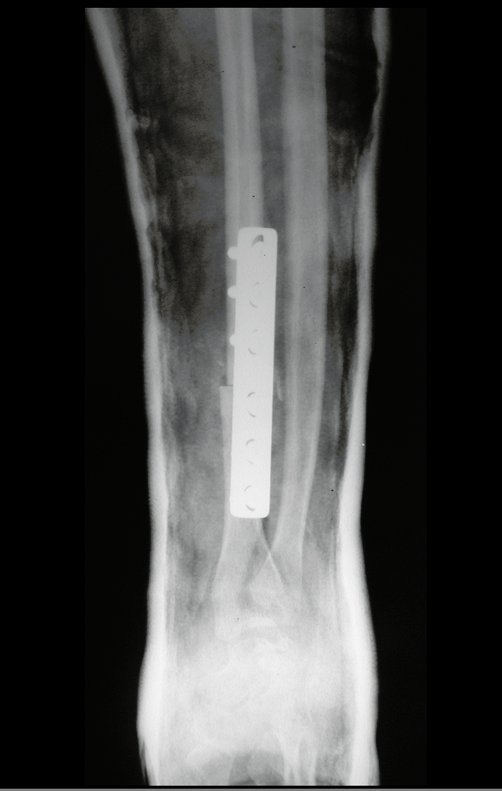
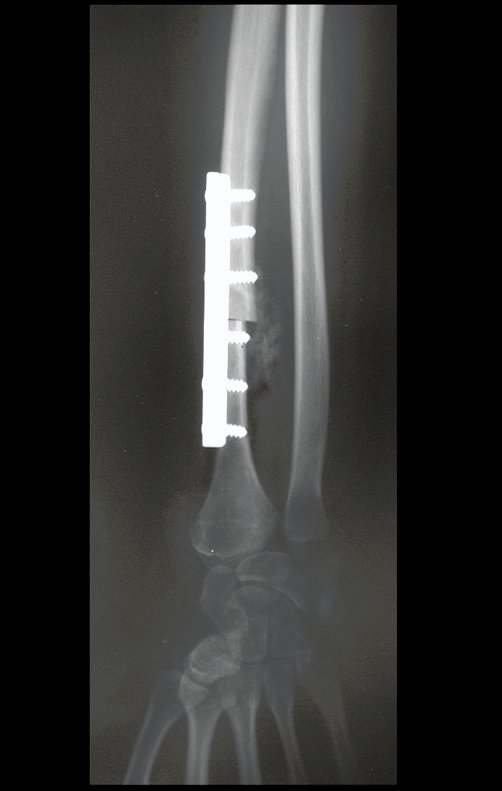
El estudio de resonancia magnética muestra lesión de rarefacción ósea, con áreas de necrosis, erosión, insuflación y fractura e infracción de la cortical, con deformidad y hundimiento de la superficie articular (figuras 25 à 36).
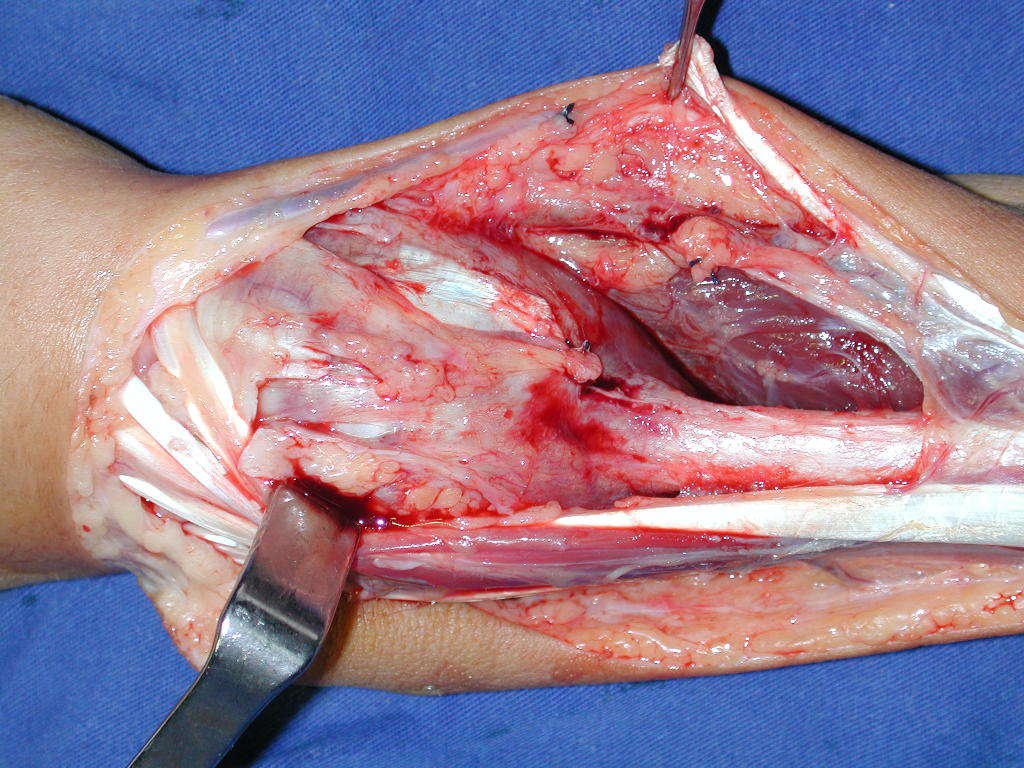
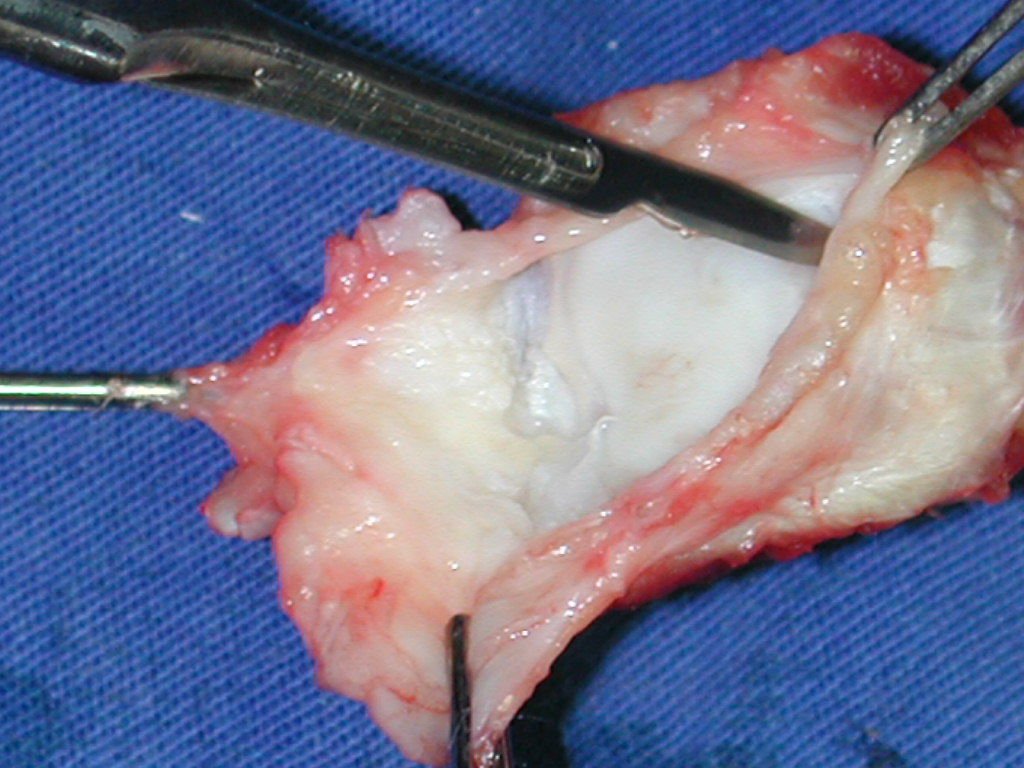
Con este estudio, confirmamos la agresividad local del tumor y la gran destrucción de la extremidad distal del radio izquierdo, con fractura por infracción, deformidad articular y hundimiento del radio. En esta situación el tratamiento intralesional esta contraindicado, debido a las altas posibilidades de recidiva local, además de perdida de la función. Oncológicamente esta indicada la resección segmentaria del radio y reconstrucción de la muñeca. La artrodesis puede ser una alternativa, mas preferimos preservar la función y la anatomía de la muñeca, siempre que sea posible. En este caso optamos por reconstruir con injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral, que imita mejor al radio.
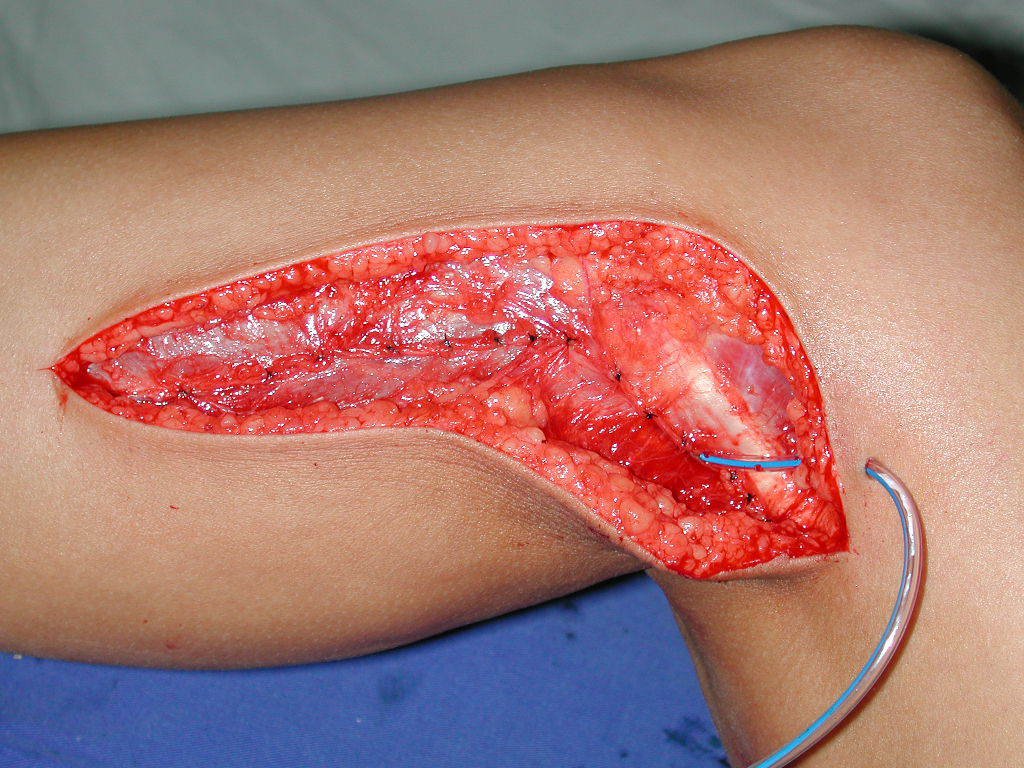
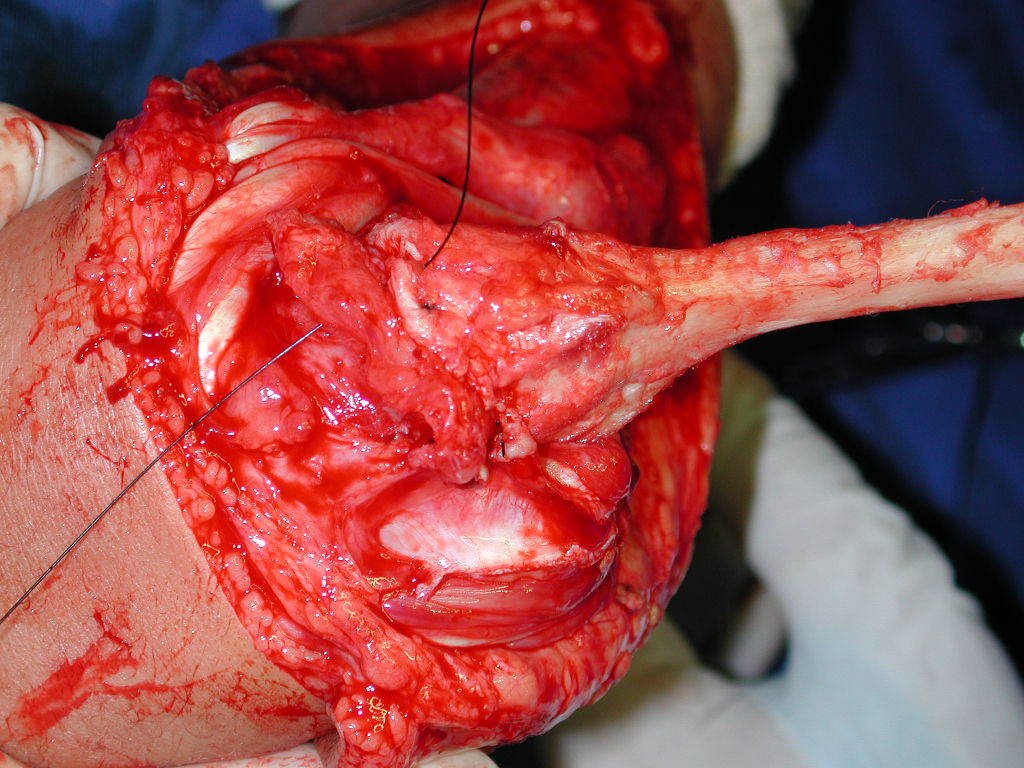
La cirugía es realizada en decúbito dorsal horizontal, preferiblemente sin uso de vaciamiento del miembro. Los detalles de la resección los mostramos en las figuras 38 a 57.
Después de la resección del segmento distal del radio y la revisión cuidadosa de la hemostasia, colocamos compresas humedecidas con suero fisiológico en lecho quirúrgico y enfajamos con faja crepe.
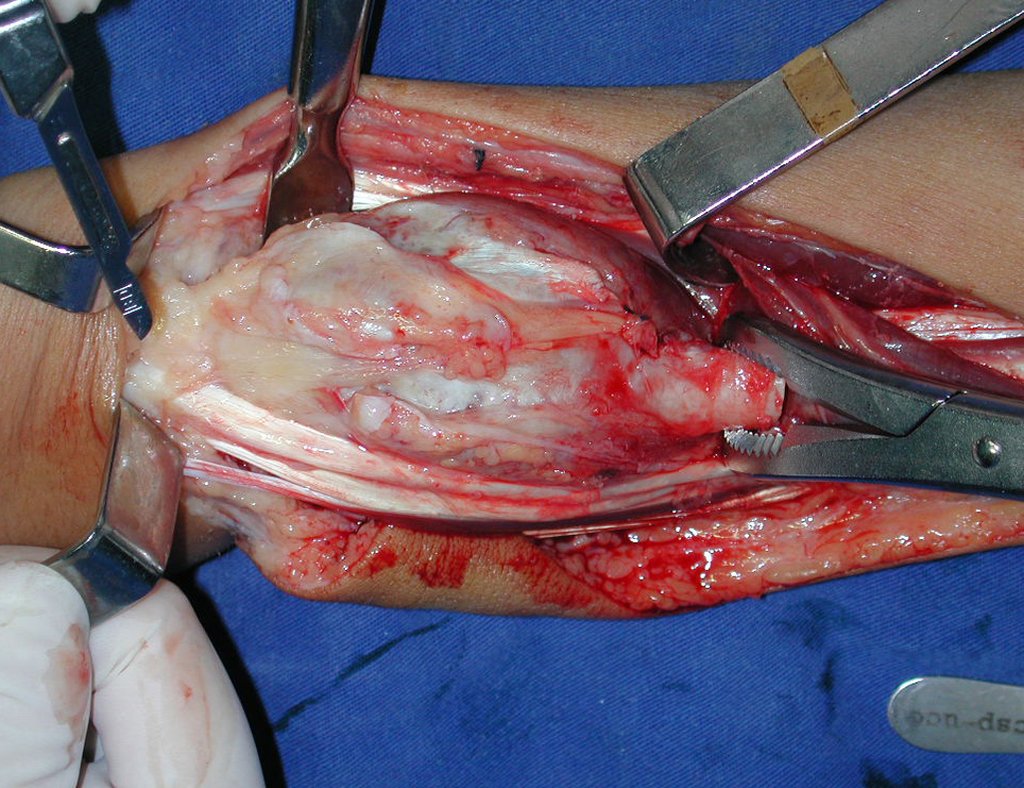
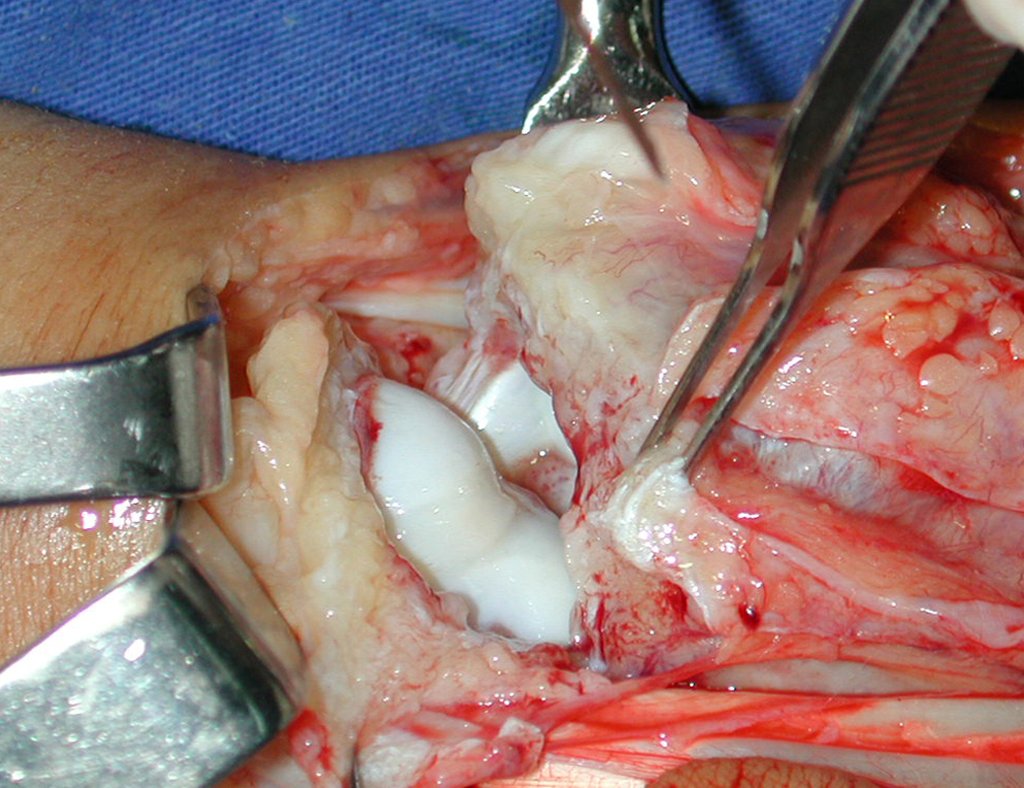
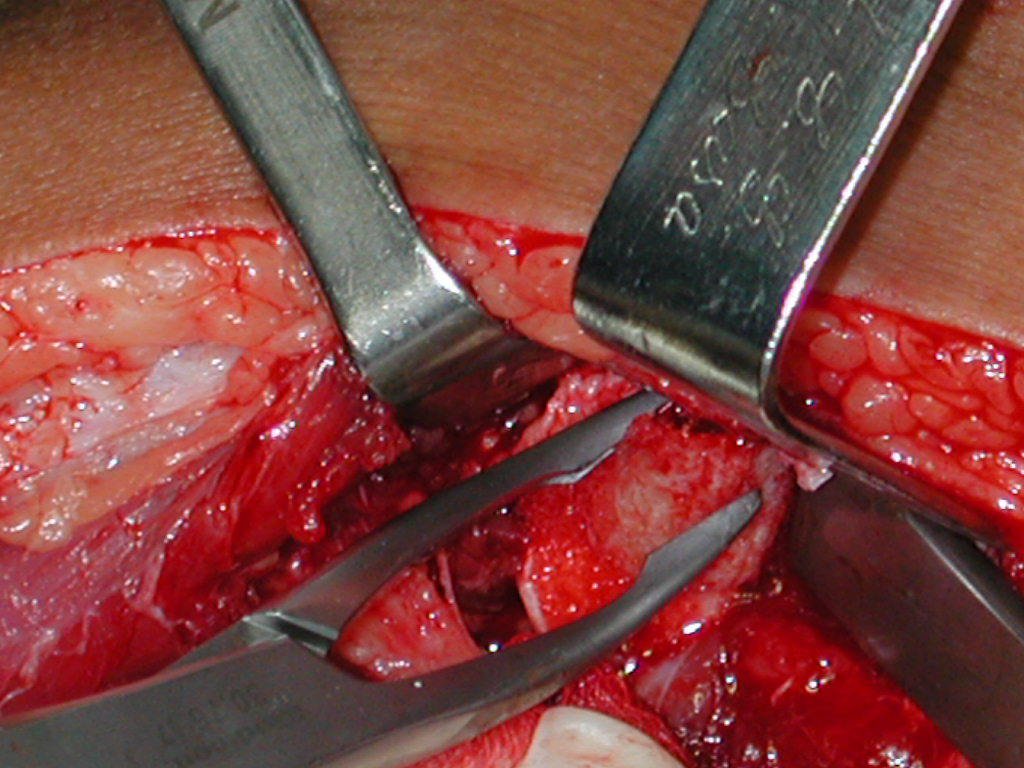
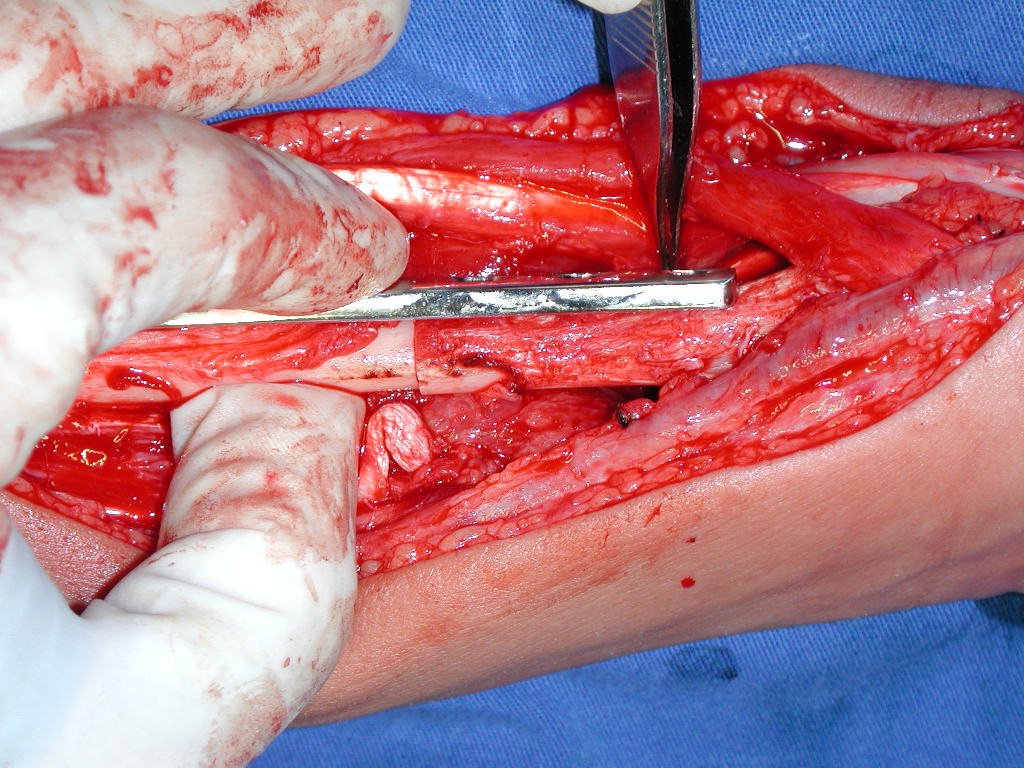
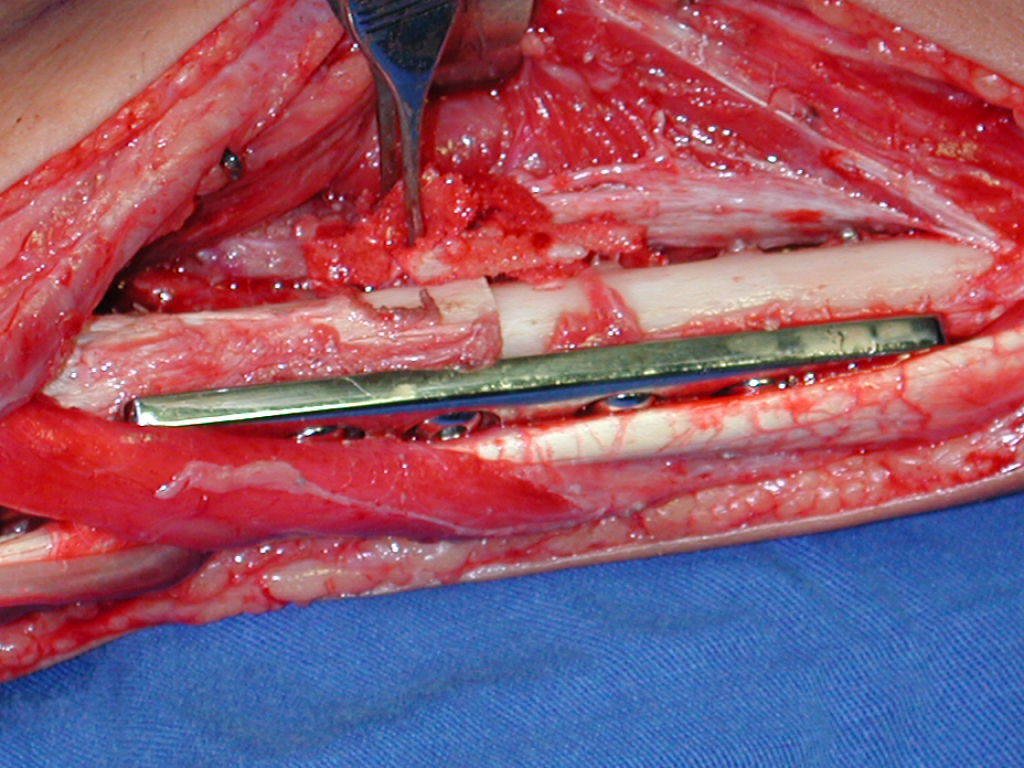
Pasamos para la segunda etapa: la obtención del injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral. Es preferible utilizar un injerto obtenido del mismo lado, pues la cara lateral del peroné y la tuberosidad de inserción del ligamento colateral lateral imitan mejor la cara dorsal del radio del mismo lado. De esta forma la pieza del peroné sustituirá a la estiloide radial.
Es importante obtener este injerto con capsula articular de la articulación tibio-peroneal proximal en toda la circunferencia de la epífisis peroneal.
De esta manera tendremos tejidos blandos para la reconstrucción circunferencial de la nueva articulación peroneo-carpal. A continuación detallamos la obtención del injerto del peroné (Figuras 58 à 75).


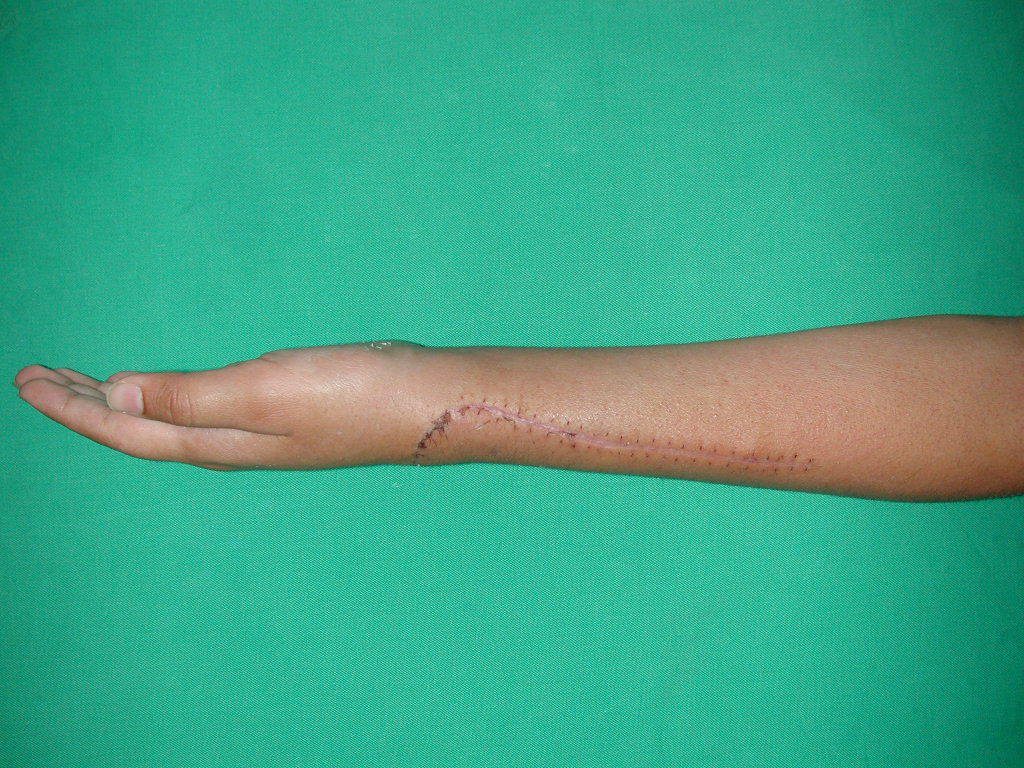
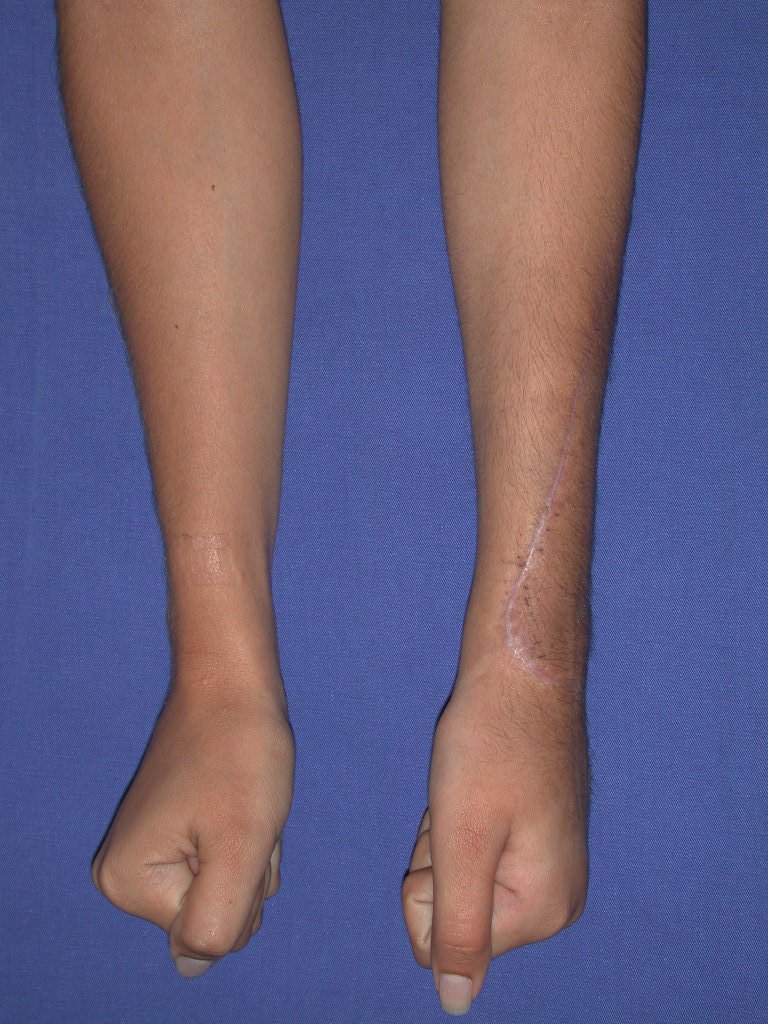
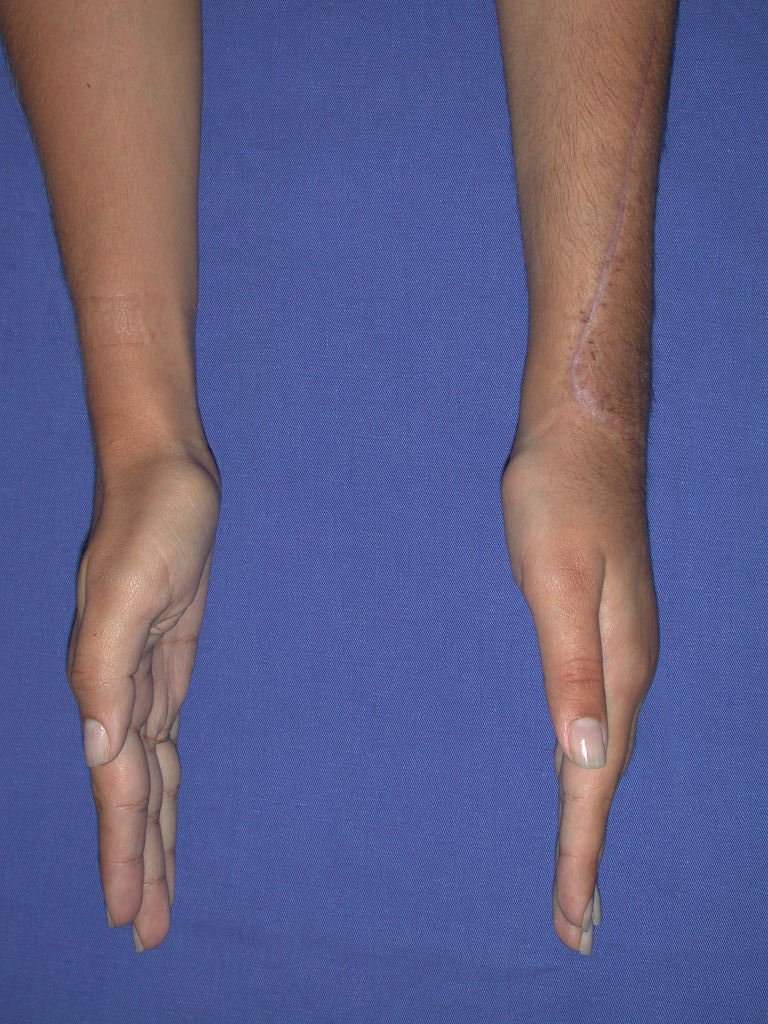
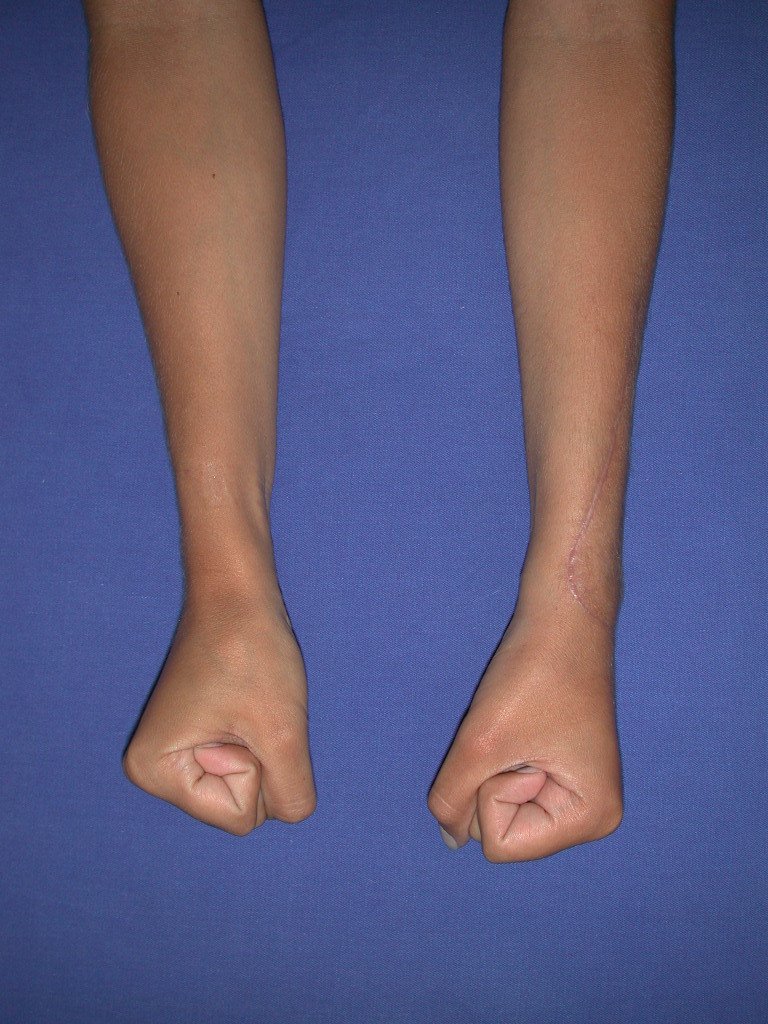
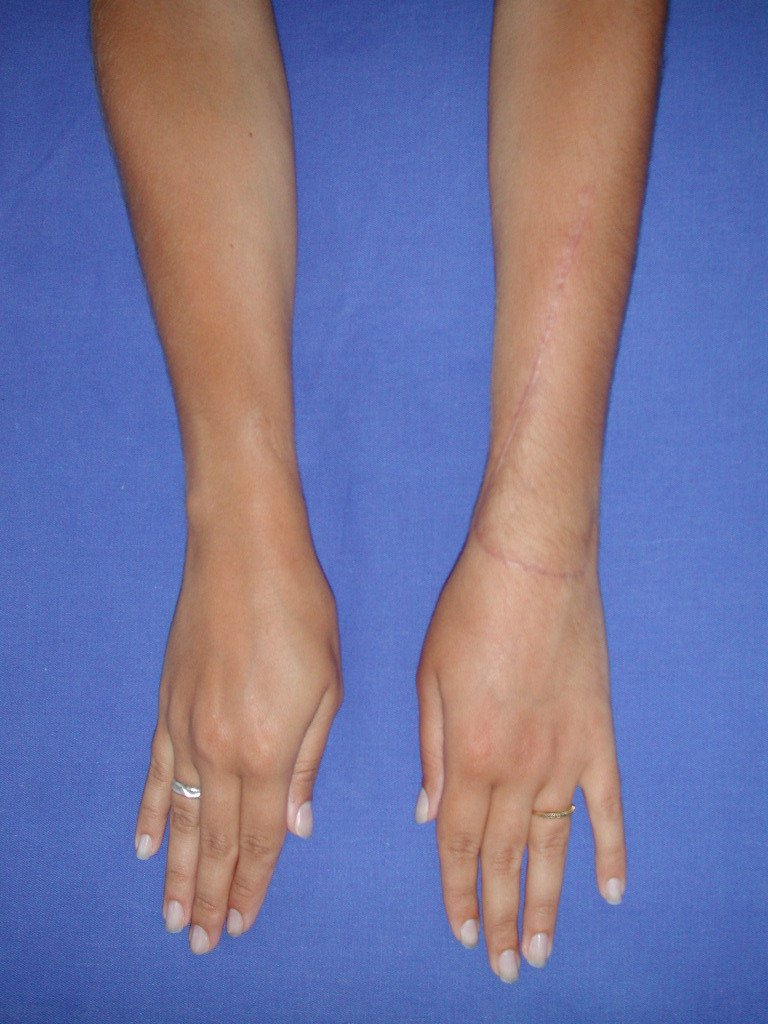
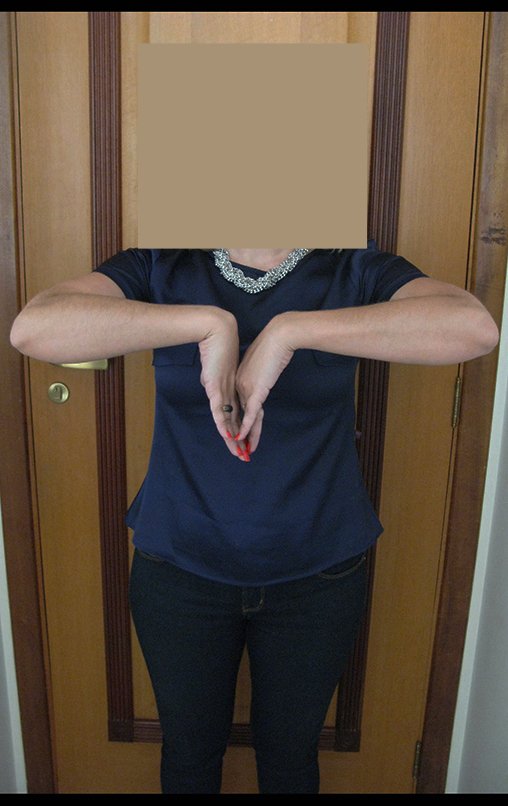
Vídeo 1: Supinação e pronação ativa e simétrica dos punhos, seis meses após a cirurgia. Boa função.
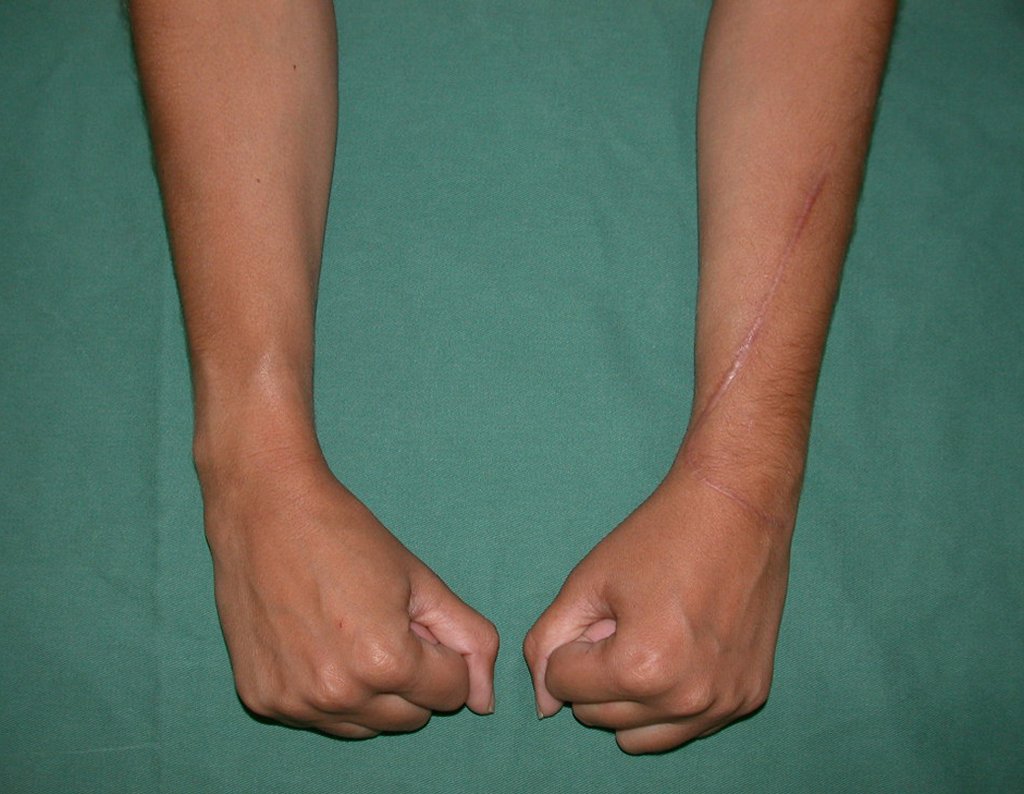
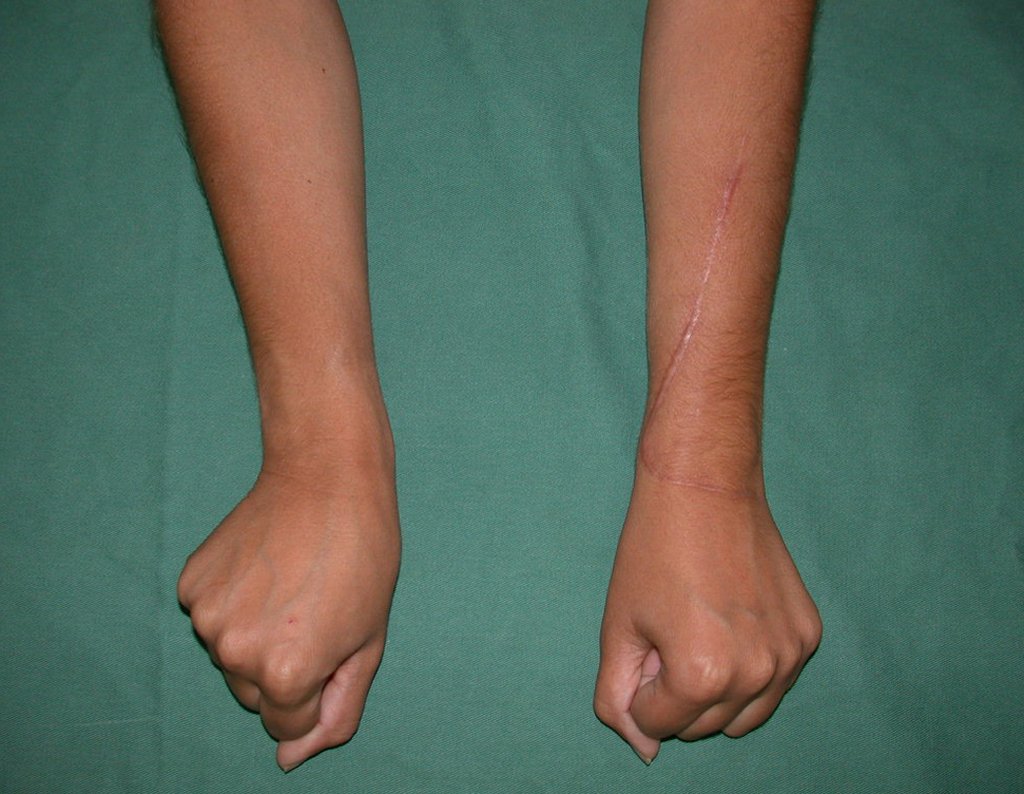
Vídeo 2: Flexão e extensão ativa e simétrica dos dedos, após seis meses. Boa função.
Vídeo 3: Pronação e supinação simétrica, após quinze anos da cirurgia.
Vídeo 4: Flexão e extensão em 29 de setembro de 2015, após quinze anos de pós-operatório.
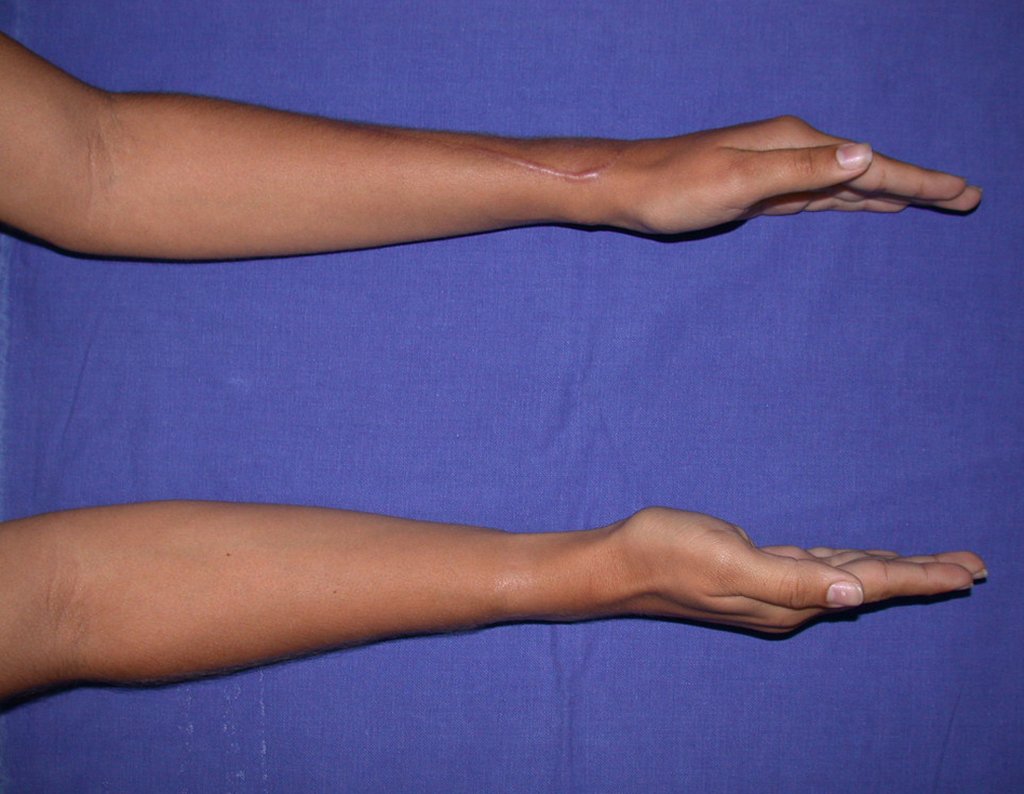
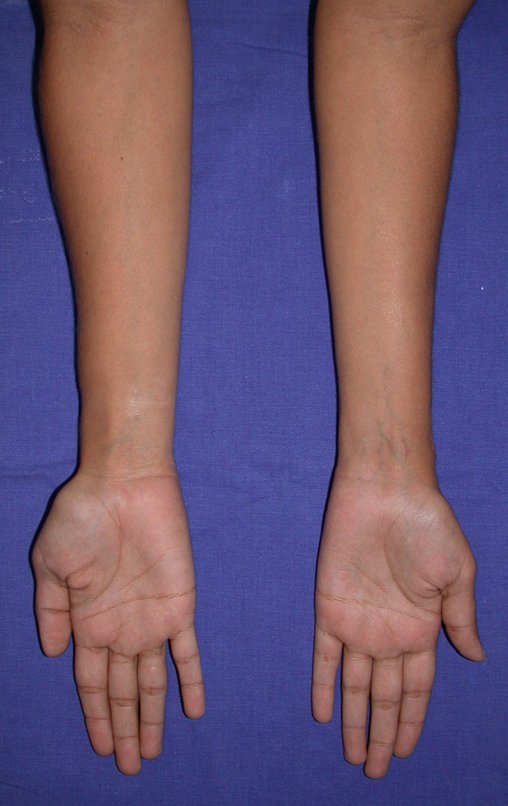
Vídeo 5: Atitude indiferente e espontânea dos punhos. Boa simetria e função em 29/15/2015. Pós-operatório de quinze anos.
Vídeo 6: Boa força muscular e estabilidade do punho esquerdo, levantando significativo peso após 19 anos de cirurgia, em 22 de agosto de 2019.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
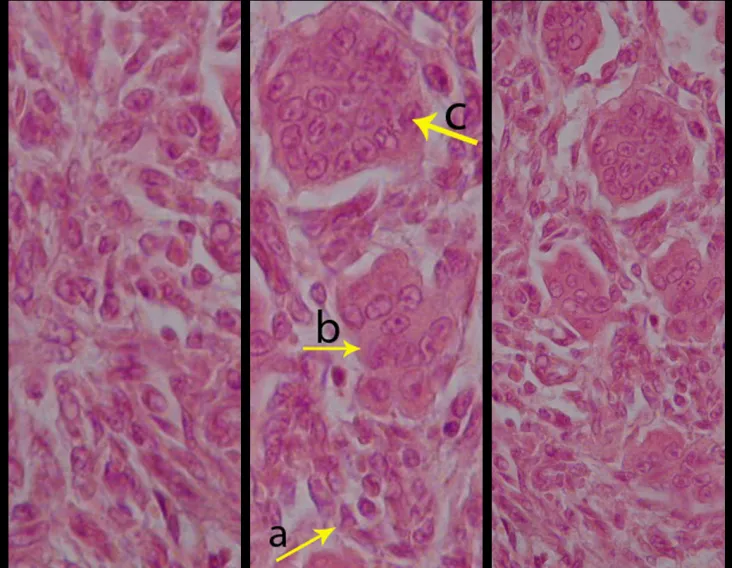
El tumor de células gigantes es una neoplasia de naturaleza mesenquimal, caracterizada por la proliferación de células gigantes multinucleadas (gigantócitos) que se asemejan a los osteoclastos, en medio de un estroma de células mononucleadas (fig. 1a). También se conoce como osteoclastoma y tumor giganto-celular, siendo común el uso de las siglas TCG o TGC. Fue descrito por primera vez por Sir Astley Cooper en 1818. Posteriormente, Paget (1853) lo denominó “tumor marrón o mieloide”. Nelaton (1860) describió sus características clínicas e histológicas, resaltando su agresividad local y dándole el nombre de “tumor a mieloplaxias”. Gross (1879) insistió en su benignidad y destacó las dificultades en el diagnóstico diferencial con “la variante aneurismática del sarcoma medular”. Con el advenimiento de la radiología, se mejoró el diagnóstico diferencial de esta lesión y Bloodgood (1923) propuso la denominación de “tumor benigno de células gigantes.
Tumor de células gigantes
En las últimas décadas, se ha discutido mucho sobre la naturaleza del tumor giganto-celular. Para Geschikter y Copeland (1949) y Willis (1949), el tumor giganto-celular sería una neoplasia de osteoclastos en medio de estroma mesenquimal, dada la similitud entre el gigantócito y el osteoclasto normal.
Jaffe et al. (1940) describieron su origen como derivado de las células del estroma. Sherman (1965) afirmó que el hueso desaparecía en el lugar de crecimiento del tumor y los gigantócitos resultarían de la fusión de las células mesenquimales del estroma, teniendo en cuenta la similitud entre la microscopía óptica de los núcleos del estroma y de las células gigantes. Los trabajos de histoquímica y cultivo de tejidos realizados por Schajowicz (1961) no demostraron diferencias significativas entre los gigantócitos tumorales y los osteoclastos normales. Por otro lado, estudios utilizando microscopía electrónica confirmaron que las células gigantes son sincitios constituidos por células del estroma. Así, las células mesenquimales indiferenciadas de la médula ósea darían origen al estroma tumoral, cuyas células, a su vez, al diferenciarse, formarían conglomerados con las características de los gigantócitos. Las numerosas células gigantes que se asemejan a los osteoclastos, en medio de un estroma de células fusiformes, son los elementos más importantes de este tumor. El aspecto histológico del TGC presenta características comunes a diversas lesiones tumorales y seudotumorales, por lo que es necesaria un análisis conjunto con las características clínicas y de imagen para confirmar el diagnóstico.
Empleamos la eletrotermia como adyuvante local, utilizando para ello el bisturí eléctrico. Esta técnica de eletrotermia es eficaz, ya que con la punta curva del bisturí podemos alcanzar áreas de acceso más difícil. La eletrotermia, además de la cauterización, también complementa el curetaje, ya que las células tumorales remanentes en las pequeñas “cavidades” de la pared ósea son destruidas y se desprenden, facilitando su eliminación. La eletrotermia debe preceder al fresado, evitando una posible diseminación de las células debido a la rotación del Lentodrill. En la región de la rodilla, frecuentemente indicamos el curetaje endocavitario seguido de eletrotermia y fresado con Lentodrill. Esto se debe a que la resección segmentaria de esta región implicaría artrodesis o sustitución por endoprótesis o injerto homólogo osteoarticular.
El metilmetacrilato permite visualizar fácilmente posibles recidivas, es de fácil aplicación y permite la carga precoz; sin embargo, no es una solución biológica y pueden ocurrir fracturas en la región.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com